вправ. ХИМИЯ ЛЕКЦИИ 6. Лекция. Электролиты в организме человека. Электрохимия
 Скачать 1.39 Mb. Скачать 1.39 Mb.
|
Лекция. Электролиты в организме человека. Электрохимия.ЭЛЕКТРОЛИТЫ В ОРГАНИЗМЕ ЧЕЛОВЕКА.Все биологические системы содержат ионы, которые образуются при диссоциации веществ-электролитов. Ионный состав некоторых биожидкостей в ммоль/л представлен в следующей таблице. Таблица 1. 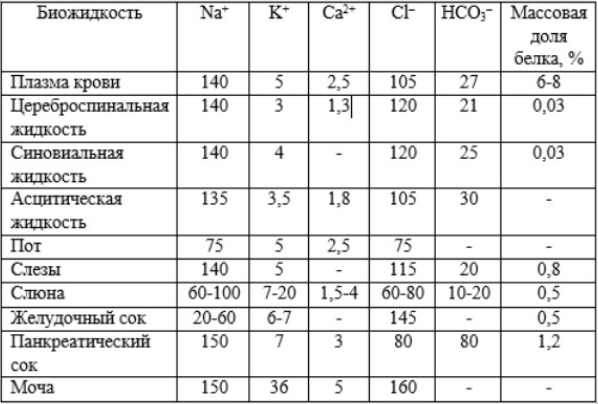 Электролиты играют очень важную роль в жизнедеятельности организмов: 1) поддерживают на определенном уровне осмотическое давление; 2) препятствуют обезвоживанию организма, т.к. удерживают воду в виде гидратов; 3) обеспечивают кислотно-щелочное равновесие; 4) необходимы для деятельности нервной системы, свертывания крови, всасывания, обмена газами, секреции и т.д. 5) природа биопотенциалов имеет ионный характер; 6) влияют на проницаемость клеточных мембран, на окислительно-восстановительные процессы, устойчивость биомакромолекул и скорость биохимических реакций; 7) особой физиологической активностью обладают ионы водорода и гидроксид-ионы, которые определяют кислотность внутренних сред организма, влияют на активность ферментов и других физиологически активных веществ. В норме содержание катионов в крови составляет в среднем 154 ммоль/л и приходится в основном на долю ионов натрия, калия, кальция и магния. Общее содержание анионов в плазме крови составляет тоже примерно 154 ммоль-экв/л, большая доля которых приходится на хлорид- и гидрокарбонат- ионы, а также многозарядные ионы белков. В меньших концентрациях присутствуют также ионы примерно 50 других элементов, которые в основном находятся в форме комплексных ионов сложного строения. При патологиях наблюдаются нарушения электролитного баланса. Например, при инфаркте миокарда снижается концентрация ионов калия в плазме крови и эритроцитах. Ионы неравномерно распределены между клетками и внеклеточной средой. Так, натрий - внеклеточный катион, его внеклеточная концентрация выше, чем внутри клетки. Калий, наоборот, внутриклеточный катион. Ионы в организме влияют друг на друга. Различают антагонизм ионов - ослабление одним ионом действия другого иона. Например, ионы калия замедляют сокращение сердечной мышцы, а их антагонисты - ионы кальция, - учащают ритм и увеличивают силу сердечных сокращений. Синергизм ионов - это усиление одним ионом действия другого иона. Например, ионы Зd- элементов, такие как Cu2+, Co2+, Mn2+, Zn2+ усиливают действие друг друга в процессе кроветворения. Некоторые ионы в одних случаях действуют как антагонисты, в других - как синергисты. Так, антагонизм ионов Са2+ и Mg2+ проявляется в том, что в отличие от Mg2+ ион Са2+ - внеклеточный катион. При длительном поступлении в организм избыточных количеств солей магния наблюдается усиленное выделение кальция из костной ткани и некоторых белков. Синергизм ионов Са2+ и Mg2+ наблюдается при активации некоторых ферментов, однако в большинстве случаев Mg2+ - активатор внутриклеточных ферментов, а Са2+ - внеклеточных. Электролиты в организме человека (для педиатрического факультета)У детей ионный состав плазмы крови и внеклеточной жидкости постоянный почти во все возрастные периоды за исключением периода новорожденности и раннего возраста. Содержание ионов К+ в сыворотке крови такое же, как и у взрослых, но относительная потребность детей в К+ выше, чем у взрослых, т.к. недостаток К+ тормозит анаболические процессы. Содержание ионов Cl- в сыворотке крови мало изменяется с возрастом ребенка. Внутриклеточное содержание Na+ у детей выше, чем у взрослых, это связано с постепенным созреванием "натриевого насоса" клеток. Тяжелый ацидоз и гипоксия новорожденных, поздняя перевязка пуповины приводят к гиперкалиемии (содержание К+ выше нормы) [К+]>5,5 ммоль/л. ЭЛЕКТРОХИМИЯПоведение ионов в растворе удобно изучать по измерению электропроводности раствора. Жизнедеятельность любых живых организмов обязательно включает наряду с химическими различные электрические явления. Электрохимические явления лежат в основе важнейших биохимических процессов: - возникновение биопотенциалов и перенос вещества через мембраны; - передача нервных импульсов; - превращение химической энергии питательных веществ в электрическую, которая используется для синтеза молекул аденозинтрифосфата (АТФ), являющихся аккумуляторами энергии в организме. Поэтому для понимания процессов жизнедеятельности необходимо знать основные положения электрохимии. Электрохимия – это раздел химии, который изучает закономерности химических реакций при действии электрического поля на вещество и, наоборот, электрические явления при химических реакциях. В первом случае электрическая энергия превращается в химическую, а во втором – химическая энергия переходит в электрическую. Для организма важную роль играет подвижность ионов в электрическом поле, т.е. электрическая проводимость растворов электролитов, и возникновение биопотенциалов. Проводники I и II рода. Формула для расчета сопротивления проводника I рода.Введем некоторые понятия. Проводники I рода - это металлы и сплавы, в них ток переносится электронами. Для проводников I рода, как известно, сопротивление подсчитывается по формуле 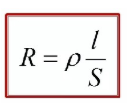 ρ - удельное сопротивление, l - длина проводника, S - площадь поперечного сечения. Проводники II рода- это растворы и расплавы электролитов, в них ток переносится ионами. С позиции жизнедеятельности организма наибольший интерес представляет поведение водных растворов электролитов в электрическом поле. Способность проводить электрический ток у растворов электролитов неодинакова и зависит от многих факторов, в частности от количества ионов и скорости их движения. Чем больше концентрация ионов, тем сильнее электростатическое взаимодействие ионов, которое снижает их скорость. При разбавлении водой сильных электролитов концентрация ионов, а следовательно, и межионное взаимодействие, и тормозящие эффекты уменьшаются, поэтому растет скорость движения ионов. В растворах слабых электролитов концентрация ионов невелика, и поэтому их скорость движения практически не зависит от разбавления. Электрическая проводимость биологических объектов в норме и патологии. Живой организм с точки зрения электрохимии можно рассматривать как систему, состоящую из клеток и межклеточного пространства, заполненных растворами электролитов. В проведении электрического тока участвуют ионы калия, натрия, хлора, карбонатов, фосфатов, ионы органических кислот, белков и других органических соединений. В соответствии с законами электрической проводимости лучше проводят ток ткани небольшой плотности, содержащие много воды и высокоподвижных ионов. Это - кровь, лимфа, желудочный сок, моча, спинно-мозговая жидкость, мышцы, подкожная клетчатка. Низкая электрическая проводимость у нервной ткани, жира, кожи и кости. Большое влияние на электрическую проводимость биологических сред сказывают меж- и внутриклеточные мембраны, которые поляризуются и препятствуют движению ионов. Поэтому постоянный и переменный токи низкой частоты идут, в основном, по межклеточным промежуткам. Переменный ток высокой частоты идет через всю ткань, т.к. в этом случае мембраны клеток не поляризуются в связи с быстрым изменением направления тока. С увеличением частоты переменного тока электропроводность живых клеток и тканей возрастает. Поэтому в медико-биологических исследованиях измерения, как правило, проводят на переменном токе с частотой более 1 кГц. При разрушении клеточных мембран электропроводность тканей для постоянного и переменного тока одинакова. Явления электропроводности биожидкостей и тканей организма для диагностики и в лечебной практике. Измерение электропроводности применяют для изучения проницаемости биологических мембран, для сравнения объема клеток и межклеточного пространства, например объема эритроцитов в крови. Изучение электропроводящих свойств тканей и органов живых организмов имеет большое значение для понимания особенностей их строения и функционирования в норме и патологии. Так, при воспалительных процессах на первых стадиях уменьшается электропроводность, т.к. клетки набухают, межклеточный объем уменьшается. На поздних стадиях нарушается структура клеток, изменяется проницаемость мембран, электропроводность увеличивается. При травмах, ожогах, облучении, омертвении ткани ее электрическая проводимость повышается. Это говорит о том, что увеличивается содержание ионов, т.к. повышается проницаемость мембран. На определении электропроводности основано изучение кровенаполнения органов и сосудов. Электрическая проводимость цельной крови меньше, чем других клеточных жидкостей, поэтому при наполнении сосудов кровью их электропроводность уменьшается. Метод изучения кровообращения в печени, сердце, почках, кровотока в сосудах на основе кондуктометрических измерений называется реографией. Исследования, проведенные на желудочном соке, показали, что его электропроводность зависит, главным образом, от содержания в нем свободной соляной кислоты. Если электропроводность выше нормы, то это указывает на гиперкислотность, если ниже - то на гипокислотность и совсем низкая - на безкислотность. Электропроводность мочи изменяется при заболеваниях. Например, при болезнях почек (нефрит, нефросклероз, гломерулонефрит) электропроводность уменьшается, что связано с уменьшением концентрации хлорида натрия и увеличением содержания белка. При диабете электропроводность мочи также понижена из-за повышенного содержания сахара, являющегося неэлектролитом. Электропроводность крови уменьшается в процессе свертывания. При появлении в крови фибрина и затем кровяного сгустка электропроводность падает до тех пор, пока не начинается ретракция и фибринолиз, сопровождающиеся выделением сыворотки из сгустка, его растворением и некоторым увеличением электрической проводимости. Электрический ток и электрическая проводимость тканей широко используется не только для диагностики, но и в лечебной практике. На электрической проводимости основаны такие физиотерапевтические методы лечения, как ионофорез, электростимуляция, диатермия, ультравысокочастотная терапия и т.д. При ионофорезе лекарственные вещества в организм вводятся через неповрежденную кожу, сквозь поры потовых желез с помощью постоянного тока. В местах приложения электродов образуются кожные депо ионов, откуда лекарственный препарат постепенно перемещается к очагу поражения. В зависимости от заряда ионов лекарственных препаратов они вводятся с положительного или отрицательного электродов. Измерение электросопротивления кожи имеет большое практическое значение для клинической рефлексологии, т.к. позволяет объективно определить местонахождение акупунктурных точек на нашем теле. В области акупунктуры кожа имеет более низкое электросопротивление (а значит, более высокую электропроводность), чем остальные участки кожи. Такие данные используются в диагностических и в терапевтических целях. На эти точки можно оказывать различные воздействия иглоукалыванием, электропунктурой или лазерным излучением. Таким образом, понимание и знание закономерностей электрической проводимости клеток и тканей поможет в дальнейшем освоить соответствующие разделы таких курсов, как физиология человека, патфизиология, физиотерапия, общая и коммунальная гигиена. Механизм возникновения электродного потенциала. Если пластинку металла, например, цинка, погрузить в воду, то расположенные на поверхности катионы металла гидратируются полярными молекулами воды. При этом выделяется энергия гидратации, которая идет на разрыв связи ионов в кристаллической решетке металла. Часть ионов цинка, расположенных на поверхности, перейдет в воду. Сама пластинка при этом зарядится отрицательно. Ионы Zn2+ из раствора электростатически притягиваются к пластинке, образуется двойной электрический слой (ДЭС). 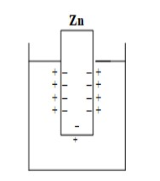 Если же металл помещен в раствор собственной соли, например ZnSO4, то в раствор поступит меньше ионов Zn2+ из металла. Пластинка металла заряжается отрицательно, если энергия гидратации больше, чем энергия кристаллической решетки. 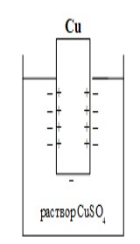 Если же медную пластинку погрузить в раствор CuSO4, то ионы Cu2+ осаждаются на ней. Пластинка заряжается положительно, в растворе создается избыток анионов. Ионы SO42– электростатически притягиваются к пластинке, образуется двойной электрический слой. Металлы, стоящие в электрохимическом ряду напряжений правее водорода, заряжаются положительно, левее водорода–отрицательно. Основные определения в электрохимииСистема, состоящая из двух токопроводящих тел: проводников 1–го рода (металлов), погруженных в растворы собственных солей (проводники 2–го рода)– называетсяэлектродом. Условное обозначение электрода в общем виде Me|Men+. Вертикальная черта показывает границу раздела между проводником 1–го рода и проводником 2–го рода. Условное обозначение цинкового электрода: Zn | ZnSO4 или Zn | Zn2+; медного электрода: Cu | CuSO4 или Cu | Cu2+. Скачок потенциала, возникающий на границе раздела металл– раствор его соли, называетсяэлектродным потенциалом. Он обозначается , например: 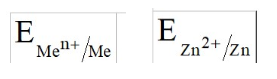 Гидратированные катионы металла в растворе, одноименные с металлом электрода, влияющие на величину его потенциала, называются потенциалоопределяющими. Чтобы можно было сравнивать значения электродных потенциалов различных металлов, следует работать в стандартных условиях: Т = 298 К; концентрация ионов 1 моль/л; Р = 1 атм. Измерение электродных потенциалов. Водородный электрод. Измерение электродных потенциалов. Электродный потенциал отдельного электрода не поддается непосредственному измерению, поскольку возникает между разными фазами – металлом и раствором его соли. Всякая замкнутая цепь должна обязательно включать два электрода. На практике потенциалы всех электродов измеряются по отношению к некоему общему электроду. В качестве такого электрода принят стандартный водородный электрод, потенциал которого при 298 К, давлении 1 атм и концентрации ионов Н+ 1 моль/л принят равным нулю. Водородный электрод. Водородный электрод состоит из платиновой пластинки, покрытой платиновой чернью (для увеличения активной поверхности электрода) и погруженной в раствор, содержащий катионы водорода, обычно раствор HCl или H2SO4. На пластинку подается ток водорода, который поглощается платиной. 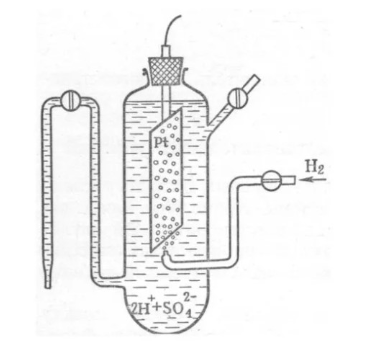 Водород, растворенный в платине, частично, под действием силовых полей атомов платины, диссоциирует на протоны и электроны: H2 ↔ 2H+ + 2ē. В результате такая платиновая пластина приобретает способность обмениваться с раствором ионами водорода. Условное обозначение водородного электрода Pt(H2) | 2H+. Электродный потенциал возникает на границе Pt – раствор кислоты и обозначается 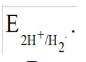 Если водородный электрод находится в стандартных условиях (Т = 298 К, 1 моль/л, Р = 1 атм), он называетсястандартным водородным электродом. Потенциал стандартного водородного электрода условно принят равным нулю: 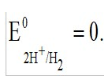 Металлический электрод соединяют проводником с водородным электродом (оба электрода находятся в стандартных условиях) и измеряют ЭДС цепи: ЭДС = Е+ – Е– , где Е+ и E – – потенциалы положительного и отрицательного электродов. Т.к. 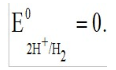 то ЭДС будет равна электродному потенциалу данного металла. Такой электродный потенциал называется стандартным электронным потенциалом и обозначается 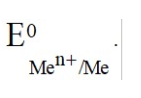 Стандартный электродный потенциалчисленно равен электродвижущей силе со знаком «+» или «–» гальванического элемента, составленного из стандартного водородного и стандартного данного электродов. Электрохимический ряд напряженияСтандартные электродные потенциалы распространенных металлов в водных растворах при 250С представлены в нижеследующей таблице. 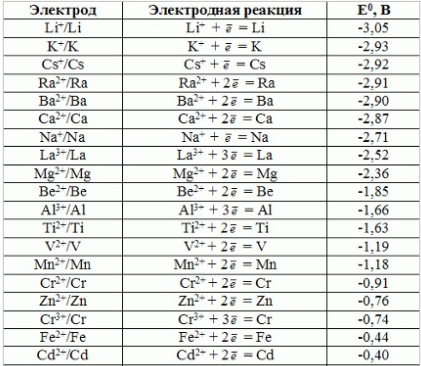 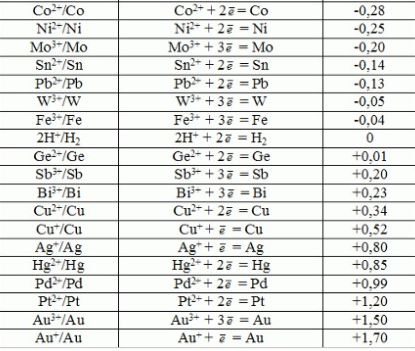 Последовательность металлов по возрастанию стандартного потенциала Е0 (от больших отрицательных к большим положительным значениям) называется рядом стандартных электродных потенциалов или электрохимическим рядом напряжений. У металлов, стоящих до водорода, стандартные электродные потенциалы отрицательные. После водорода – положительные. Таким образом, при стандартных условиях электродные потенциалы имеют определенные стандартные значения. Величины стандартных электродных потенциалов количественно характеризуют восстановительную способность металлов и окислительную способность их ионов. Так, Li – самый сильный восстановитель, а Au – самый слабый, и наоборот, ион Au3+ – самый сильный окислитель, а ион Li+ – самый слабый. Уравнению Нернста для расчета величины электродного потенциала.Для условий, отличных от стандартных (иная концентрация электролита и иная температура) электродные потенциалы будут иметь другие значения. Их можно рассчитать по уравнению Нернста (немецкий физик, 1888 г.):   По этой формуле, зная величину электродного потенциала водородного электрода, находящегося в исследуемом растворе, можно рассчитать pH этого раствора. Однако для серийных измерений водородный электрод не применяется в силу громоздкой конструкции и чувственности к посторонним веществам и каталитическим ядам. Гальванические элементы. Правила записи гальванических схемюГальваническим элементомназывается система, в которой химическая энергия окислительно–восстановительного процесса превращается в электрическую. При этом процессы окисления и восстановления в системе пространственно распределены. Примером гальванической системы может служить элемент Якоби–Даниэля. Он состоит из цинкового и медного электродов, опущенных в растворы солей этих металлов. Между растворами имеется пористая перегородка. На цинковом электроде происходит переход ионов цинка с электрода в раствор; протекает реакция окисления: Zn – 2 e → Zn2+. В результате растворения цинковой пластинки увеличивается концентрация ионов цинка в растворе. На медном электроде протекает реакция восстановления: Cu2+ + 2 e → Cu. В результате этого концентрация ионов меди в растворе уменьшается. При замыкании полюсов элемента проводником (внешняя цепь) электроны переходят по нему с цинковой пластины на медную. Т.к. в приэлектродном пространстве цинкового электрода раствор обогащается ионами цинка, а медного электрода – объединяется ионами меди, то сульфат–ионы перемещаются через пористую перегородку из раствора сульфата меди в раствор сульфата цинка (внутренняя цепь). Возникает замкнутый контур электрического тока. Электрический ток, возникающий в гальваническом элементе, обусловлен суммарной окислительно–восстановительной реакцией: Zn + Cu2+ → Cu + Zn2+. Zn - 2e → Zn+2 - оксиление (отдача электронов, образование катионов) Сu2+ + 2e→ Cu - восстановление (прием электронов, разрядка катионов) В гальванической цепи условно различают анод и катод. Анодом называется электрод, на котором протекает процесс окисления, т.е. отдачи электронов. В гальванической цепианод заряжен отрицательно. Он посылает электроны во внешнюю цепь. Катодом называется электрод, на котором протекает процесс восстановления, т.е. присоединения электронов. В гальванической цепикатод заряжен положительно. Он принимает электроны из внешней цепи. При условном обозначении гальванических цепей анод записывают слева, катод справа (правило «правого плюса»), границу раздела между двумя проводниками 2–го рода изображают двумя вертикальными чертами (–) Анод | Анодный раствор || Катодный раствор | Катод (+) (–) Zn | ZnSO4 || CuSO4 | Cu (+) анод катод ИЛИ (–) Zn | Zn2+ || Cu2+ | Cu (+) Если составлять гальваническую цепь из двух металлических электродов, то тот металл, который расположен правее в электрохимическом ряду напряжений, будет катодом (+), а левее – анодом (–). Способность гальванической цепи к переносу электрических зарядов характеризуется электродвижущей силой (ЭДС). ЭДС гальванической цепи определяется как разность потенциалов катода и анода: ЭДС = Ек – Еа. ЭДС гальванического элементавсегда положительная величина. Чем дальше отстоят друг от друга металлы в ряду стандартных электронных потенциалов, тем больше будет ЭДС построенного из них гальванического элемента. Концентрационный гальванический элемент.Концентрационный гальванический элемент.Элементы этого типа состоят из электродов, сделанных из одного и того же металла, но опущенных в растворы солей с различной концентрацией, из–за чего величины потенциалов этих электродов будут разными. Чем больше в растворе концентрация ионов металла, тем больше вероятность их перехода в кристаллическую решетку металла и тем положительнее должен быть потенциал металлического электрода. Поэтому катодом (+) будет электрод, опущенный в раствор с большей концентрацией соли, а анодом (–) электрод, опущенный в раствор с меньшей концентрацией соли, например: (–) Ag | AgNO3 || AgNO3 | Ag (+) C1< C2 Благодаря различию в концентрациях солей в растворах при замкнутых внешней и внутренней цепи в этом гальваническом элементе будут протекать следующие реакции: анод Ag – ē → Ag+ катод Ag+ + ē → Ag0 ЭДС концентрационного элемента при 298К будет равна: 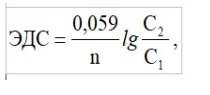 где n – заряд ионов металла. Т.о., ЭДС зависит от соотношения концентраций ионов металла в растворах и не зависит от природы металла. При работе концентрационного гальванического элемента происходит выравнивание концентраций его растворов, и поэтому ЭДС постоянно уменьшается. Окислительно–восстановительные (редокс–) потенциалы.Скачок потенциала на электроде может возникать в результате окислительно–восстановительной реакции, протекающей в приэлектронном пространстве. Если в растворе одновременно содержатся окисленная и восстановленная формы одного и того же вещества, например Fe3+ и Fe2+, то обмен электроном между окисленной (Fe3+) и восстановленной (Fe2+) формами в результате реакции Fe3+ + ē → Fe2+ наиболее вероятен через посредника. В качестве посредника используют инертный металл – платину. Платина способствует перераспределению электронов между восстановленной и окисленной формами данной системы. Ионы Fe2+ отдают электроны на платину, а затем они переходят на ионы Fe3+. Инертный металл не принимает участия в электродной реакции, а является переносчиком электронов. Переход электронов с Fe2+ на платину энергетически более выгоден, чем от иона Fe2+ к Fe3+ в растворе. Обмен электронами между восстановленной и окисленной формами через платину сопровождается появлением на границе раздела фаз платина – раствор двойного электрического слоя (ДЭС). Возникновение ДЭС в этом случае не связано с природой металла, а вызывается различием в способности восстановленной формы отдавать электроны посреднику, а окисленной формы – принимать электроны от посредника.Условная запись окислительно–восстановительного электрода: 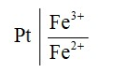  - соотношение концентраций окисленной и восстановленной форм в растворе, - температура. Потенциал окислительно–восстановительного электрода при 298 К рассчитывают по уравнению Петерса: 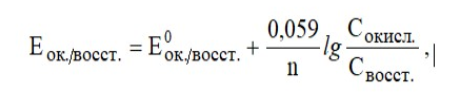 где n – число электронов, участвующих в обратимом окислительно–восстановительном процессе, протекающем на электроде, СОКИСЛ. , СВОССТ. – концентрации окисленной и восстановленной форм вещества в растворе, 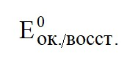 – стандартный окислительно–восстановительный потенциал. – стандартный окислительно–восстановительный потенциал.Стандартный окислительно–восстановительный потенциал– это потенциал, возникающий на границе раздела инертный металл–раствор, в котором концентрация окисленной формы равна концентрации восстановленной формы. Величина стандартного окислительно–восстановительного потенциала является мерой окислительной способности данной системы. Чем больше положительное значение Окислительно–восстановительные потенциалы биологических систем. Представления об окислительно–восстановительных потенциалах необходимы для изучения окислительно–восстановительных процессов в организме. Биологическое окисление является основным источником энергии в организме и имеет многоступенчатый характер. В организме окислительно–восстановительные реакции могут осуществляться путем переноса либо электронов, либо электронов и протонов одновременно. Большинство биохимических окислительно–восстановительных реакций протекает с участием ионов водорода. Например, окисление молочной кислоты до пировиноградной можно описать следующим уравнением:  Окислительно–восстановительные потенциалы биологических систем (далее) Окислительно–восстановительные потенциалы биологических систем представляют большой интерес. Последовательность окислительно–восстановительных реакций в организме определяется уровнями потенциалов окислительно–восстановительных систем. Окислительно–восстановительные процессы происходят при окислении субстратов в митохондриях. На внутренних мембранах митохондрий размещаются ансамбли из ферментов–дегидрогеназ, коферментов (НАД+, ФАД и Ко Q) и серии цитохромов b, с1, с и а, а также фермента цитохромоксидазы. Они образуют систему клеточной дыхательной цепи, с помощью которой происходит эстафетная передача электронов и катионов водорода от субстрата молекулам кислорода, доставленным гемоглобином к клетке. Каждый компонент клеточной дыхательной цепи – участник окислительно–восстановительного процесса – характеризуется определенным значением окислительно–восстановительного потенциала. Стандартные окислительно–восстановительные потенциалы берутся в стандартных биологических условиях, т.е. при 370С и в растворах с рН=7,4. Стандартные окислительно–восстановительные потенциалы (Е0) биологической дыхательной цепи приведены в следующей таблице. 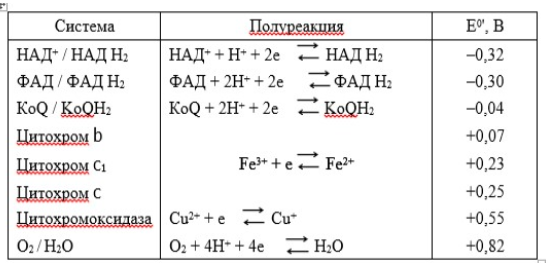 В цитохромах и цитохромоксидазе перенос электрона идет без участия протонов: цитохром (Fe3+) + е ↔ цитохром (Fe2+) цитохромоксидаза (Cu2+) + ē ↔ цитохромоксидаза (Cu+) Движение электронов в клеточной дыхательной цепи происходит ступенчато от веществ с низким потенциалом (–0,32 В) к веществам с более высоким потенциалом (+0,82 В). Изменение окислительно–восстановительного потенциала в виде небольших перепадов и свободной энергии – небольшими порциями имеют, видимо, биологический смысл, состоящий в том, что эффективность использования энергии при этом возрастает по сравнению с однократной разностью потенциалов между субстратом и кислородом. Энергия, выделяемая в процессах биологического окисления, накапливается в клетках за счет синтеза молекул аденозинтрифостфата АТФ. Диффузионный потенциал. Протекание многих биологических процессов связано с изменением концентраций ионов в клетках и тканях живых организмов. Неравномерное распределение ионов в какой–либо жидкой среде обычно приводит к возникновению диффузионного потенциала. Диффузионным называется потенциал, возникающий на границе раздела двух растворов, содержащих один и тот же электролит различной концентрации вследствие различия в подвижности их катионов и анионов. Рассмотрим процесс, протекающий на границе двух растворов соляной кислоты разной концентрации. При соприкосновении растворов ионы Н+ и Cl– из более концентрированного раствора благодаря диффузии будут перемещаться в разбавленный раствор. Поскольку известно, что подвижность ионов Н+ значительно больше, чем ионов Cl –, то в разбавленный раствор в единицу времени ионов Н+ переместится больше, чем ионов Cl –. 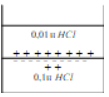 В результате этого разбавленный раствор у поверхности раздела зарядится положительно за счет более быстрых ионов (Н+), а концентрированный – отрицательно за счет медленных ионов (Cl–). Т.о., на границе раздела двух растворов HCl образуется двойной электрический слой, который постепенно движется в сторону разбавленного раствора и существует до тех пор, пока концентрации ионов не выравнятся по всему объему. Величина диффузионного потенциала ЕД обычно невелика и не превышает 0,1 В. если подвижности катионов и анионов близки, то ЕД → 0. В биологических системах диффузионный потенциал проявляется при механическом повреждении клеток. Из места повреждения ионы перемещаются в межклеточную жидкость, за счет чего возникает диффузионный потенциал. Мембранный потенциал. Мембранный потенциал. Величина диффузионного потенциала на границе двух растворов постепенно уменьшается в результате выравнивания концентраций. Стабилизировать потенциал, возникающий на границе раздела жидкость – жидкость можно, если соприкасающиеся растворы разделить мембраной с избирательной проницаемостью (полупроницаемой). Такая мембрана способна избирательно пропускать те или иные ионы и молекулы, в результате чего возникает мембранный потенциал Ем : 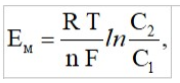 где С1 и С2 – концентрации ионов по разные стороны мембраны; С2>С1. Биопотенциалы.Биопотенциалы. По современным представлениям биопотенциалы по своей природе являются мембранными. Причиной возникновения биопотенциалов является неравномерное распределение ионов калия и натрия между содержимым клетки и окружающей средой. Содержание ионов калия внутри клеток в 20–40 раз выше, чем в околоклеточной жидкости. Содержание ионов натрия, наоборот, в 10–20 раз выше в межклеточной жидкости, чем в клетке. Внутри клетки существует высокая концентрация крупных анионов, главным образом белков А–, которые не способны проникать через мембрану (или проникают через нее очень медленно) и поэтому являются фиксированным компонентом внутри клеток. Чтобы уравновесить заряд этих анионов необходимо равное количество катионов. Благодаря действию Na / K насоса этими катионами в основном оказываются ионы калия. Через клеточную мембрану ионы K+ и Na+ самопроизвольно передвигаются по ионным каналам в соответствии с градиентом концентраций. В состоянии покоя в мембране в основном открыты каналы для прохождения ионов К+ и практически закрыты натриевые каналы. При возбуждении наоборот: открыты главным образом каналы для ионов Na+ и почти полностью закрыты для ионов K+. Таким образом, проницаемость клеточной мембраны для ионов K+ и Na+ зависит от ее состояния – покой или возбуждение. Избирательная проницаемость клеточной мембраны и разница в концентрации ионов Na+ и K+ по обе стороны от нее приводят к установлению мембранного потенциала. Потенциал покоя и действия. В покое ионы К+ из внутриклеточного раствора переходят через клеточную мембрану в наружный раствор. При этом наружная поверхность мембраны заряжается положительно за счет перешедших ионов К+, а внутренняя поверхность – отрицательно за счет избытка органических анионов, оставшихся внутри клетки. В результате этого на мембране возникает разность потенциалов. Внутриклеточный отрицательный заряд препятствует выходу из клетки новых ионов калия, а те ионы, которые все же выйдут из клетки, еще больше увеличат заряд на мембране. Таким образом возникает мембранный потенциал покоя ЕП. Потенциаломпокояназывается мембранный потенциал, возникающий между внутренней и наружной сторонами клеточной мембраны, находящейся в невозбужденном состоянии. Определить потенциал покоя можно с помощью двух микроэлектродов, вводимых внутрь клетки и в наружный раствор. Измеренная величина En для разных клеток лежит в пределах от –70 до –90 мВ. Знак минус говорит о том, что внутренняя поверхность мембраны заряжается отрицательно по отношению к наружной. Величину потенциала покоя можно рассчитать по уравнению Нернста для концентрационной цепи: 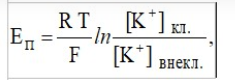 где индексы кл. и внекл. соответственно означают «клетки» и «внеклеточной жидкости». Потенциал покоя присущ всем без исключения живым клеткам. Потенциал действия. Такие клетки организма, как нервные, мышечные, железистые, способны находиться в состоянии возбуждения. Возбудимость– это ответ клетки на раздражения. При раздражении клетки химическим, электрическим или механическим воздействием мембрана становится более проницаемой для ионов Na+, чем для К+, что приводит к очень быстрому сдвигу мембранного потенциала в положительном направлении (деполяризация мембраны). Продолжительность этого ≈10–4 сек. Обычно кривая деполяризации переходит за нулевую линию и мембранный потенциал становится положительным (+40 - +60 мВ). 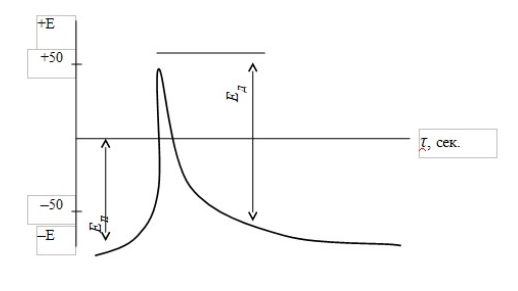 Величина потенциала действия определяется выражением: 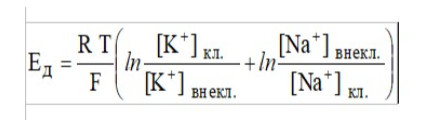 Непосредственно после этого изменения мембрана вновь становится проницаемой для ионов К+ и непроницаемой для Na+. Ионы К+ выходят из клетки в соответствии с градиентном концентрации, унося с собой положительный заряд до тех пор, пока на мембране не восстановится исходный отрицательный потенциал покоя. Таким образом, при возбуждении клеточной мембраны за 1–2 миллисекунды отрицательная величина потенциала (≈ –75 мВ) меняется на положительную (≈ 50 мВ), а потом вновь возвращается к первоначальной величине. Это обусловлено циклическим процессом поступления Na+ в клетку и последующего выхода К+ из нее. Потенциалом действия называется быстрое колебание (повышение и падение) мембранного потенциала, возникающее при возбуждении клеточной мембраны. Потенциал действия, возникнув на одном участке клетки, вызывает возбуждение соседних участков и распространяется по всей поверхности мембраны со скоростью 1–100 м/сек. Число ионов К+ и Na+, проходящих через мембрану во время генерации потенциала действия, мало по сравнению с числом этих ионов внутри клетки. Даже и при прохождении большого числа импульсов концентрации ионов К+ и Na+ в растворах по обе стороны мембраны остаются практически постоянными. Это происходит потому, что в мембране клетки действует Na+ – K+ насос, который выкачивает из клетки ионы Na+ и накачивает в нее ионы К+ в соотношении 3:2. Следует отметить, что в общем случае возникновение потенциала покоя и генерация потенциала действия на мембранах различных клеток связаны не только с переходом через мембрану ионов К+ и Na+, но также и ионов Ca2+, Cl–, H+ и др. Работа клеток нарушается, если изменяется ионная проницаемость клеточных мембран. Например, под действием некоторых ядов в нервных клетках при возбуждении блокируются каналы для прохождения ионов Na+, и поэтому прекращается генерация и подача потенциала действия вдоль нервного волокна. Этим и объясняется токсическое действие ядов на нервную систему организма. Генерирование мембранного потенциала связано с работой сердца, мозга, мышц. Электрические потенциалы, возникающие при деятельности сердца, можно регистрировать с помощью электрокардиографа на электрокардиограмме. ЭКГ – важнейшая характеристика сердечной деятельности. Биоэлектрические потенциалы мозга регистрируются на электроэнцефалограмме, желудка – на электрогастограмме и т.д. НГУЕН ТХАНЬ ЛАМ - 121 |
