лекция кс. Лекция комплексные соединения
 Скачать 163.66 Kb. Скачать 163.66 Kb.
|
|
ЛЕКЦИЯ 1. КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ Важность темы определяется тем, что в живом организме комплексными соединениями являются металлоферменты, гормоны, некоторые витамины, гемоглобин крови, они образованы «металлами жизни» и белками, аминокислотами, водой, порфиринами. Существует много определений комплексных соединений (дальше КС), мы будем пользоваться определением в соответствие с теорией Вернера в зависимости от природы химической связи. Координационная теория Вернера различает простые вещества, в которых атомы соединены в соответствие с валентностью ионной или ковалентной свзью Пример: Сu(OH)2 H2O    Комплексные соединения – это сложные вещества с донорно-акцепторной связью  М + n L: [ М Ln ] акцептор ē донор ē устойчивый комплексообразователь лиганд комплексный ион (к.и.) Акцептор е – атом со свободными (вакантными) орбиталями, дальше будем называть его комплексообразователем. Донор электронов – атом с неподеленной парой электронов, дальше – лиганд. Пример образования КС: Zn(OH)2↓ + 2 NaOH Na2[Zn(OH)4] Простые вещества КС, комплексный ион выделяют скобками [ ] Cu(OH)2↓ + 4NH3 [Cu(NH3)4] (OH)2 СОСТАВНЫЕ ЧАСТИ КС Общая формула КС [MLn] X где М – комплексообразователь, или центральный атом или ион (ц.а.) с вакантными орбиталями. Способность к образованию КC у элементов возрастает в ряду: s < p < d < f- элементы L – лиганд (донор ē) [MLn] – внутренняя сфера = комплексный ион к.и. Х – внешняя сфера n – координационное число (к.ч.) определяется числом лигандов ( или равно числу связей ц.а. с L) !!! Обычно к.ч. в 2 раза больше заряда ц.а.: n(Ag+, Cu+) = 2 n(Cu+2, Zn+2) = 4 n(Fe+3,+2, Al+3, Co+3,+2) = 6 (исключение) РАСЧЕТ ЗАРЯДОВ СОСТАВНЫХ ЧАСТЕЙ КС    Пример 1. [Ag(NH3)2] Cl название строится, начиная с аниона (справа налево) хлорид диамминсеребра 1) Заряд внутренней = заряду внешней сферы, противоположен по знаку Cl -1 [ ] +1 Заряд внутренней сферы = сумме зарядов ц.а. и лигандов [Ag (NH3 0)2] +1 общий заряд L = заряд L к.ч. L x + 2 0 = +1 заряд ц.а.(Аg) х = +1 ц.а. заряд L Пространственное строение КС зависит от координационного числа, при n = 2 линейная молекула L – M – L Пример 2. К4 [Fe(CN)6] гексацианоферрат (II) калия (название ← начинать с аниона) 1) заряд внешней сферы (К+1) = 4 (+1) = +4 2) заряд к.и. [ ] = - 4 3) заряд L (CN -) = 6 (-1) = - 6 (лиганд- остаток цианистоводородной кислоты HCN) 4) заряд ц.а. (Fe) = x (?) x – 6 = - 4 x = + 6 – 4 = +2 Пространственное строение при n = 6 - октаэдр (восьмигранная пирамида) КЛАССИФИКАЦИЯ КС Существует несколько классификаций КС по различным признакам. 1) По классу вещества бывают: Кислоты Основания Соли Н+ [ ]- [ ]+OH- [ ]+X- или X+ [ ]- во внешней сфере протон во внешней сфере гидроксид-анион комплексный катион или анион H[AuCl4] [Cu(NH3)4](ОН)2 К4 [Fe(CN)6] тетрахлороаурат гидроксид тетраамминмеди (II) [Cr(H2O)6]Cl3 водорода 2) По заряду к.и. Катионные Анионные Нейтральные [ ]+ [ ]- [ ]0 [Cr(H2O)6]Cl3 Na2[Zn(OH)4] [Pt(NH3)2Cl2] [Fe(CO)5] По природе лиганда . Природа L Пример L Название КС (общее) NH3 аммиакат Молекулярные Н2О аквокомплексы (лиганд-молекула) СО карбонил ОН- гидроксокомплексы Анионные анионы кислот Cl- Br- CN- NO2- ацидокомплексы Смешанные разные по природе Na[Al(OH)4(H2O)2] диаквотетрагидроксоалюминат натрия К.ч. = 4 + 2 = 6 По дентатности диганда Дентатность (от латинского «зуб») определяется по числу донорных атомов в L = числу связей М и L. По дентатности КС бывают монодентатными и полидентатными. Монодентатные L (однозубые) содердат один атом-донор ē. У атома донора указана неподеленная пара электронов (..) .. .. .. .. .. NH3 H2O CO Cl- CN- Полидентатные L содержат несколько донорных атомов и бывают: бидентатные (2 донорных атома) .. .. .. .. H2N-CH2-CH2-NH2 H2N-CH(R)-COOH этилендиамин аминокислоты терадентатные (4 атома-донора) порфирин (формула будет ниже) гексадентатные (6 атомов-доноров) трилоны А, Б, тетацин Будем писать формулу трилона А, она симметричная (лучше начинать изображение с центра), отмечены шесть донорных атомов с неподеленными парами элетронов. .. ..   HOOC-CH2 CH2-COOH .. ..   N- CH2-CH2-N .. .. HOOC-CH2 CH2-COOH трилон А = ЭДТА (этилендиаминтетрауксусная кислота) acide ЭДТА- сокращение по первым буквам полного химического названия ХЕЛАТЫ Полидентатные лигадны образуют с металлами-комплексообразователями устойчивые циклические комплексы, которые называются хелатами (от латинского «клешня») Пример хелата меди (II) и бидетатного этилендиамина. ГРАФИЧЕСКОЕ ИЗОБРАЖЕНИЕ ДОНОРНО-АКЦЕПТОРНОЙ СВЯЗИ – СТРЕЛКА (или пунктир) ОТ АТОМА-ДОНОРА К АКЦЕПТОРУ.  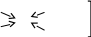 СН2-NH2 NH2-СН2 +2   Cu CuСН2-NH2 NH2-СН2 Широко распространены в природе порфириновые комплексы, в которых лигандом является тетрадентатный порфирин, в центре металл-комплексообразователь (М). 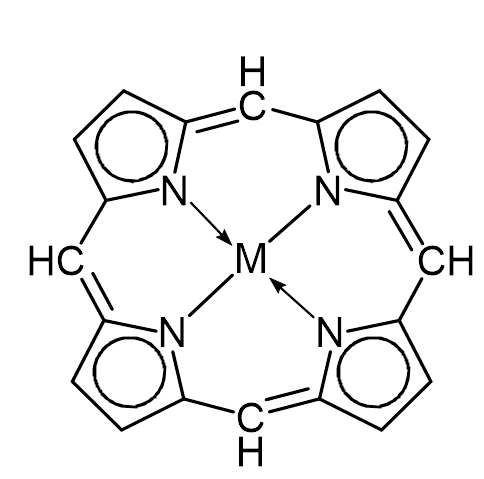 (!! Удобно рисовать пятичленные циклы с N в вершинах квадрата, затем соединять их через группу СН с чередованием двойных и простых связей). В зависимости от природы центрального атома образуются жизненно важные КС с различными биологическими функциями: если ц.а. Fe+2 гем крови Mg+2 хлорофилл Zn+2 карбоангидраза (фермент дыхательной цепи) Со+3 витамин В12 Сu+2, Fe+2 ЦХО (цитохромоксидаза-фермент ОВР) МЕХАНИЗМ ОБРАЗОВАНИЯ ДОНОРНО-АКЦЕПТОРНОЙ СВЯЗИ Механизм образования донорно-акцепторной связи рассмотрим на примере аммиаката меди. Сu+2 + 4 NH3 [Cu(NH3)4]+2 акцептор ē донор ē к.и. Надо доказать с точки зрения электронного строения, что катион меди является акцептором электронов (имеет вакантные орбитали), а лиганд содержит донорный атом. Начнем с лиганда: монодентатный :NH3 Атом водорода не может быть донором электронов, он отдал свой электрон на образование связи с азотом, значит, надо написать электронную формулу азота (порядковый номер 7, период 2, группа 5): N7 1S22S22P3 Электронно-графическая формула внешнего второго электронного уровня (распределение по ячейкам):  Из пяти валентных три неспаренных электрона участвут в SP3 гибридизации и идут на образование 3 σ cвязи N-H, два электрона (неподеленная пара) остаются на азоте. Значит, атом азота в аммиаке является атомом-донором. Надо написать электронную формулу сначала атома меди, порядковый номер 29, период 4, группа 1В (побочная). Вспоминаем, что у элементов побочных подгрупп на внешнем уровне 1 или 2 электрона и идет заполнение предвнешнего уровня. У атом меди на последнем 4-ом уровне 1 электрон. При переходе в катион атом меди отдает 2 электрона с последнего и предпоследнего уровне, получаем электронную формулу Cu +2. Сu29 1S22S22P63S23P63d104S1 ↓ -2ē Сu+2 1S22S22P63S23P63d94S0 Элетронно-графическая формула внешного уровня 4S 4P наглядно показывает наличие у катиона меди 4-х свободных орбиталей, на которые он может принять электроны от атомов-доноров. Катион Cu +2 – акцептор е. Катион меди принимает 4 пары электронов от 4 молекул аммиака, образуется 4 донорно-акцепторных связи. Пространственное строение КС с к.ч. = 4 квадрат или тетраэдр NH3   NH3   NH3 ХИМИЧЕСКИЕ СВОЙСТВА КС На лекции мы рассматриваем только диссоциацию комплексных соединений, на практических работах вы познакомитесь и с другими химическими свойствами КС, Диссоциация ступенчатая: 1-я стадия как у сильного электролита (100%) идет распад на внутреннюю и внешнюю сферы (между ними ионная связь) [Ag(NH3)2] Cl ↔ [Ag(NH3)2]+ + Cl – α ≈ 100% 2-я стадия – комплексный ион, как слабый электролит, диссоциирует на ц.а. и L  [Ag(NH3)2]+ ↔ Ag+ + 2 NH3 Записываем константу диссоциации по второй ступени, она для КС называется константой нестойкости. (Пояснение: коэффициент идет в показатель степени, квадратные скобки [ ] обозначают концентрацию). 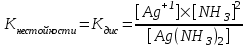 Величина, обратная К нестойкости, называется константой устойчивости. 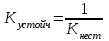 Чем ↓(меньше) Кнест (больше Куст), тем прочнее комплекс!!! МЕДИКО-БИОЛОГИЧЕСКОЕ ЗНАЧЕНИЕ КС Многие биологически-активные структуры – К.С. Природные КС образованы биогенными металлами и биогенными лигандами, примеры которых приведены ниже. Мбиогенный + L биогенный → К.С. и функции «металлы жизни» аминокислоты ферменты катионы Fe, Zn, белки гормоны (регуляторная) Cu, Co, Mn, Mo порфирин гемоглобин (транспортная) вода витамины (регуляторная) Рассмотрим некоторые конкретные КС и их роль в организме. Транспортная функция К.С. Пример 1. Гемоглобин_ это порфириновый комплекс железа (II) связывает кислород по донорно-акцепторному механизму и переносит его в ткани. [HHbFe+2 ] + O2 [HHbFe+2 O2 ] L оксигемоглобин Пример 2. Транспорт катионов калия и натрия через клеточную мембрану осуществляется в виде КС: [К+ валиномицин] и [Na+ грамицидин] 2.В организме наблюдается металл-лигандный гомеостаз (баланс) – поддержание постояннства содержания биогенных металлов, лигандов и КС, т.е. участников равновесия; Мб + Lб ↔ [Мб Lб ] Баланс нарушается под действием неблагоприятных факторов: несбалансированное питание (недостаток биогенных М и L) загрязнение окружающей среды (проникновение токсических лигандов) длительный прием лекарств (токсические лиганды) Токсические вещества при поступлении в организм приводят к образованию устойчивых К.С., не выполняющими физиологические функции, что приводит к патологиям в результате смещения металл-лигандного равновесия. 3. Металлолигандная патология может быть разделена на два подвида. а) лигандная патология развивается под действием токсических лигандов Lт :СО, СО2, H2S, NH3, нитраты NO3-, нитриты NO2-,цианиды CN-, пестициды, лекарства-тубазид, ПАСК, сульфамиды. Механизм токсического действия заключается в замещении (вытеснении) биогенного лиганда токсическим. При образовании более прочного КС с токсическим лигандом развивается патология (заболевание). Часто это связано со снижением активности ферментов [Мб Lб ] + Lт ↔ [Мб Lт ] + Lб Кнест 1 > Кнест 2 более прочный инактивация ферментов Пример 1. При отравлении угарным газом СО идет замещение кислорода (Lбиог) в оксигемоглобине с образованием карбонилгемоглобина, более прочного, чем оксигемоглобин по схеме: [HHbFe+2 O2] + СО ↔ [HHbFe+2 СO] + О2 Оксигемоглобин карбонилгемоглобин устойчивость > в 210 раз Источники угарного газа: 1) курение 2) выхлопные газы При отравлении СО наблюдается: Нарушение транспорта О2, ↓ иммунитета, заболевание дхательных путей Симптомы отравления угарным газом зависят от концентрации карбонилгемоглобина в крови и приведены ниже: % HHbCO в крови Симптомы  4,7 (1 пачка в день) → головная боль, тошнота 4,7 (1 пачка в день) → головная боль, тошнота10-15 25-30 → нарушение координации движений, помутнение сознания 60 → судороги, потеря сознания, смерть Пример 2. Отравление цианидами СN- (источник – химические гальванические производства, органический амигдалин в косточковых фруктах) приводит к блокированию дыхательных ферментов цитохромов. Цитохромы содержат Fe +2 и +3, в первую очередь блокируется Fe+3 (К нест [Fe +3(CN) ] < К нест [Fe +2(CN)]). Cимптомы отравления: удушие (асфиксия), летальный исход (КCN циванид калия). б) металлопатология бывают Ме-избыточные и Ме-дефицитные состояния, возникают при недостаточном поступлении Ме жизни (Ме-дефицитное), например, при недостатке в пище ↓[Fe] (вегетарианство) к железодефицитной анемии ↓[Са] повышает риск кариеса, парадонтита поступление токсичных тяжелых Ме (Ме-избыточное): Hg2+ Cd2+ Pb2+ Cu2+ Механизм токсического действия заключается в замещении (вытеснении) биогенного металла токсическим. При образовании более прочного КС развивается Ме- патология. [Мб Lб ] + Mт ↔ [Мт Lб ] + Мб Кнест 1 > Кнест 2 более прочный Токсические металлы Мт действует на тиольные группы SH, образует устойчивые хелаты с белками, что приводит к дезактивированию ферментов. Проявлением Ме-патологии может быть: нарушение обмена веществ (костеобразование, кроветворение…) мутагенез развитие опухолей Лечение металлопатологии проводится антидотами: Na2S2O3 тиосульфат натрия, трилоны А, Б, тетацин, унитиол, БАЛ 4) Хелатотерапия- образование КС лежит в основе действия ряда лекарств Антидоты при отравлении тяжелыми Ме!!! Унитиол (формулу и схему действия смотрите в конце лекции) Комплексоны: Трилон А (формулу смотри выше) Трилон Б – динатриевая соль трилона А =Na2ЭДТА Тетацин – СаNa2ЭДТА Покажем образование тетацина из трилона Б путем замещения водородов с группах СООН на катион кальция. Кальций образует с тетацином 4 донорно-акцепторных связи (стрелки), к.ч. Са = 6, дентатность тетацина равна 6.  NaOOC-CH2 CH2-COONa NaOOC-CH2 CH2-COONa N- CH2-CH2 −N + Са +2 → .. HOOC-CH2 CH2-COOH Трилон Б → .. ..  NaOOC-CH2 CH2-COONa .. ..  N- CH2-CH2-N .. .. ОOC-CH2 CH2-COO Са Тетацин При отравлении токсическим металлом тетацин связывает токсический металл в прочное КС по схеме: CaNa2ЭДТА] + Hg2+ [ HgNa2ЭДТА] + Ca2+ прочный комплекс Продукт связывания тяжелого металла выводится из организма через почки и кишечник. Схема действия унитиола, как антидота:     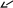     СН2-SH S СН2-S HS-CH2 СН2-SH S СН2-S HS-CH2   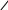     2 CH- SH + Белок Hg → CH- SH Hg S-CH + Белок 2 CH- SH + Белок Hg → CH- SH Hg S-CH + БелокCH2-SO3Na S CH2-SO3Na CH2SO3Na Унитиол (избыток) 5) Лекарственные К.С. широко применяются в медицине: Трилоны – для консервирования крови, для понижения свертываемости крови [Pt(NH3)2Cl2] – противоопухолевое действие Na3 [Au(S2O3)2] хризолан – при ревматизме |
