НХ Лекция 6. Лекция общие свойства растворов
 Скачать 240.5 Kb. Скачать 240.5 Kb.
|
|
Лекция 6. ОБЩИЕ СВОЙСТВА РАСТВОРОВ Раствор – это гомогенная (однородная) система, состоящая из двух или более компонентов (химических веществ) и продуктов их взаимодействия. Один из компонентов считается растворителем, а остальные – растворенными веществами. Если вещества до смешивания находились в разных агрегатных состояниях, то растворителем считается тот компонент, агрегатное состояние которого имеет раствор. Например, при смешивании жидкой воды и твердого сахара получился жидкий раствор. В данном случае растворителем является вода, а сахар – растворенным веществом. Если вещества в момент смешивания имели одинаковое агрегатное состояние, то растворителем считается тот компонент, которого больше по количеству вещества. Например, если смешать 180 г воды (10 моль) и 180 г этилового спирта (180 г / 40 г / моль = 3,9 моль), то растворителем является вода. По агрегатному состоянию растворы можно разделить на газообразные, жидкие и твердые. Примеры: 1) Газообразный раствор – воздух (N2 – растворитель; O2, CO2, H2O и т.д. – растворенные вещества). 2) Жидкий раствор – раствор сахара в воде. 3) Твердый раствор – сталь (Fe – растворитель; С и другие элементы – растворенные вещества). Способы выражения концентрации растворов Таких способов существует множество, но чаще всего используется 6 перечисленных ниже. Символом X будет обозначаться формула того вещества, концентрация которого определяется данным выражением (Х = NaCl, H2SO4, KOH и т.д.) I. Массовая доля () – это отношение массы растворенного вещества к общей массе раствора: Массовая доля – безразмерная величина. Сумма массовых долей всех веществ в растворе = 1. Массовая доля может быть выражена в процентах. В этом случае она находится по формуле: II. Мольная доля (х) – отношение количества вещества Х (моль) к общему числу молей всех веществ в растворе. Мольная доля – безразмерная величина. Сумма мольных долей всех веществ в растворе = 1. III. Массовая концентрация (Т) – отношение массы компонента Х к объему раствора. Обычно Т находят в единицах (г/дм3), в системе СИ она имеет единицы измерения (кг/м3). В аналитической химии эта величина находится в единицах (г/см3) и называется титром вещества Х. IV. Молярная концентрация (молярность) С(Х) или [X] – отношение количества вещества к объему раствора. Обычно молярность выражают в (моль/дм3) и обозначают буквой (М). В системе СИ молярность должна иметь единицы измерения (моль/м3). V. Моляльность (b) – отношение количества вещества Х к массе растворителя в данной порции раствора. Моляльность может иметь только одну единицу измерения (моль/кг). VI. Молярная концентрация эквивалента C(Э) – отношение количества вещества эквивалента к объему раствора:  . .Ранее для обозначения этого понятия использовались синонимы: эквивалентная концентрация, нормальная концентрация, нормальность (все они считаются устаревшими). Молярная концентрация эквивалентов обычно выражается в единицах (моль/дм3). В СИ она имеет единицы измерения (моль/м3). Коллигативные свойства растворов Некоторые физико-химические свойства разбавленных растворов не зависят от природы растворенного вещества, а определяются только количеством частиц этого вещества в растворе и природой растворителя. Такие свойства называются коллигативными. Математические зависимости для коллигативных свойств выведены для сильно разбавленных растворов неэлектролитов. В случае электролитов в эти формулы вводится поправочный коэффициент, который называется изотоническим коэффициентом (i): i = 1 - (1 - n), где – степень электролитической диссоциации электролита; n – число ионов, на которые распадается каждая молекула электролита. Осмос. В ходе экспериментальных исследований жидких растворов широко используются полупроницаемые перегородки (осмотические мембраны). Осмотическая мембрана изготавливается из материала, который пропускает через себя только молекулы растворителя. Молекулы растворенного вещества не могут проходить через нее. В современных приборах по измерению осмотического давления (осмометрах) осмотические мембраны изготавливаются из специальных сортов целлофана. Для объяснения явления осмоса рассмотрим схему:  Рис. 6.1. Схема явления осмоса Некий сосуд разделен на две части осмотической мембраной (ОМ), выполненной из эластичного материала (типа очень тонкой резины). В начальный момент времени в левой части сосуда (I) находится чистый растворитель (например, вода), а в правой части сосуда (II) находится раствор вещества Х в данном растворителе (например, сахара в воде). Концентрация молекул Н2О в чистом растворителе всегда больше, чем в растворе. Поэтому поток молекул воды через мембрану из левой части сосуда в правую (n1) будет больше, чем обратный поток (n2). Это приведет к тому, что объем I будет уменьшаться, а объем II увеличиваться. Эластичная осмотическая мембрана выгнется влево (рис. 1б). Получается, что со стороны раствора на мембрану действует давление, которое деформирует эту перегородку. Такое давление называется осмотическим (Росм). Величина его определяется уравнением Вант-Гоффа: Pосм = С(Х) ∙ R ∙ T, где С(Х) – молярная концентрация вещества Х в растворе; R – универсальная газовая постоянная (8,31 Дж/мольК); T – температура раствора (К). Данное выражение по форме аналогично уравнению Менделеева - Клайперона для идеального газа: P ∙ V = P = C ∙ R ∙ T. Поэтому Вант-Гофф сформулировал закон осмотического давления следующим образом: осмотическое давление равно тому давлению, которое производило бы растворенное вещество, если бы оно в виде идеального газа занимало тот же объем при той же температуре. Измерение осмотического давления - один из главнейших методов определения молярных масс высокомолекулярных веществ (каучук, целлюлоза, белки, жиры и т.п.). Закон Рауля. Если жидкий летучий растворитель (например, воду) поместить в замкнутый объем, то через некоторое время установится равновесие (рис.6.2). Рис. 6.2. Объем, заполненный водой, находящейся в равновесии с водяным паром Равновесное давление паров воды (Р0) называется давлением насыщенного пара над чистым растворителем. Величина Р0 зависит только от природы растворителя (Н2О) и температуры. Если в воде при той же температуре растворить некоторое количество нелетучего вещества Х (например, сахара), то давление паров растворителя понизится на величину Р = Р0 – Р, где Р – давление паров растворителя над данным раствором. Величина Закон Рауля: относительное понижение давления насыщенного пара растворителя над раствором нелетучего вещества равно мольной доле этого вещества в растворе. В экспериментальных исследованиях часто используются два следствия из закона Рауля. Первое следствие из закона Рауля: раствор нелетучего вещества имеет температуру кипения выше, чем у чистого растворителя. Тк = Тр - Т0 = Кэ ∙ b(X), где Тк – увеличение температуры кипения раствора по сравнению с чистым растворителем; Тр – температура кипения раствора вещества Х; T0 – температура кипения чистого растворителя; b(X) – моляльность раствора (моль/кг растворителя); Kэ – эбулиоскопическая константа. Значение Кэ определяется только природой растворителя: для воды Кэ = 0,52 кгК/моль, для бензола Кэ = 2,57 кгК/моль, для этилового спирта Кэ = 1,16 кгК/моль, для диэтилового эфира Кэ = 2,02 кгК/моль и т.д. Измерив температуру кипения раствора неизвестного вещества в данном растворителе, можно рассчитать его молярную массу. Этот метод называется эбулиоскопией. Второе следствие из закона Рауля: раствор нелетучего вещества имеет температуру замерзания ниже, чем у чистого растворителя: Tз = Т0 - Тр = Кк b (X) , где Тз – понижение температуры замерзания раствора по сравнению с чистым растворителем; T0 – температура замерзания чистого растворителя; Tр – температура замерзания раствора вещества Х; b(X) – моляльность раствора (моль/кг растворителя). Значение Кк для данного растворителя является константой: Кк (Н2О) = 1,86 кгК/моль, Кк (бензол) = 5,1 кгК/моль, Кк (диэтиловый эфир) = 1,73 кгК/моль. На этом следствии из закона Рауля основана криоскопия: метод нахождения молярных масс веществ, исходя из измерения температуры замерзания их растворов. Примеры решения задач Задача 1. Смешали 150 г раствора с массовой долей растворенного вещества 6% и 50 г раствора с массовой долей 20%. Вычислите массовую долю полученного раствора. Решение Вычисляем массу растворенного вещества в первом растворе: Масса растворенного вещества во втором растворе: Общая масса раствора равна: 150+50=200(г), в нем содержится растворенного вещества: 9+10=19(г). Массовая доля полученного раствора: Задача 2. В 450г воды растворили 50г CuSO4·5H2O. Вычислите массовую долю (в процентах) кристаллогидрата и безводной соли. Решение mр-ра = mв-ва+ mводы; mр-ра = 450 + 50 = 500 (г). Находим массовую долю кристаллогидрата ( Находим массу безводной соли: 50 г Х г CuSO4·5H2O ― CuSO4 250 г 160 г М(CuSO4·5H2O) = 250 г; М(CuSO4) = 160 г Массовая доля безводной соли равна: Задача 3. К 1дм3 раствора KOH с массовой долей 10% (ρ=1,092 г/см3) прибавили 0,5 дм3 раствора KOH с массовой долей 5% (ρ=1,045 г/см3). Объем смеси довели до 2 дм3. Вычислите молярную концентрацию полученного раствора. Находим массу 1 дм3 раствора KOH: m1 р-ра=V1· ρ1; m1 р-ра=1000 · 1,092=1092 (г). В этом растворе содержится масса вещества KOH (mв-ва): Находим массу 0,5 дм3 раствора KOH: m2 р-ра=V2· ρ2; m2 р-ра=500·1,045=522,5 (г); В этом растворе содержится масса вещества KOH: В общем объеме полученного раствора масса вещества KOH составляет: 109,2+26,125=135,325 (г) Молярная концентрация раствора: Задача 4. Раствор KNO3 одержит 192,6 г соли в 1 дм3 (=1,14 г/см3). Рассчитайте моляльность раствора. Решение. Моляльность вычисляется по формуле: Находим массу растворителя: mр-ра=1000 см31,14 г/см3=1140 г=1,14 кг. Задача 5. Массовая доля гидроксида калия в растворе равна 10 %. Рассчитать моляльность раствора. Решение. Массовая доля 10 % указывает, что на каждые 90 г воды приходится 10 г KOH. Рассчитаем массу гидроксида калия, приходящуюся на 1 кг воды: Задача 6. Рассчитать молярную долю иода в растворе, содержащем 20 г J2 в 500 г тетрахлорида углерода CCl4. Решение. Находим количество иода и тетрахлорида углерода в данном растворе: Задача 7. В 1 дм3 воды растворимо 150 г серной кислоты. Плотность полученного раствора 1,1 г/см3. Определить молярную концентрацию эквивалента. Решение. Масса полученного раствора:  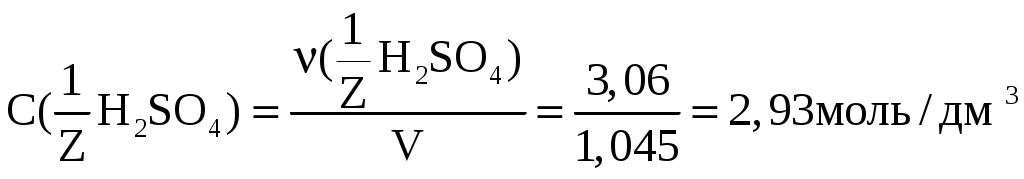 Задача 8. 1,33 г хлорида алюминия растворили в 200 см3 воды. Плотность полученного раствора 1,05 г/см3. Рассчитать массовую долю растворенного вещества, молярную концентрацию, моляльность, молярную концентрацию эквивалента, мольные доли хлорида алюминия и воды. Решение. Массовая доля. Масса раствора m2=200 г + 1,33 г = 201,33 г Молярная концентрация. Объем раствора Моляльность. Молярная концентрация эквивалента. Мольная доля.  Задача 9. Водный раствор, содержащий 2,562 г вещества в 100,0 г воды замерзает при температуре –0,141С. Рассчитать молярную массу растворенного вещества. Решение. Задача 10. Рассчитать температуру кипения раствора, содержащего 3,6 г глюкозы С6Н12О6 в 500 г Н2О. Решение.  , где m1 – масса растворенного вещества в г; , где m1 – масса растворенного вещества в г;М – его молярная масса, г/моль; m2 – масса растворителя в г; Кэ – эбулиоскопическая постоянная; Тк=100+0,0208=100,0208С Задача 11. Раствор, содержащий 2,501 г вещества в 100 г воды кипит при 100,21С. Найти молярную массу растворенного вещества. Решение Задача 12. Вычислить осмотическое давление раствора, содержащего 3,42 г сахарозы С12Н22О11 в 100 см3 водного раствора при температуре 18С. Решение V – объем раствора; Т – температура, К; R – универсальная газовая постоянная, равная 8,314 ДжК-1моль-1 или 0,083105 Падм3К-1моль-1. Задача 13. Рассчитать молярную массу вещества, если известно, что раствор, содержащий 30 г этого вещества, в 500 см3, имеет при 25С осмотическое давление, равное 4,31105 Па. Решение.  Изучив материал этой главы, студенты должны знать: Понятие растворимости веществ. Способы выражения концентраций растворов. Коллигативные свойства растворов (закон Рауля, его следствия, осмотическое давление). Должны уметь: Рассчитывать молярную, моляльную концентрации, молярную концентрацию эквивалента, мольную долю, массовую долю вещества в растворе. Рассчитывать изменение температуры замерзания (кипения) растворов, осмотическое давление в растворе. |
