Лекция 4. Основы молекулярно-кинетической теории газов. Уравнение состояния идеального газа. Уравнение Менделеева-Клапейрона. Законы идеального газа. Барометрическая формула. Диффузия. Броуновское движение.
План:
Свойства молекул идеального газа. Параметры газового состояния.
2.Статистический и термодинамический методы изучения состояний.
3.Основное уравнение молекулярно-кинетической теории газов.
4.Основные законы идеального газа
1.Свойства молекул идеального газа. Параметры газового состояния.
Идеальный газ рассматривается как совокупность материальных точек нулевого размера, лишенных механических свойств, или, в крайнем случае, как бесконечно малые идеально упругие шарики. Молекулы газа или покоятся или непрерывно и хаотически движутся, причем все направления движения строго равновероятны. Равновероятны не только направления движения, но и виды движения: поступательное, вращательное, колебательное. Известный опыт Перрена подтверждает разумность этих утверждений.
Взаимодействие между молекулами и со стенками сосудов осуществляется путем идеально упругих столкновений.
Любая совокупность молекул идеального газа характеризуется следующими параметрами:
mo – масса одной молекулы,
M – масса некоторого объема,
- молярная масса газа,
V – объем, занимаемый данной массой газа,
р – давление, испытываемое или создаваемое газом,
Т – температура газа.
Совокупность параметров определяет состояние газа. При изменении состояния газа параметры могут меняться или по отдельности или все вместе.
Установлено, что модель идеального газа хорошо описывает состояния реальных газов, если они разрежены, пока их давление не превышает 1 МПа.
2.Статистический и термодинамический методы изучения состояний.
Движение каждой молекулы тела может быть описано законами классической механики. Однако число молекул во всяком теле чрезвычайно велико (например, в 1 см3 воздуха при нормальных условиях содержится 2,691019 молекул), а направление и величина скорости каждой из них в данный момент случайны. Поэтому на первый взгляд кажется, что, опираясь на законы механики, невозможно сделать какие-либо выводы о поведении молекул – невообразимый хаос. На самом деле это не так.
Свойства огромного скопления молекул, образующих тело, подчиняются особым статическим закономерностям и могут быть изучены с помощью особого (статистического) метода.
Статистический метод соответствует известному положению диалектического материализма о соотношении случайности и необходимости. Хотя скорость и направление движения каждой молекулы в любой момент времени случайны, в совокупном движении огромного числа молекул проявляются определенные закономерности. Так, оказывается, что большинство молекул обладает величинами скорости, энергии, импульса и других характеристик движения, близкими к некоторым вполне определенным при данных условиях величинам. Они называются «наиболее вероятными».
С помощью особого математического аппарата — теории вероятностей — вычисляются средние значения физических величин, характеризующие движение всей совокупности молекул (средние скорости молекул, среднее значение энергии молекулы и т. д.). Как мы увидим дальше, в современной физике статистический метод широко используется в форме классической и квантовой статистик и позволяет исследовать весьма разнообразный круг вопросов молекулярной физики.
Наряду со статическим методом для изучения физических явлений применяется термодинамический метод.
Термодинамика не оперирует с отдельными атомами и молекулами, она изучает условия превращения энергии из одного вида в другой и характеризует эти превращения энергии с количественной стороны. В основе термодинамики лежат два экспериментально установленных закона, которые часто называют первым и вторым началами термодинамики, а также принцип недостижимости абсолютного нуля (третье начало термодинамики). С помощью этих законов можно, не делая никаких предположений о молекулярном строении изучаемых тел, получить многие сведения о свойствах тел (и не только газообразных) в различных условиях.
Совокупность рассматриваемых тел, обменивающихся энергией, как между собой, так и с другими (внешними) телами, называется термодинамической системой. В основе термодинамического метода исследования лежит понятие о состоянии термодинамической системы. Состояние системы определяется совокупностью значений всех величин, характеризующих физические свойства системы и называемых ее термодинамическими параметрами. В качестве примера термодинамических параметров тел можно назвать их температуру, плотность, теплоемкость и т. д. Два состояния системы считаются разными, если для них неодинаковы значения хотя бы одного из термодинамических параметров.
Состояние термодинамической системы называется стационарным, если значения всех термодинамических параметров системы не изменяются во времени. Стационарное состояние системы называется равновесным, если его неизменность во времени не обусловлена протеканием каких-либо процессов во внешних по отношению к системе телах.
Исследования показывают, что для каждого тела термодинамические параметры взаимно связаны. Например, вязкость и многие другие свойства тела зависят от их температуры. Поэтому оказывается, что равновесное состояние термодинамической системы однозначно определяется заданием значений ограниченного числа ее термодинамических параметров, называемых параметрами состояния.
Важнейшими параметрами состояния химически однородной системы являются: плотность , или связанный с ней объем v, занимаемый единицей массы вещества (удельный объем), давление р и температура Т. Между этими тремя основными параметрами состояния существует связь, называемая уравнением состояния:
f(p,v,T)=0.
Зная уравнение состояния вещества и используя законы термодинамики, можно изучать свойства веществ в различных агрегатных состояниях.
Между статистическим и термодинамическим методами существуют глубокие связи. Современная физика развивается на базе тесного сочетания обоих методов.
После этих предварительных замечаний перейдем к изучению идеальных газов, свойства которых легче всего поддаются исследованию.
3.Основное уравнение молекулярно-кинетической теории газов.
Основным уравнением молекулярно-кинетической теории газов принято называть уравнение, устанавливающее связь между давлением газа, его температурой и энергией движения его молекул. При его получении мы будем пользоваться статистическим методом: проанализируем процесс взаимодействия одной молекулы со стенкой сосуда, а ответ потом обобщим на скопление молекул.
Для установления этого закона рассмотрим некоторый объём газа, заключенный внутри куба со стороной L (рис.8.1).
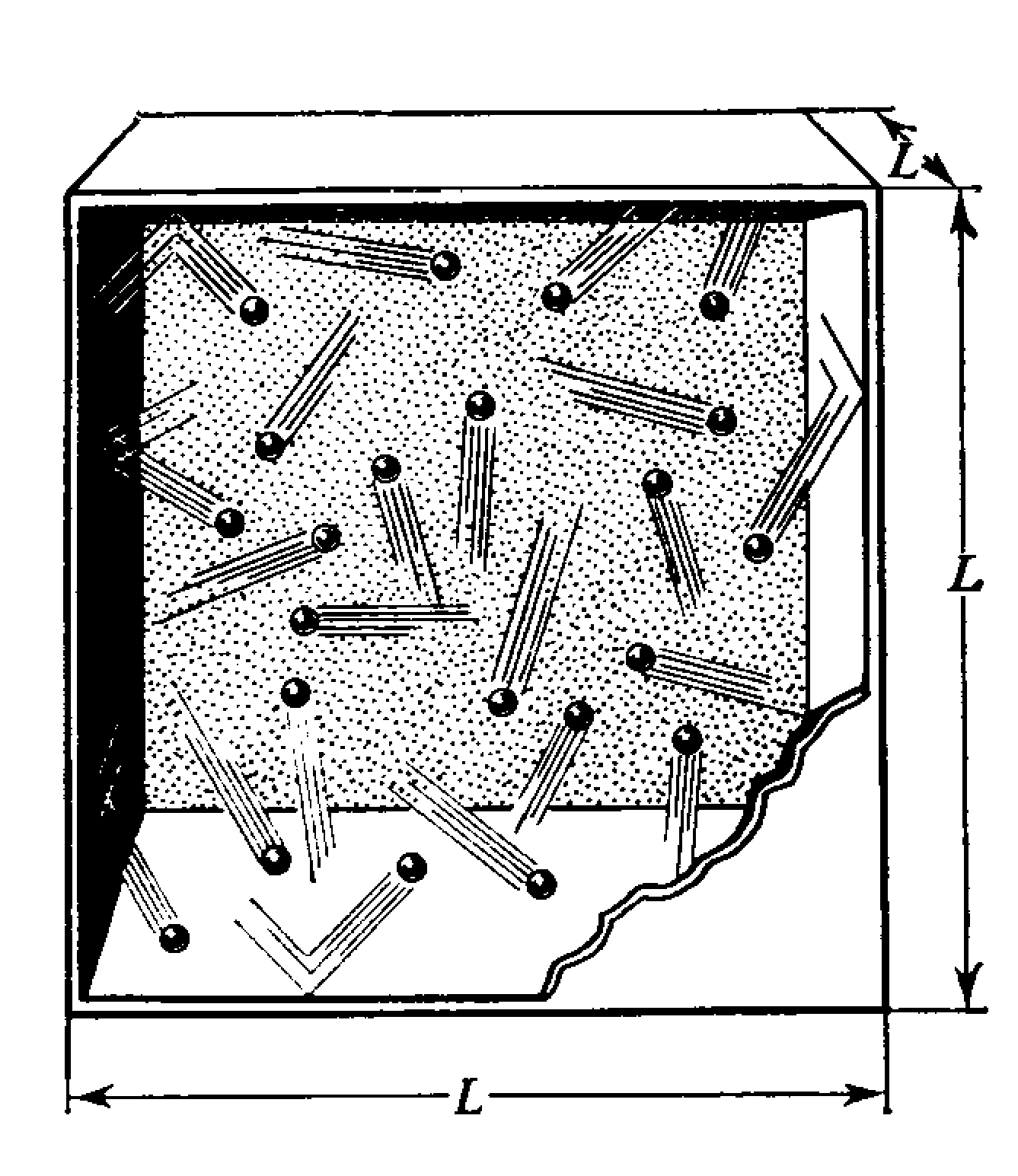 
        у F у F 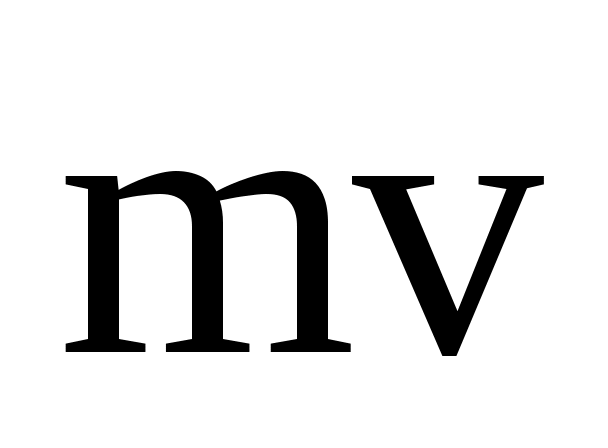
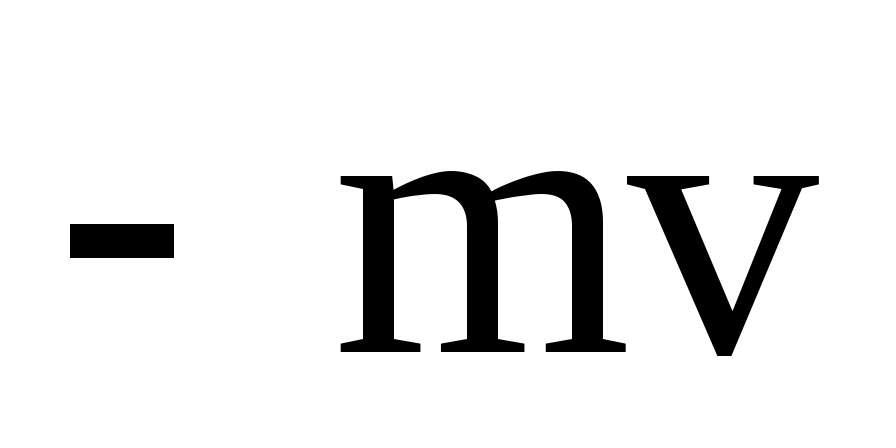
Рис.8.1. К выводу основного уравнения молекулярно-кинетической теории
(МКТ) газов.
Этот объём V=L3 содержит N одинаковых молекул, масса которых равна m, температура также везде одинакова и равна Т.
Молекулы испытывают идеально упругие соударения со стенками сосуда- скорость после соударения изменяется по направлению на противоположное, но остается неизменной по величине. Однако изменение направления скорости означает изменение импульса молекулы, следовательно, стенка должна испытывать импульс силы. Совокупность сил воздействия всех молекул со стенками сосуда и составляет давление, производимое газом на стенки сосуда.
Рассмотрим взаимодействие одной «черной» молекулы со стенкой сосуда, перпендикулярной оси у.
Молекула обладает до удара импульсом 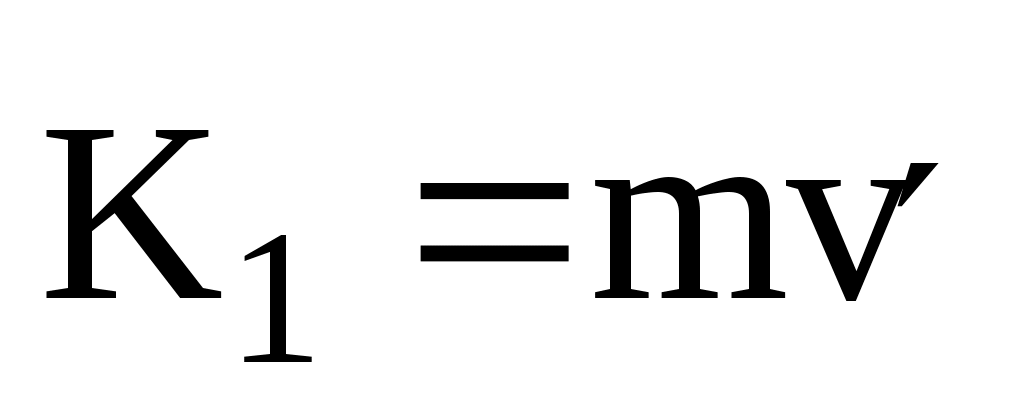 , после удара , после удара 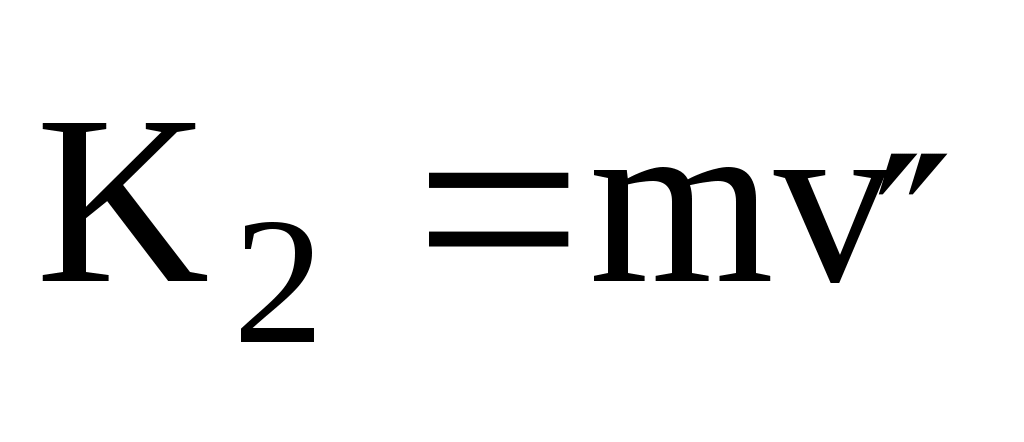 , причем , причем 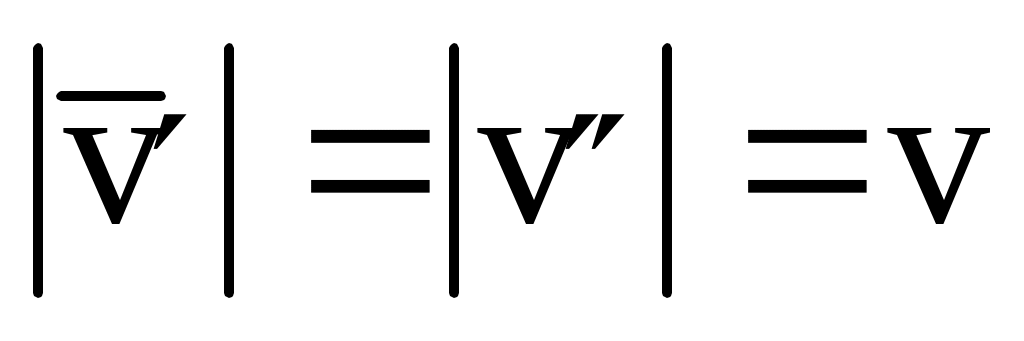 , так как , так как  , то , то 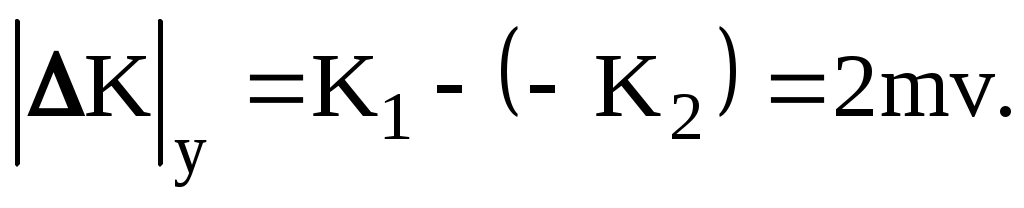
По II-му закону Ньютона импульс силы, испытываемый стенкой от однократного удара молекулы равен
ft = 2mv = K,
где f – средняя сила взаимодействия за время, равное t – продолжительности однократного удара.
Если скорость этой конкретной «черной» молекулы v1, то следующее соударение той же молекулы о ту же стенку произойдет через время
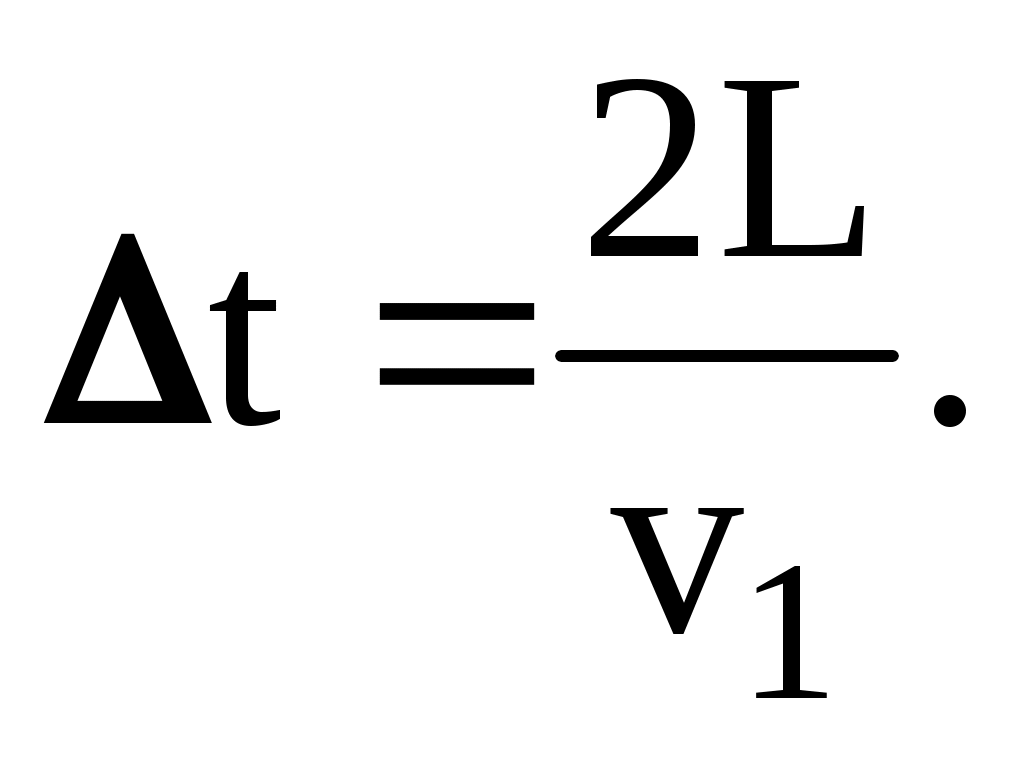
Соответственно, сила воздействия одной молекулы на одну стенку, усредненная на временном отрезке t, будет равна
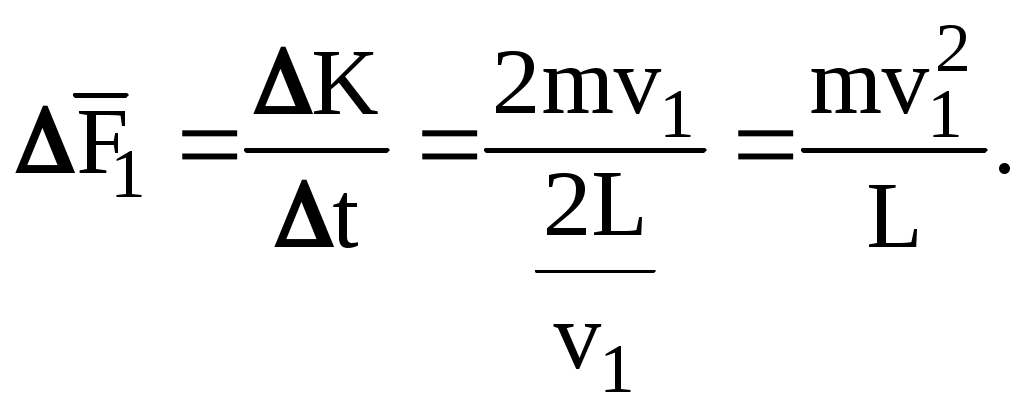
Определим теперь результат воздействия от всех молекул, содержащихся в нашем «ящике».
Поскольку движение молекул во всех направлениях равновероятно, то естественно предположить, что в направлении каждой из осей движется лишь треть от их общего числа:
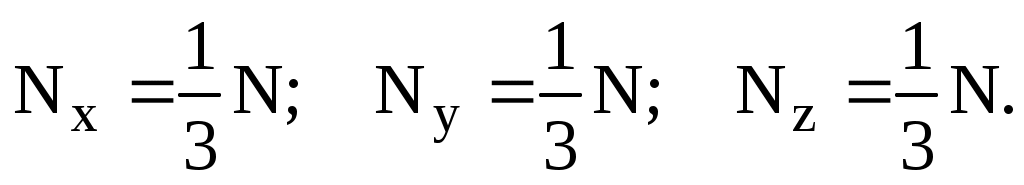
Скорости молекул, конечно, различны, поэтому суммарная сила, испытываемая выбранной нами стенкой, равна
Fy = F1+F2+…+FNy = 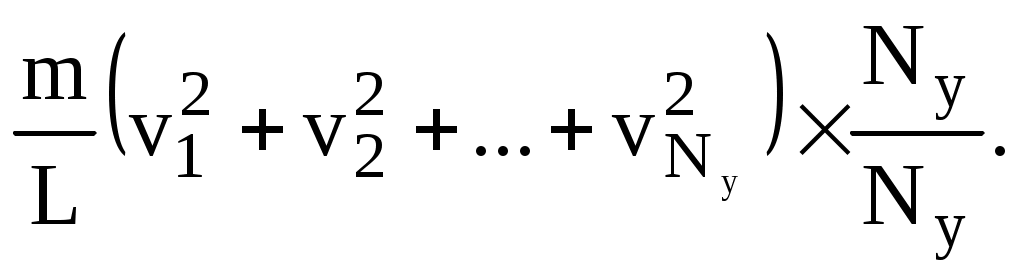 (8.1) (8.1)
В принципе величины скоростей всех молекул различны, но можно преодолеть эту сложную проблему, заменив сумму квадратов скоростей квадратом средней квадратичной скорости кв2>, который представляет собой среднее арифметическое из квадратов скоростей отдельных молекул:
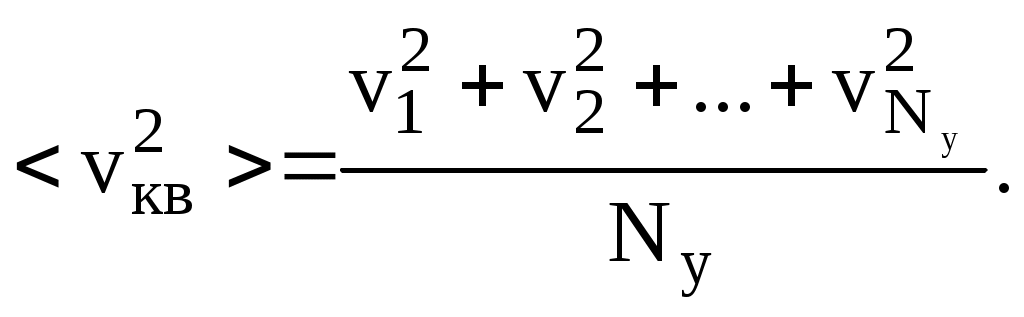 (8.2) (8.2)
Следовательно, после доумножения и деления (8.1) на Ny, и с учетом (8.2) можно записать
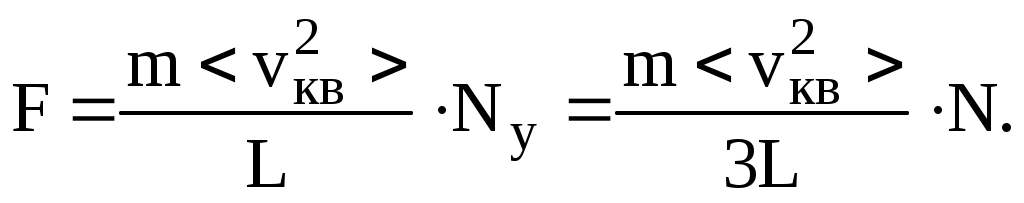 (Учтено, что Ny = 1/3 N). (Учтено, что Ny = 1/3 N).
Определим теперь давление р, как силу, действующую на единицу площади
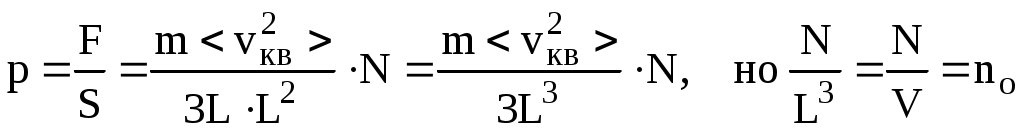 - концентрация молекул, - концентрация молекул,
а 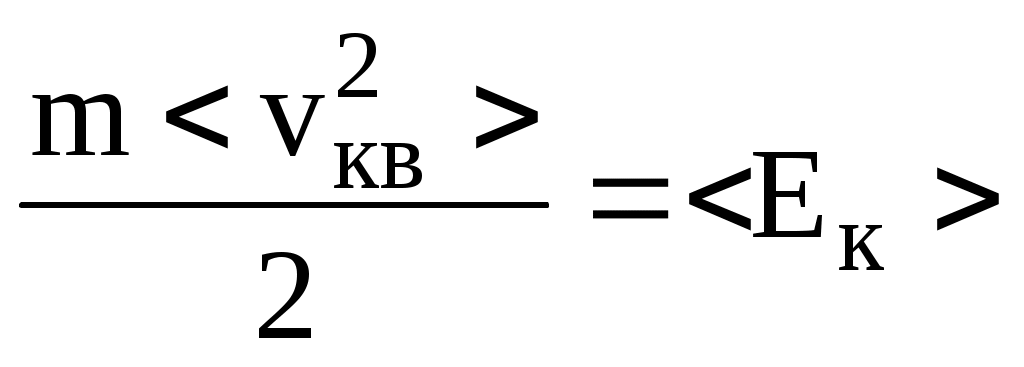 - средняя кинетическая энергия молекул газа. - средняя кинетическая энергия молекул газа.
И так, можно записать ряд равноправных выражений, описывающих основной закон МКТ: так, можно записать ряд равноправных выражений, описывающих основной закон МКТ:
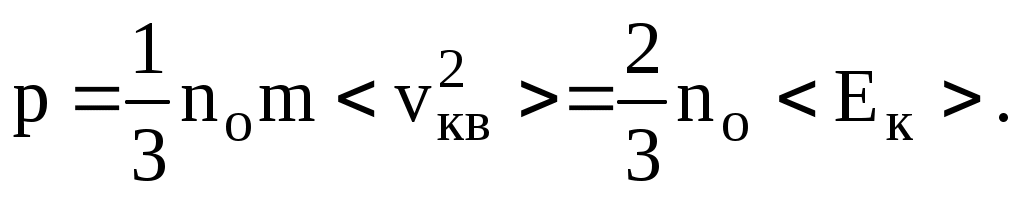 (8.3) (8.3)
Связь <vкв>, <Eк> молекул и давления р с температурой.
Абсолютная температура Т является фундаментальной термодинамической характеристикой газа. Поэтому для выявления связи с температурой величин скорости и средней кинетической энергии воспользуемся некоторыми представлениями термодинамики. В частности, фундаментальным утверждением термодинамики является закон о равномерном распределении энергии движения молекул по степеням свободы молекул. На каждую степень свободы приходится 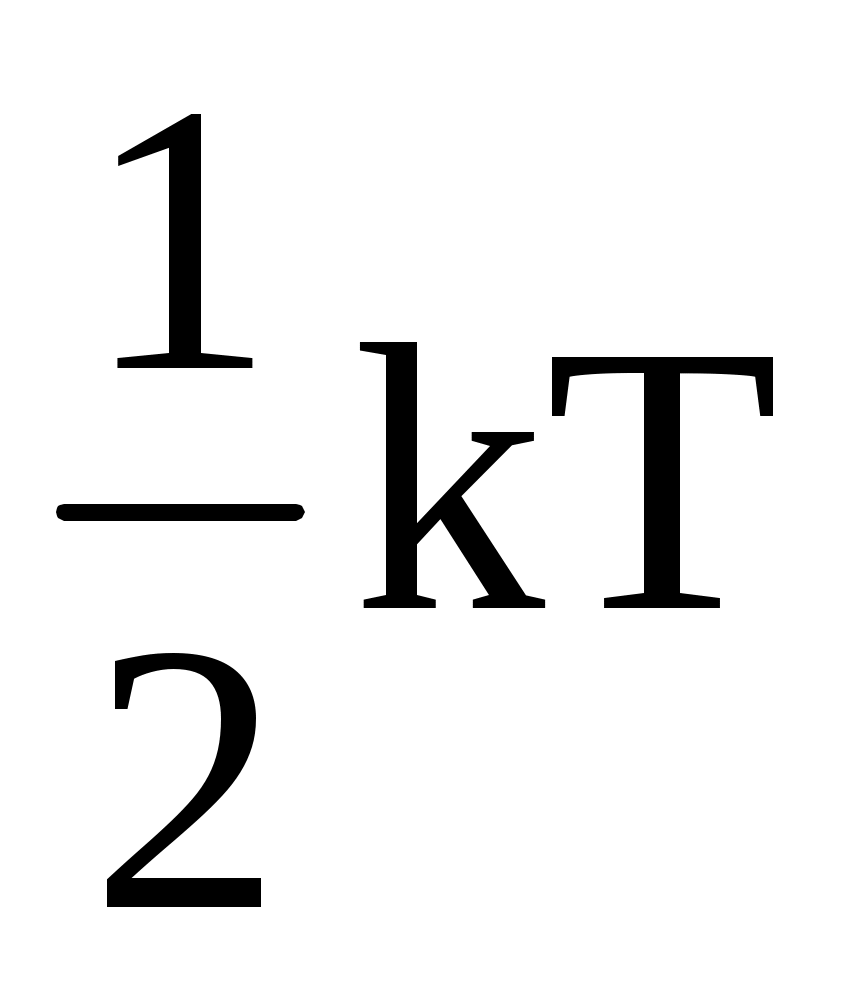 энергии. энергии.
Полная энергия одной молекулы равна 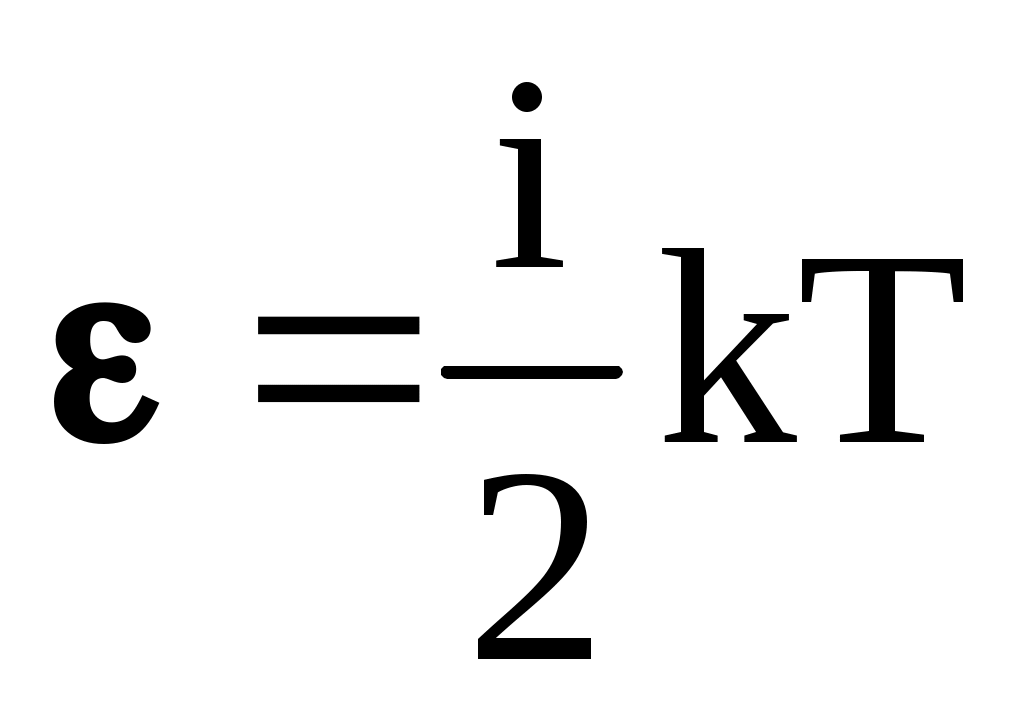 , где i – число степеней свободы , где i – число степеней свободы
(i = 3 для одноатомных газов, i = 5 – для двухатомных молекул, i = 6 – для трех- и многоатомных молекул).
По определению идеального газа, он – одноатомный, поэтому для его молекулы 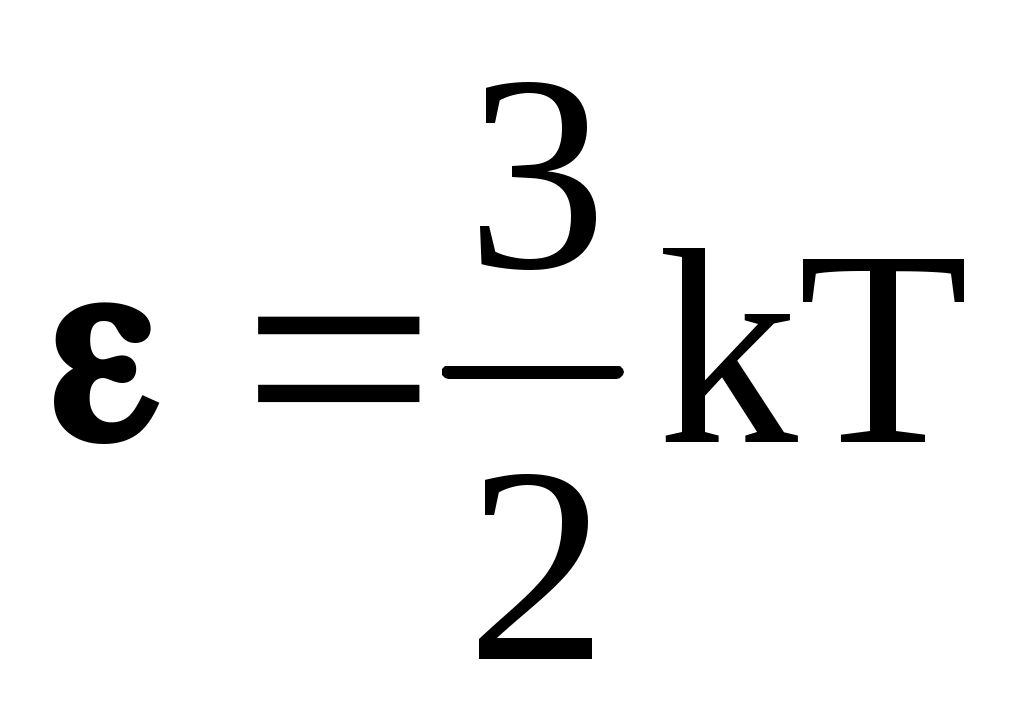 , в то же время эта энергия равна , в то же время эта энергия равна 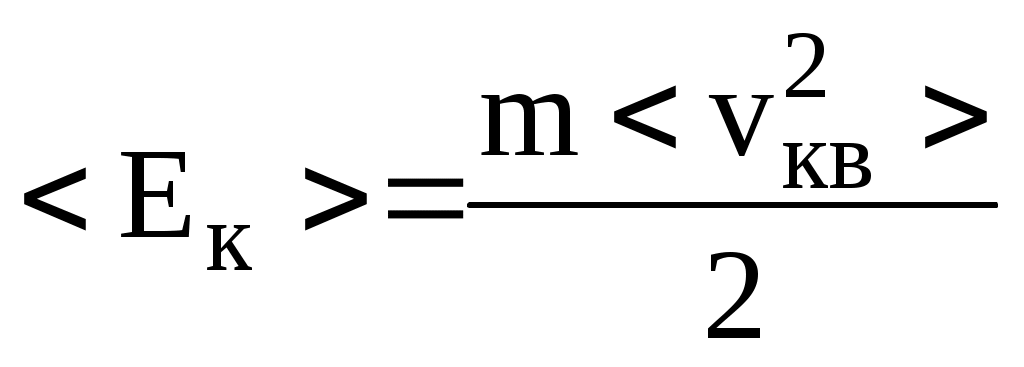 . Следовательно, . Следовательно,
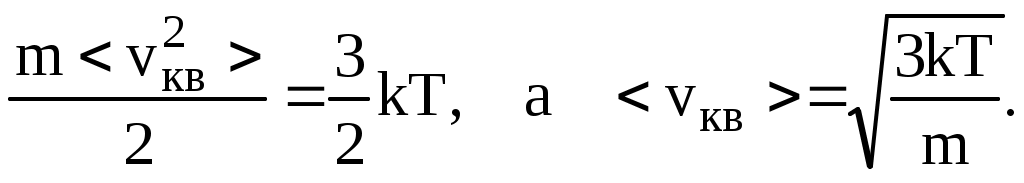 Поскольку mкв2> = 3kT, то Поскольку mкв2> = 3kT, то
p = nokT. (8.4)
Опираясь на последнее соотношение, получим основные уравнения, которым подчиняются состояния идеального газа.
Основные законы идеального газа: уравнения и графики.
Рассмотрим уравнение (8.4) применительно к одному молю идеального газа. Домножим левую и правую части этого равенства на Vo – объем, занимаемый одним молем газа.
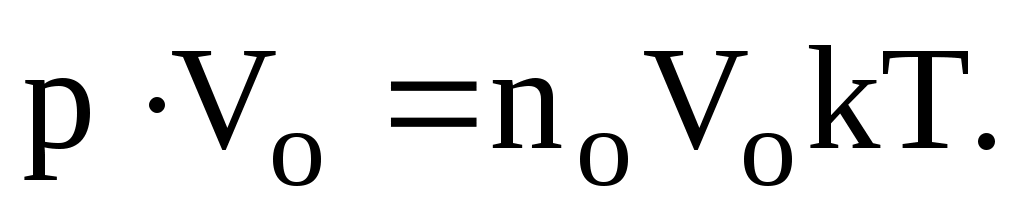
Но noVo = NA – число Авогадро, число молекул в моле любого вещества, далее
NAk = R = 8,31 Дж/(мольК) – универсальная газовая постоянная.
В результате получаем
PVo = RT – уравнение Клапейрона, (8.5)
описывающее состояние одного моля идеального газа, связывающее три основных параметра газа – p,V и Т.
Если рассматривается не один моль, то вместо Vo в уравнении (8.5) слева следует использовать произвольный объём V, а справа произведение следует дополнить числом молей вещества = М/.
Получаем известное уравнение Менделеева-Клапейрона:
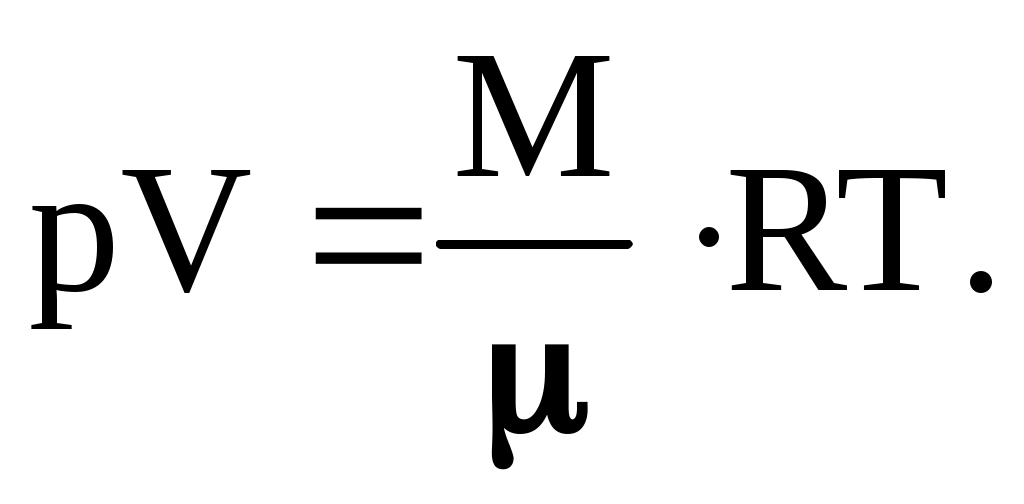
Частным случаем последнего уравнения является так называемый объединенный газовый закон, описывающий переход идеального газа из одного состояния в другое. Если рассматривается изолированная система, то переход по ряду состояний идеального газа сопровождается выполнением равенства
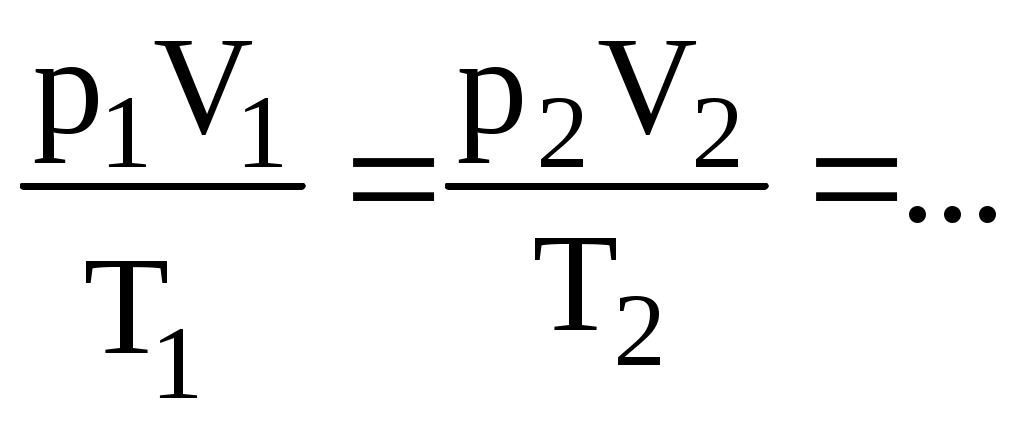 (8.6) (8.6)
Из последнего равенства легко получить основные уравнения для изопроцессов в газах, известные из курса средней школы.
Изотермический процесс (T = const).
p 1V1 = p2V2 pV = const при постоянной температуре в изолированной системе – закон Бойля-Мариотта. (8.7) 1V1 = p2V2 pV = const при постоянной температуре в изолированной системе – закон Бойля-Мариотта. (8.7)
  p Рис. 8.2. Графики изотермических p Рис. 8.2. Графики изотермических
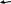 T2 процессов. T2 процессов.
 гипербола гипербола
 T12 T12

0 V
Изохорный процесс (V = const).
   - закон Шарля. (8.9) - закон Шарля. (8.9)
  а) p б) p p02 а) p б) p p02
 
V1
 V2 V2      p01 p01
0 T,К - 273 0 t,oC
Рис.8.3. Графики изохорных процессов.
С учетом условий рис.8.3,б, где графики p=p(t,oC) построены в зависимости от температуры в шкале Цельсия, уравнение Шарля можно записать в форме
pt = po(1+t), (8.10)
где ро - давление взятой массы газа при t = 0oC, 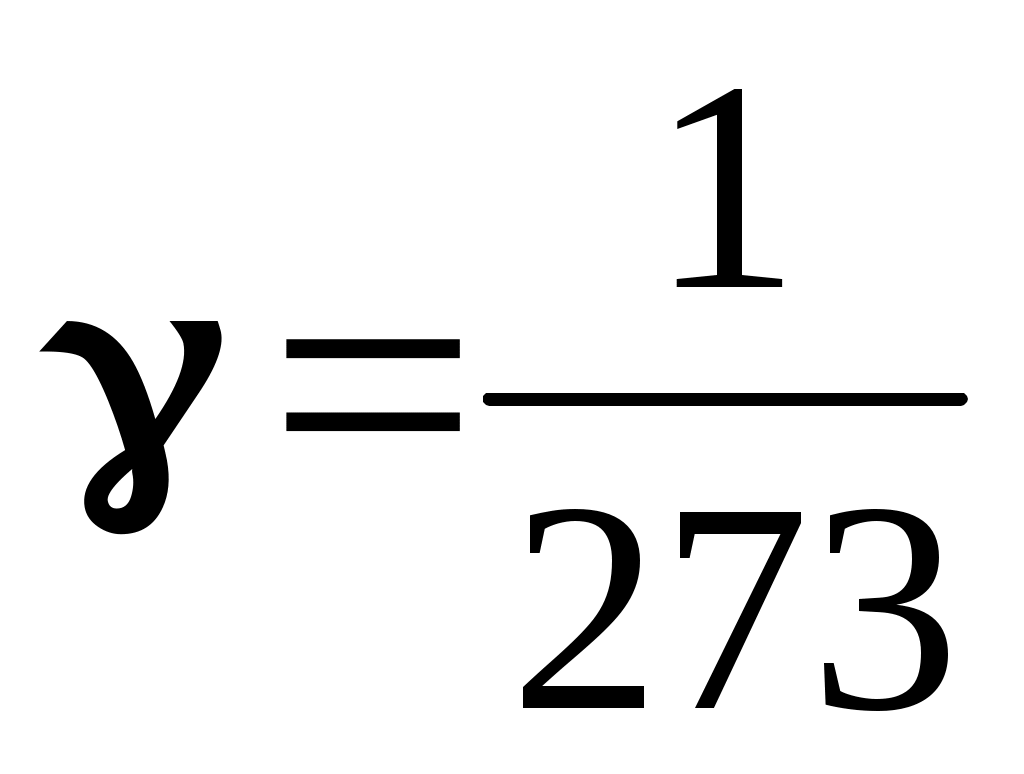 - температурный коэффициент давления, одинаковый для всех газов. - температурный коэффициент давления, одинаковый для всех газов.
Изобарный процесс (p = const)/
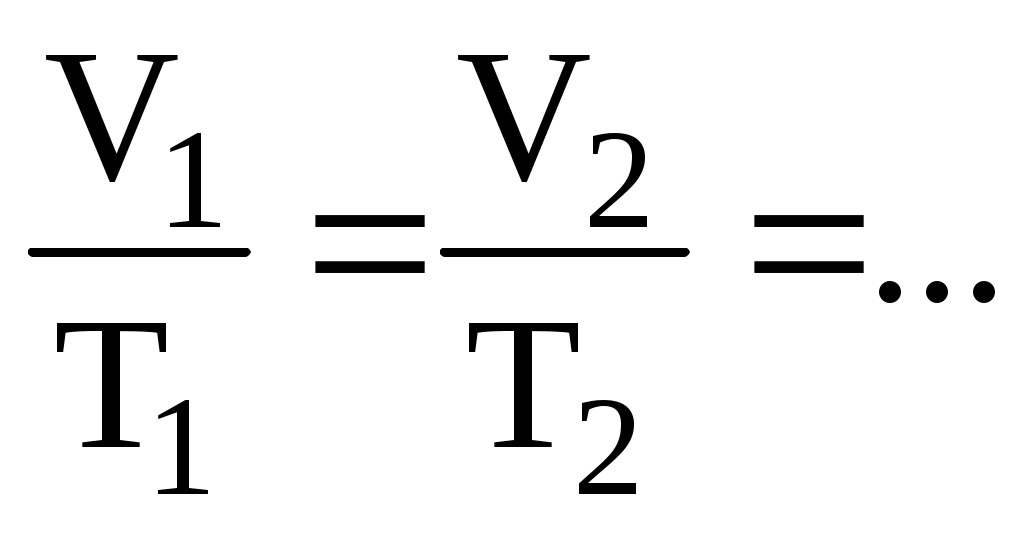 - закон Гей-Люссака. (8.11) - закон Гей-Люссака. (8.11)
   V V V V

  p1 V01 p1 V01
  p2 V02 p2 V02
    0 T,K -273 0 t,oC 0 T,K -273 0 t,oC
Рис.8.4. Графики изобарных процессов.
По аналогии с уравнением (8.10), закон Гей-Люссака применительно к шкале температур можно записать в форме
Vt = Vo(1+t),
где Vo – объем взятой массы газа при 0оС, а - температурный коэффициент расширения, одинаковый для всех газов и равный 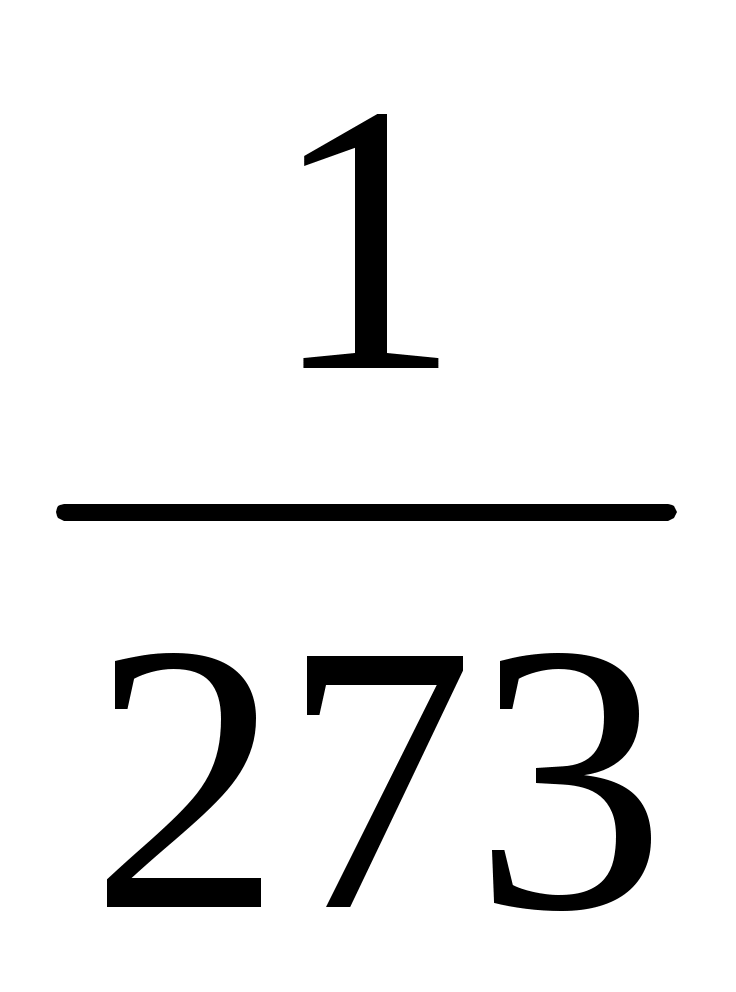 . .
Закон Дальтона.
Так как по модели идеального газа его молекулы размеров не имеют, то в любой сосуд можно поместить любое количество любых газов.
Закон Дальтона позволяет определить давление смеси идеальных газов как аддитивную сумму парциальных давлений компонентов смеси.
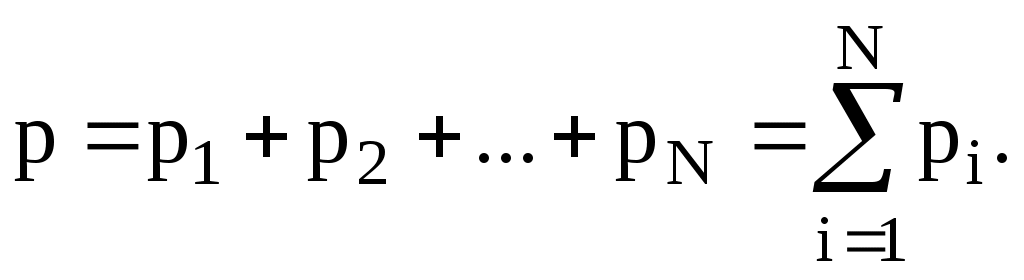
Здесь рi – парциальное давление i-ого компонента смеси, давление, которое создавал бы данный компонент в сосуде, занимая один весь объём. |
 Скачать 287.5 Kb.
Скачать 287.5 Kb.






 у F
у F 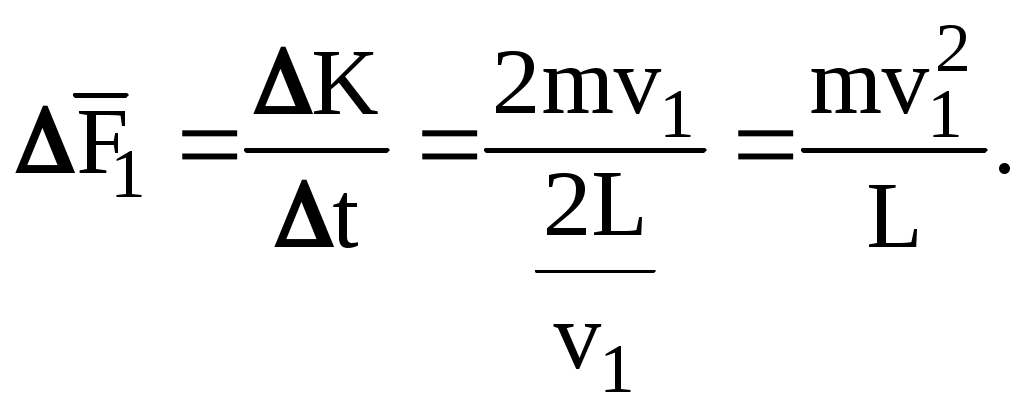
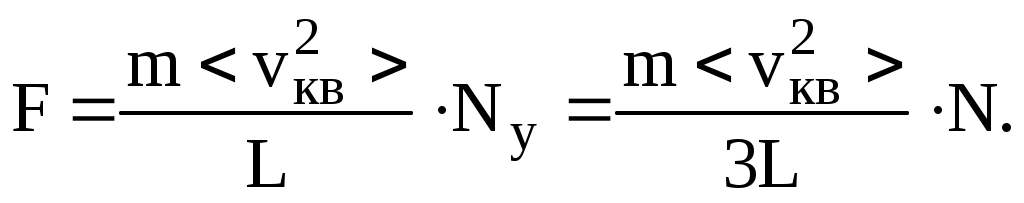 (Учтено, что Ny = 1/3 N).
(Учтено, что Ny = 1/3 N).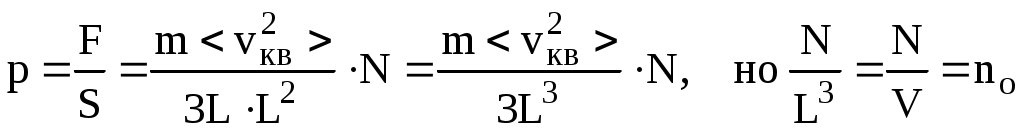 - концентрация молекул,
- концентрация молекул, 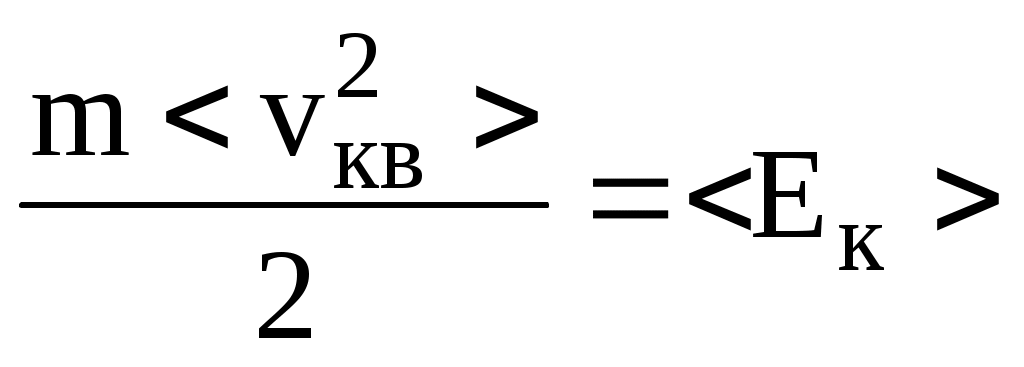 - средняя кинетическая энергия молекул газа.
- средняя кинетическая энергия молекул газа. так, можно записать ряд равноправных выражений, описывающих основной закон МКТ:
так, можно записать ряд равноправных выражений, описывающих основной закон МКТ: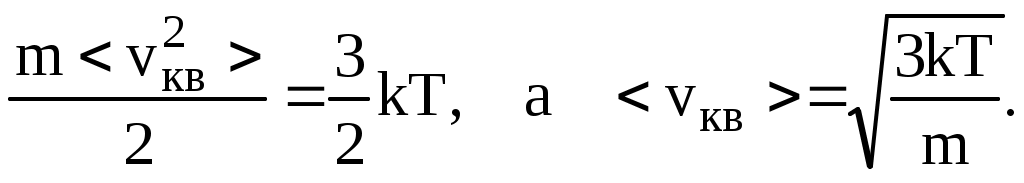 Поскольку m
Поскольку m 1V1 = p2V2 pV = const при постоянной температуре в изолированной системе – закон Бойля-Мариотта. (8.7)
1V1 = p2V2 pV = const при постоянной температуре в изолированной системе – закон Бойля-Мариотта. (8.7)
 p Рис. 8.2. Графики изотермических
p Рис. 8.2. Графики изотермических  T2 процессов.
T2 процессов. гипербола
гипербола T1
T1

 - закон Шарля. (8.9)
- закон Шарля. (8.9)
 а) p б) p p02
а) p б) p p02

 V2
V2 


 p01
p01

 V V
V V

 p1 V01
p1 V01
 p2 V02
p2 V02 


 0 T,K -273 0 t,oC
0 T,K -273 0 t,oC