Лр 18. 03. 02. 01. 000 От
 Скачать 60.54 Kb. Скачать 60.54 Kb.
|
|
Изм. Лист № докум. Подпись Дата Лист 2 ЛР 18.03.02.01.000 ОТ Цель работы Целью работы является:
2) Ознакомление с технологией электрохимического получения едкого натра, хлора и водорода электролизом водного раствора хлорида натрия в лабораторном диафрагменном электролизере непрерывного действия; 3) Определение технологических показателей процесса: выхода по току продуктов электролиза и расходные коэффициенты по электроэнергии. 4) Построение графика зависимости выхода по току NaOH от напряжения. Описание лабораторной установки Основными элементами установки являются электролизер 5 и блок питания 1 - источник постоянного тока с измерительными приборами. В верхней крышке электролизера закреплена шина горизонтального графитового анода 4 (диаметр анода 4 см, высота 1 см). Между корпусом и нижней конической крышкой установлен дырчатый медный катод 2 и пористая асбестовая диафрагма 3. Через патрубок, установленный на верхней крышке, в электролизер подается насыщенный раствор хлорида натрия из сосуда 6. Через патрубок 8 осуществляется отсос раствора из анодного пространства водоструйным насосом 13. На линии отхода хлора установлена трубка Лунге 10, заполненная раствором тиосульфата натрия (возможно также заполнение трубки Лунге 9 – 10 % раствором сульфита натрия) для поглощения хлора. Католит через патрубок 11 поступает в приемную емкость 12. 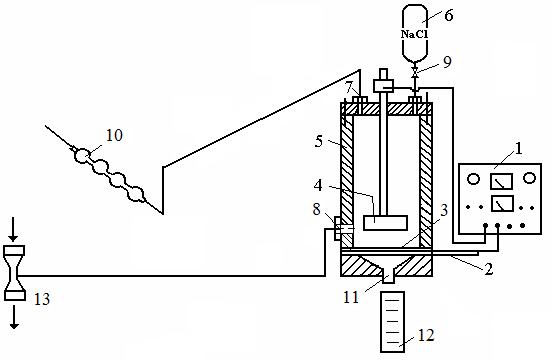 1 - блок питания; 2 - медный катод; 3 - асбестовая диафрагма; 4 - графитовый анод; 5 - электролизер; 6 - сосуд для раствора хлорида натрия; 7 - патрубок для отвода газообразного хлора; 8 - патрубок для отсоса анолита; 9 - зажим; 10 - трубка Лунге; 11 - патрубок вывода католита; 12 - сборник католита; 13 - водоструйный насос Рисунок 1 - Схема лабораторной установки электролизера хлорида натрия Порядок выполнения работы Изм. Лист № докум. Подпись Дата Лист 3 ЛР 18.03.02.01.000 ОТ Залить 100 мл насыщенного раствора хлорида натрия в емкость 6, ослабляя зажим 9, заполнить раствором электролизер. Уровень раствора в электролизере должен быть на 5 мм выше анода. В ходе работы уровень поддерживается постоянным.
Анализ католита При объёме католита (V1 ) более 10 мл пипеткой отбирают 10 мл католита и помещают в коническую колбу, а если количество полученного католита менее 10 мл, то для титрования забирают весь католит, доводят объём раствора в конической колбе до 20 – 25 мл дистиллированной водой, добавляют несколько капель фенолфталеина и титруют 0,5 N раствором соляной кислоты. Если индикатор обесцвечивается из-за присутствия в растворе ионов ОН-, то добавляют в пробу 2 - 3 мл 3 %-ного раствора перекиси водорода и титруют в колбе как обычно. Содержание щелочи в католите (GNaOH , г), определяют по формуле: GNaOH 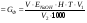 ; ; где V - количество кислоты, пошедшее на титрование, мл; ЕNaOH- эквивалент гидроксида натрия (40); Н - нормальность кислоты; Т - поправка к нормальности кислоты; V1 - количество полученного католита, мл; V2 - количество католита, взятого для титрования, мл. Методы расчета Изм. Лист № докум. Подпись Дата Лист 4 ЛР 18.03.02.01.000 ОТ Коэффициент разложения хлорида натрия в процессе электролиза определяют по формуле: = C1/C2; C1= 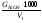 ; ; C2= 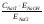 , , где С1 - концентрация гидроксида натрия в католите, г/л; С2 - концентрация гидроксида натрия в католите при полном разложении NaСl, г/л; ЕNaСl- эквивалент NaCl (58,5); СNaCl - концентрация NaCl в исходном электролите, г/л. Концентрация СNaCl определяется по плотности раствора (таблица 1). Таблица 1 - Плотность раствора NaCl при 20 0С
Определение выхода по току Теоретическое количество гидроксида натрия рассчитывают по закону Фарадея: 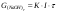 , г. , г. Определяют выход по току для гидроксида натрия: А = 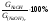 . . Изм. Лист № докум. Подпись Дата Лист 5 ЛР 18.03.02.01.000 ОТ Рассчитывают теоретический (Wт) и практический (Wф) расходы электроэнергии на 1 кг гидроксида натрия: 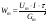 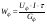 . . Определяют степень использования энергии: 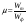 . . Расчёты
Опыт №1 U = 3 B I = 0.05 A ρ(NaCl) = 1,18 г/см3 V(HCl) = 0,2 мл V(NaOH) = 3 мл G(NaOH) = (0,2*40*0,5*1*3)/(3*1000) = 0,004 г С1 = 0,004*1000/3 = 1,33 г/л С2 = 283,3*40/58,5 = 193,71 г/л φ = 1,33/193,71 = 0,0068 G(NaOH)т = 1,493*0,05*0,25 = 0,018 г А = 0,004/0,018 *100% = 0,22 = 22% Wm = 3*0,05*0,25/0,004 = 9,37 Wф = 3*0,05*0,25/0,018 = 2,08 µ = 9,37/2,08 = 4,5 Опыт №2 U = 4 B I = 0.07 A ρ(NaCl) = 1,18 г/см3 V(HCl) = 0,6 мл V(NaOH) = 7 мл G(NaOH) = (0,6*40*0,5*1*7/(7*1000) = 0,012 г С1 = 0,012*1000/7 = 1,71 г/л С2 = 283,3*40/58,5 = 193,71 г/л φ = 1,71/193,71 = 0,088 G(NaOH)т = 1,493*0,07*0,18 = 0,018 А = 0,012/0,018 *100% = 0,66 = 66% Wm = 4*0,07*0,18/0,012 = 4,2 Wф = 4*0,07*0,18/0,018 = 2,8 Изм. Лист № докум. Подпись Дата Лист 6 ЛР 18.03.02.01.000 ОТ µ = 4,2/2,8 = 1,5 Опыт №3 U = 5B I = 0,1A ρ(NaCl) = 1,18 г/см3 V(HCl) = 0,6 мл V(NaOH) = 5,2 мл G(NaOH) = (0,6*40*0,5*1*5,2)/(5,2*1000) = 0,012 г С1 = 0,012*1000/5,2 = 2,3 г/л С2 = 283,3*40/58,5 = 193,71 г/л φ = 2,3/193,71 = 0,0118 G(NaOH)т = 1,493*0,1*0,16 =0,023 А = 0,012/0,023*100% = 0,52 = 52% Wm = 5*0,1*0,16/0,012 = 6,66 Wф = 5*0,1*0,16/0,023 = 3,47 µ = 6,66/3,47 = 1,91 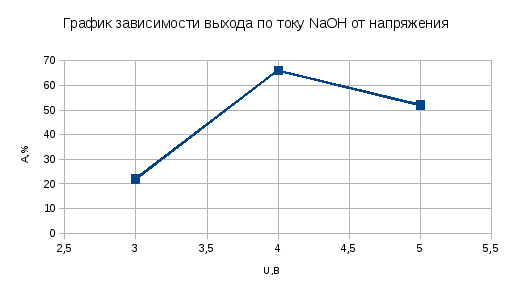 Рисунок 2 - График зависимости выхода по току NaOH от напряжения Вывод: Изм. Лист № докум. Подпись Дата Лист 7 ЛР 18.03.02.01.000 ОТ 1)Изучили основные закономерности электрохимического процесса. 2)Ознакомились с технологией электрохимического получения едкого натра, хлора и водорода электролизом водного раствора хлорида натрия в лабораторном диафрагменном электролизере непрерывного действия 3)Определили технологические показатели процесса: выхода по току продуктов электролиза и расходные коэффициенты по электроэнергии. 4)Построили график зависимости выхода по току NaOH от напряжения, из которого следует, что при повышении напряжения выход тока увеличивается. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
