экология. Механические химические физикохимические
 Скачать 171.97 Kb. Скачать 171.97 Kb.
|
|
Для очистки бытовых и производственных сточных вод используют следующие методы: - механические; - химические; - физико-химические; - биологические. Метод очистки и состав очистных сооружений выбирают в зависимости от требуемой степени очистки, состава загрязнений, пропускной способности очистной станции, грунтовых условий и мощности водного объекта с соответствующим технико-экономическим обоснованием. Методы механической очистки используются для удаления из растворов твердых нерастворимых примесей и позволяют обычно выделять частицы крупнее 50 мкм. Эти вещества, выделенные из воды в виде осадка, представляют собой сильно обводненную массу, объем которой в десятки раз превышает их начальный объем. Выбор метода осветления зависит от дисперсности частиц, физико-химических свойств примесей, их концентрации, расхода воды, требуемой степени очистки и т.д. Применяют следующие методы: процеживание; отстаивание; центрифугирование; фильтрация; флотация. Первые четыре метода являются чисто механическими приемами, а флотацию можно отнести к физико-химическим методам. Все эти методы могут применяться раздельно или в комплексе, а также как первичная подготовка воды или как одна из завершающих стадий после применения других физико- Фильтрация. В зависимости от количества и характера примесей, а также расхода сточных вод и требований к осветленной воде применяют фильтры с зернистой загрузкой или с фильтровальной перегородкой (тонкостенные фильтры, где используются пленки, ткани, пористые материалы, сетки, порошки и т.д.). При фильтровании через зернистую загрузку различают пленочное и объемное фильтрование. При пленочном фильтровании примеси задерживаются на поверхности материала, что характерно для тонкостенных и медленных зернистых фильтров. В объемном фильтровании примеси задерживаются внутри пор. По такому же принципу работают и все остальные типы фильтров. Помимо широко применяемых материалов естественного происхождения (кварцевый песок, антрацит и керамзит, все больше распространяемые горелые породы, доменные и вулканические шлаки, гранит, пиролюзит, магнетит, аглопорит, шунгизит, ильменит), в фильтрах находят применение искусственные материалы (графит, капрон, полистирол, поливиниловая и полиамидная смолы, кокс и древесный уголь). Иногда материалы естественного происхождения подвергают специальной обработке (силиконом, смолами, окислами железа, полиэлектролитами). Все фильтрующие материалы должны отвечать следующим требованиям: - определенный гранулометрический состав; - механическая прочность на истирание и измельчение; Флотация. Одним из наиболее перспективных методов удаления из сточных вод нерастворенных примесей является флотация. Флотационный метод выделения грубодисперсных частиц (от 3 мм до 10’4 мм) из суспензий основан на способности последних при определенных условиях закрепляться на границе раздела фаз жидкость-газ. Данные методы используют для очистки от растворенных и коллоидных примесей, а в некоторых случаях - и от взвешенных веществ. К ним можно отнести следующие: коагуляция и флокуляция, флотация; сорбция; ионообменная и электрохимическая очистка; экстракция; реагентная очистка; мембранные методы. Коагуляция. Наибольшее практическое значение для очистки воды имеет коагуляция, при которой снижение (исчезновение) энергетического барьера, препятствующего слипанию частиц, происходит за счет повышения концентрации электролитов. Коагуляция - это процесс слипания частиц коллоидной системы в результате их взаимодействия под действием молекулярных сил сцепления при перемешивании или направленном перемещении во внешнем силовом поле. В результате коагуляции образуются агрегаты - более крупные (вторичные) частицы, состоящие из скопления мелких (первичных). Для осуществления процесса коагуляции в воду дозируются растворы реагентов (коагулянтов). В основе процесса лежат законы взаимодействия частиц - броуновское движение, силы Ван-дер-Ваальса и межмолекулярные силы. Наиболее распространенными коагулянтами являются соли алюминия (сульфат алюминия АЬ^ОДзЛБНзО, алюминат натрия NaAlCb, оксихлорид алюминия А12(ОН)пС1б.п, на практике в основном используется А12(ОН)5С1, алюмокалиевые квасцы KAb(S04)2) и железа (сульфат железа FeS04, хлориды железа FeCl2, FeCl3, дигидроксохло- рид железа Fe(OH)2Cl). В редких случаях находят применение соли магния, кальция, цинка и титана. Выделение твердой фазы коагулянта из пересыщенного раствора (кристаллизация) протекает в три стадии: а) инкубационный период (образование зародышей); б) рост частиц твердой фазы; в) старение твердой фазы. 5) Флокуляция. Некоторые высокомолекулярные вещества и ПАВ при определенных концентрациях способны самостоятельно, без добавления неорганических электролитов, вызывать агрегацию частиц лиофобных коллоидов. Объединение частиц в агрегаты в этом случае осуществляется в дополнение (а иногда - и взамен) к непосредственному контакту частиц за счет их взаимодействия через молекулы органических веществ. Такие вещества получили название флокулянты, а разделение фаз коллоидных систем с их помощью назвали флокуляцией. Способность высокомолекулярных веществ флокулировать коллоидные частицы была открыта французским исследователем В. Анри в 1903 г. Флокулянты принадлежат к классу линейных полимеров, для которых характерна цепочечная структура макромолекул. Молекулярная масса достигает нескольких миллионов, а длина цепочки, состоящей из ряда повторяющихся звеньев - сотен и тысяч ангстрем. В качестве флокулянтов используют высокомолекулярные вещества, хорошо растворимые в воде. Благодаря большому количеству функциональных групп, одна макромолекула взаимодействует одновременно с несколькими коллоидными частицами, как бы связывая их нитями или мостиками. Согласно мостиковой модели, флокуляция состоит, во-первых, в закреплении концов макромолекул на поверхности частиц, и, во-вторых, в адсорбции простертых в глубину раствора сегментов молекул на вакантных участках соседних частиц. Расход флокулянтов во многом зависит от дисперсности системы. С увеличением дисперсности расход увеличивается, а в ряде случаев флокуляция, как показано на рис. 20, вообще не достигается. Поэтому довольно часто в практике водоподготовки и очистки сточных вод используют совместное действие простых электролитов или коагулянтов и полиэлектролитов. Электролиты, содержащие в своем составе коагулирующие ионы, как бы подготавливают коллоидную систему к флокуляции, снижая энергетический барьер между частицами. Расход флокулянта при этом резко снижается. Адсорбция. Адсорбция в общем случае - это самопроизвольно протекающий диффузионный процесс, который сопровождается понижением энергии Гиббса, и в результате которого происходит концентрирование растворенного компонента или растворителя на поверхности адсорбента. Может быть использована для извлечения как электролитов, так и неэлектролитов, молекулярно растворенных коллоидов, полимерных и мономолекулярных веществ. В зависимости от характера взаимодействия различают несколько типов адсорбции. 1. Физическая адсорбция обусловлена силами межмолекулярного взаимодействия. Она неизбирательна, обратима и характеризуется высокими скоростями. 2. Активированная адсорбция обусловлена взаимодействием с образованием поверхностного соединения особого рода - молекулы, которые вступили во взаимодействие, остаются в кристаллической решетке адсорбента. Вследствие этого для данного процесса характерны избирательность, необратимость и невысокие скорости. 3. Хемосорбция - это обычная химическая реакция, идущая на поверхности адсорбента, при которой выделяется энергия, равная теплоте данной реакции. Знание механизмов протекающих процессов связано с необходимостью целенаправленного и сознательного выбора адсорбента и условий процесса. Эффективность адсорбции веществ из водных растворов зависит от химической природы поверхности, ее величины и доступности, а также химического строения извлекаемого компонента и его состояния в растворе в присутствии сильных электролитов. Для адсорбции органических веществ должны применяться прежде всего углеродистые пористые (различные активные угли) или синтетические материалы. Полярные гидрофильные материалы (глины, силикогели, гидраты окислов) для этого не пригодны, так как энергия взаимодействия с молекулами воды почти равна или выше энергии адсорбции молекул органических веществ. Но, если в водном растворе молекулы или ионы образуют большие ассоциаты (как, например, ионы или молекулы ПАВ с длинной углеводородной цепью или ионы красильных веществ), то энергия адсорбции таких ассоциатов или мицелл значительно больше энергии связи молекул воды с поверхностью даже очень гидрофильных материалов. Основные сведения о сорбционных свойствах материала и характере сорбции на нем определенных веществ могут быть получены из изотерм сорбции, характеризующих зависимость сорбционной способности А от концентрации С сорбируемого компонента при постоянной температуре Процессы адсорбции могут осуществляться в статическом или динамическом вариантах. В статических условиях обрабатываемая вода интенсивно перемешивается с сорбентом в течение определенного времени достижения равновесия, а затем отделяется от него отстаиванием или фильтрацией. Последующим введением в отделяемую воду новых порций сорбента можно достичь практически любой заданной степени очистки или концентрации извлекаемого компонента. На рис. 22 представлена схема сорбционной установки. 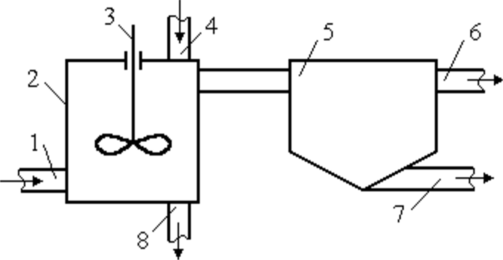 Рис. 22. Схема сорбционной установки: 1 - трубопровод; 2 - адсорбер; 3 - импеллер; 4 - трубопровод для подачи адсорбента; 5 - отстойник; 6 - трубопровод для отведения очищенной воды; 7 - трубопровод для отведения адсорбента; 8 - трубопровод для удаления осадка Сточная вода поступает в адсорбер по трубопроводу. По трубопроводу подается адсорбент, перемешиваемый со стоками импеллером. Адсорбент с поглощенными примесями оседает на дно адсорбера, откуда удаляется через трубопровод. Сточная вода со взвешенными частицами сорбента поступает в отстойник, в котором частицы сорбента оседают на дно и удаляются по трубопроводу, а очищенная сточная вода направляется по трубопроводу для последующей обработки. Обычно используется многоступенчатый вариант адсорбции, так как степень очистки повышается и снижается расход адсорбента. Динамический вариант адсорбции в сравнении со статическим имеет большие технологические, эксплуатационные и экономические преимущества: более полно используется обменная емкость адсорбента, уменьшается количество его регенераций, упрощается аппаратурное оформление процесса и его автоматизация. Одним из важных вопросов в процессе эксплуатации адсорбционных аппаратов является регенерация адсорбента. Вообще сорбционная очистка может быть регенеративной (извлеченные вещества утилизируются) или деструктивной (извлеченные вещества уничтожаются или меняют свое состояние и свойства). В зависимости от этого различаются и способы регенерации адсорбентов. Метод ионного обмена широко используется в водоподготовке. С помощью ионитов можно изменить ионный состав раствора, осуществлять полную его деминерализацию. Иониты - это высокомолекулярные органические вещества трехмерной структуры, практически нерастворимые в воде и органических растворителях и обратимо обменивающие ионы, входящие в их состав, на эквивалентное количество других ионов из раствора одинакового заряда. Структуры элементарного звена типичных ионитов приведены ниже (рис. 23). Многообразие свойств этих полимеров, их благоприятные эксплуатационные характеристики обеспечивают успешное применение различных сорбентов для широкого диапазона научных и практических задач - от аналитических разделений и препаративных синтезов органических веществ до извлечения металлов из руд и очистки природных и сточных вод. Ионный обмен эффективно может дополнять, а иногда и заменять такие процессы, как дистилляция, адсорбция, фильтрация и др. Ионный обмен является одним из широко используемых и перспективных физико-химических рекуперационных методов. Способность к ионному обмену определяется строением ионита, основу которого составляет высокомолекулярный каркас или так называемая матрица, связанная валентными силами или силами решетки. Матрица несет на себе положительный (аниониты) или отрицательный (катиониты) заряд, который компенсируется противоположным зарядом противоионов, находящихся в фазе ионита. Заряд матрице придают фиксированные (неподвижные) ионы, вводимые при синтезе. Противоионы же подвижны в каркасе ионита и в силу этого могут заменяться другими ионами из раствора. Реакции ионного обмена характеризуются стехиометричностью и обратимостью: Существуют и другие типы ионитов, например, амфолиты, способные одновременно и к анионному, и к катионному обмену. Если ионит, например, содержащий только противоионы А (рис. 24), поместить в раствор, содержащий ионы того же знака, но другого вида (В), то ионы А могут замещаться ионами В из раствора. Через некоторое время установится подвижное ионообменное равновесие. 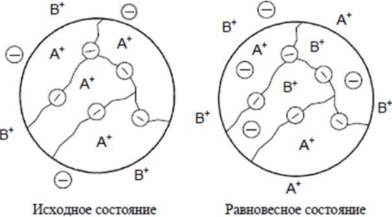 Рис. 24. Схема обмена ионов между ионитом и раствором Обмен ионов в гетерогенной системе ионит-раствор включает несколько разделяемых во времени и пространстве последовательных стадий: а) перенос вытесняющего иона из внешнего раствора к поверхности зерна ионита; б) преодоление этим ионом межфазной границы раствор-ионит; в) диффузия иона в фазе ионита от поверхности к функциональной группе; г) собственно акт обмена ионов - акт химического взаимодействия; д) обратный процесс по тем же стадиям для вытесненного иона. В настоящее время известно достаточно много примеров использования катионитов для извлечения металлов из сточных вод. Зачастую целесообразность таких способов обусловливается не только решением экологических проблем, но и достаточно быстрой окупаемостью затрат на внедрение вследствие ценности продуктов. Одно из достоинств ионообменного метода состоит в том, что самые разнообразные ионообменные операции могут быть выполнены при помощи типовой, относительно несложной аппаратуры. Основными аппаратами для работы с ионитами являются напорные ионито- вые фильтры. Иногда используются и безнапорные ионитовые фильтры, представляющие собой открытые железобетонные емкости. Экстракционный метод используется для очистки сточных вод от вредных и токсичных веществ органической природы (например, фенолы, масла, органические кислоты) или для селективного извлечения ценных неорганических примесей (например, металлов) из технологических растворов и жидких отходов. Экстракция основана на распределении извлекаемого компонента в смеси двух взаимно нерастворимых жидкостей в соответствии с его растворимостью в них. После распределения устанавливается равновесие. Экстракционный метод целесообразен, когда стоимость извлеченного компонента превышает затраты на экстрагирование, или если все другие методы неприменимы. То есть, рентабельность экстракции в сравнении, например, с конкурирующим методом ионного обмена, будет определяться различными технологическими соображениями, стоимостью и доступностью экстрагента, величиной его потерь и ценностью выделенных веществ. Часто в процессах экстракции в качестве экстрагентов используют различные технические продукты (антраценовое масло, сырой бензол). Это значительно снижает общую стоимость экстрагирования. Иногда удается подобрать в качестве растворителя смесь двух более дешевых экстрагентов, получая при этом высокий коэффициент распределения (так называемый синергетический эффект). Если в сточной воде содержатся несколько примесей, то лучше извлекать экстракцией сначала один из компонентов, а затем - другой. Экстрагенты для разных компонентов могут быть различными. Жидкостная экстракция достаточно эффективно используется для извлечения металлов из сточных вод в процессе производства редкоземельных элементов, ряда редких, цветных и благородных металлов в технологии ядерного горючего. Этот процесс проводят путем катионо- или анионообменной, а также координационной экстракции. Извлекаемые металлы переходят из водной в органическую фазу, а затем в результате реэкстракции - из органической фазы в водный раствор. При этом достигаются очистка сточных вод и концентрирование металла для его последующей рекуперации. В качестве экстрагентов обычно используются различные органические кислоты, эфиры, спирты, кетоны, амины, соли четвертичного аммониевого основания и другие. Реэкстрагентами чаще являются растворы кислот и оснований. Технология экстракционной очистки включает три основных процесса, от простоты и экономичности которых зависит целесообразность метода: - смешение сточной воды с экстрагентом в условиях максимального развития поверхности соприкосновения; - возможно более быстрое разделение жидкостей после экстракции; - удаление и регенерация экстрагента из водной и органической фаз. К преимуществам процессов экстракции можно отнести очень высокую кинетику процесса, возможность применения при больших исходных концентрациях извлекаемого компонента. Ограничивает же использование этого метода достаточно высокая стоимость органических экстрагентов, возможность загрязнения ими уже очищенных сточных вод и неэффективность при малых концентрациях вещества. Реагентный метод очистки СВ заключается в переводе загрязняющих веществ в малорастворимые или безопасные соединения. Нейтрализация - одна из разновидностей данного метода очистки стоков. Обычно нейтрализации подвергают промышленные СВ, содержащие кислоты. Нейтрализующими веществами при обработке сточных вод в данном случае могут быть аммиак, известь и прочие щелочные реагенты. Относительная технологическая простота обработки СВ обусловила наибольшее распространение модификаций реагентного метода в практике гальванического производства по сравнению с другими методами. К этой же группе методов можно отнести окислительные и термоокисл ител ьн ые методы. Особенно затруднительна очистка стоков с большим спектром и высокой концентрацией органических и минеральных веществ. В таких случаях применяют термоокислительные методы, суть которых заключается в окислении при повышенной температуре органических веществ до нетоксичных газообразных соединений. Сжигание же вод с минерализованными примесями может приводить к образованию твердого остатка или жидкого расплава. Эти методы подразделяются на парофазное окисление (или огневой метод), жидкофазное окисление (метод Циммермана) и парофазное каталитическое окисление. СВ, поступающие на сжигание, тоже подразделяют: по физическим свойствам жидкости или по ее теплотворной способности. То есть они могут быть загрязнены только органическими веществами, летучими или нелетучими, или загрязнены и неорганическими, и органическими компонентами. Также при сжигании стоков может быть необходимо дополнительное топливо или они в исходном состоянии обладают высокой теплотворной способностью не менее 8,4 МДж/кг. Окончательный выбор метода обусловливается следующими факторами: количество и состав сточных вод, их исходная теплотворная способность, наличие у предприятия энергоресурсов и катализаторов, возможность и целесообразность использования очищенных стоков, экономичность процесса. Огневой метод является наиболее универсальным, надежным и эффективным из всех термоокислительных методов. Суть его заключается в следующем. СВ в распыленном состоянии вводятся в высокотемпературную зону горения органического топлива. При этом вода полностью испаряется, токсические органические вещества, подвергаясь термическому окислению кислородом печной атмосферы, образуют нетоксичные продукты полного сгорания. Минеральные же примеси переходят в твердые или расплавленные частицы, которые улавливаются в пределах рабочей камеры, выводятся из нее в виде расплава или уносятся с дымовыми газами. Метод жидкофазного окисления основан на окислении кислородом воздуха органических примесей стоков при повышенной температуре (до 350°С) и давлении (2...28 МПа), которое обеспечивает нахождение воды в жидком состоянии. При высоких давлениях существенно возрастает растворимость кислорода в воде, а это способствует ускорению процесса окисления. Метод парофазного каталитического окисления заключается в каталитическом окислении органических примесей сточных вод при повышенной температуре в парогазовой фазе. В соответствии со схемой СВ направляют в выпарной аппарат, после которого водяной пар поступает в теплообменник для нагревания. Затем пары смешивают с горячим воздухом и направляют в контактный аппарат с катализатором, где происходит окисление органических веществ. Обезвреженная газовая смесь конденсируется и направляется обратно в производство. Пульпа из выпарного аппарата после обезвоживания направляется на сжигание. Для этих установок характерна достаточно высокая производительность по стокам и высокая степень их обезвреживания. Мембранные процессы разделения (рис. 25) основаны на преимущественной проницаемости одного или нескольких компонентов жидкой, газовой смеси или коллоидной системы через разделительную перегородку - мембрану. Компоненты жидкой фазы, прошедшие через перегородку, называют пермеатом, или фильтратом, а задержанные - концентратом. Движущей силой мембранных процессов является разность химических или электрохимических потенциалов по обе стороны перегородки. 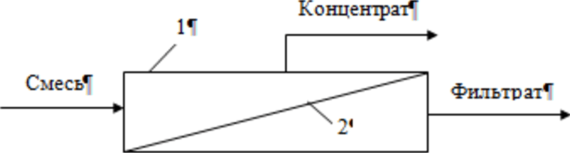 Мембрана - это материал или устройство, который ведет себя как некий физико-химический барьер между двумя жидкими фазами и допускающий определенные обменные или диффузные процессы. Мембранные процессы могут быть обусловлены градиентами давления (баромембранные процессы - микро-, ультра- и нанофильтрация и обратный осмос), электрического потенциала (электромемб- ранные процессы, например, электродиализ), концентрации (диффузионно-мембранные). Основное свойство, которое обусловливает практическое использование мембран - это не сама пропускная или обменная способность, а селективная проницаемость, то есть способность пропускать только определенные компоненты раствора и препятствовать переносу Других. Основные требования, предъявляемые к мембранам при их выборе: - высокая проницаемость и селективность; - устойчивость к действию рабочих растворов; - механическая прочность и низкая стоимость; - постоянство характеристик в процессе работы. Таким образом, принцип баромембранных методов состоит в непрерывном процессе разделения растворов путем их фильтрования под давлением, превышающим осмотическое, через полупроницаемую мембрану, которая полностью или частично задерживает молекулы или ионы растворенного вещества. Осмосом называют процесс самопроизвольного проникновения молекул растворителя через полупроницаемую мембрану. При давлении выше осмотического будет осуществляться перенос растворителя в обратном обычному осмосу направлении - от раствора к чистому растворителю (рис. 26). То есть мембраны пропускают молекулы растворителя, задерживая растворенное вещество. Поэтому такой процесс называют обратным осмосом, а применяемое давление - обратноосмотическим. При обратном осмосе отделяются частицы, размеры которых не превышают размеры молекул растворителя. При ультрафильтрации же размер отдельных частиц на порядок больше. Процесс мембранного разделения зависит от гидродинамических условий и конструкции аппарата, давления, температуры, концентрации и кислотности раствора. С ростом давления обычно повышается производительность, так как растет движущая сила процесса. Но при этом происходит уплотнение материала мембран и снижается ее проницаемость. Мембранная технология получает все большее распространение как в промышленном, так и в бытовом использовании. Это связано с общими преимуществами методов: - стабильно высокое качество очищенной воды; - мембрана, в отличие от других водоочистных систем, не накапливает внутри себя примеси, что исключает вероятность их попадания в очищенную воду; - достаточно низкие эксплуатационные затраты; - экологическая безопасность - отсутствие химических сбросов и реагентов; - компактность установок и минимальное внимание со стороны персонала. Методы электрообработки жидкости достаточно разнообразны. Для очистки сточных вод от различных растворимых и диспергированных примесей применяют процессы анодного окисления и катодного восстановления, электрокоагуляции, электрофлотации и электро диализа. Все они основаны на том, что твердые частицы или капельки дисперсной фазы ведут себя как заряженные микрообъекты, поэтому по законам электростатики в постоянном электрическом поле они будут совершать движение, которым можно управлять. Таким образом, можно концентрировать частицы у электрода, вызывать их укрупнение, ускорять седиментацию частиц, отделять их от жидкости и т.д. Электроочистные сооружения достаточно компактны и эффективны, хорошо поддаются автоматизации и могут компоноваться с другими методами и оборудованием. Основными общими областями применения электрохимических методов являются: улучшение качества воды, ее обеззараживание, очистка сбросных вод и обезвоживание осадков. В настоящее время существуют три основных укрупненных направления использования электрохимических методов: - удаление растворенных примесей в результате их анодного окисления и катодного восстановления с образованием нетоксичных или нерастворимых в воде продуктов, выпадающих в осадок; - удаление растворенных примесей с одновременной утилизацией ценных продуктов методами электро диализа с активными мембранами (в основном для неорганических веществ); - удаление растворенных неорганических и органических примесей путем электролиза сточных вод с использованием растворимых анодов и получением нерастворимых продуктов. Из электрохимических методов очистки сточных вод (особенно - стоков гальванического производства) наибольшее распространение получил электрокоагуляционный метод,, применяемый для очистки сточных вод от взвешенных частиц и коллоидно-дисперсных систем, ионов цветных металлов и особенно - хрома. При электролизе сточных вод с использованием анодов из листовой стали или алюминия вода обогащается соответствующими ионами, которые затем образуют гидроксиды этих металлов. Под их действием происходит процесс коагуляции содержащихся в воде высокодисперсных веществ, аналогичный процессу обработки воды соответствующими солями алюминия и железа. Однако, в отличие от применения солевых коагулянтов, при электрокоагуляции вода не обогащается сульфат- и хлорид-ионами, содержание которых в очищенной воде регламентируется. При электрокоагуляции протекают следующие процессы: - электрофорез; - катодное восстановление растворенных органических и неорганических примесей с образованием катодных осадков; - химические реакции между ионами алюминия и железа и другими растворенными ионами (например, S2', Р043') с образованием малорастворимых соединений; - флотация твердых и эмульгированных частиц пузырьками водорода, образующимися на катоде; - сорбция ионов и молекулярно растворенных и эмульгированных веществ на поверхности хлопьев гидроксидов алюминия или железа, которые обладают высокой адсорбционной активностью в момент их образования. Сдерживающим фактором применения электрокоагуляции является повышенный расход электроэнергии и листового железа и алюминия. Поэтому необходимость использования данного метода в каждом конкретном случае должна быть экономически обоснована. Электродиализ - это процесс непрерывной сепарации ионов солей, осуществляемый в многокамерном мембранном аппарате (электродиализаторе) под действием постоянного тока, направленного перпендикулярно плоскости мембран. Простейший электродиализатор (рис. 27) представляет из себя аппарат, разделенный мембранами на три камеры. 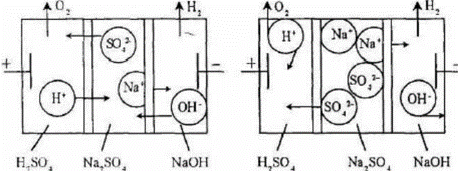 Рис. 27. Схема электродиализаторов В среднюю камеру, называемую солевой, запускают рабочий раствор, а в приэлектродных пространствах находятся водные камеры. При прохождении электрического тока ионы начинают направленное движение к соответствующим электродам. |
