реферат. МЕХАНИЗМ ТЕРМИЧЕСКИХ ПРЕВРАЩЕНИЙ УГЛЕВОДОРОДОВ. Механизм термических превращений углеводородов
 Скачать 2.11 Mb. Скачать 2.11 Mb.
|
|
МЕХАНИЗМ ТЕРМИЧЕСКИХ ПРЕВРАЩЕНИЙ УГЛЕВОДОРОДОВ Термические превращения нефтяных фракций — весьма сложный химический процесс. Сырье состоит из большого числа индивидуальных компонентов. Совершенно очевидно, что предсказать или проследить судьбу каждого компонента сырья при воздействии высоких температур невозможно. Поэтому на практике о результатах того или иного высокотемпературного процесса судят обычно по выходам целевых продуктов: газа, бензина, кокса, а также по групповому или, в лучшем случае, компонентному составу бензинов. Однако многочисленные исследования термических превращений отдельных углеводородов позволяют делать  выводы о характерных для данного класса углеводородов типах реакций. выводы о характерных для данного класса углеводородов типах реакций.Распад алканов. Термодинамические расчеты показывают, что углеводороды этого ряда, начинай с пентана, при повышенных температурах склонны лишь к реакции распада по связи С—С, с образованием алкена и алкана: СnH2n+2 → CmH2m + CqH2q+2 Полученные предельные осколки вновь распадаются на алкен и алкан. Низкомолекулярные углеводороды—этан, пропан и бутаны — могут также дегидрироваться: СnH2n+2 → CnH2n + H2 В результате в газах накапливается водород. Распад алканов может происходить по всем связям С—С. Место разрыва, а следовательно, преимущественное образование тех или иных продуктов реакции зависят от температуры и давления. Чем выше температура и ниже давление, тем место разрыва углеродной цени все больше смещается к ее концу и значительно возрастает выход газообразных продуктов. При температуре около 450°С разрыв происходит посередине цепи. Повышение давления также сдвигает место разрыва к центру молекулы. Полому крекинг под давлением позволяет получать больше целевых жидких продуктов. В ряду алканов метан является наиболее термически устойчивым, так как в нем отсутствуют связи С—С. Разложение метана на углерод и водород возможно при очень высоких температурах (примерно 1500°С). Распад этана, пропана и бутанов изучали многие исследователи. Для этана характерна реакции дегидрирования: Пропан примерно в равной степени реагирует по двум направлениям Бутан при 500—600 °С распадается по всем связям С—С и в незначительной степени дегидрируется: 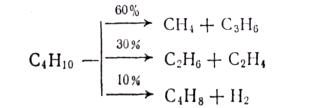 Изобутан, наоборот, при этих температурах в основном дегидрируется Для углеводородов с числом углеродных атомов более четырех при обычных температурах крекинга распад происходит в центре углеродной цепи. Написанные выше схемы химических реакций распада алканов не раскрывают еще всей сложности механизма процесса образования водорода, предельных и непредельных осколков. Большинство ученых считает, что распад алканов имеет цепной характер и подчиняется теории свободных радикалов, выдвинутой Ф. О. Рай-сом и С. К. Райсом. Кратко эта теория сводится к следующему. 1.Так как энергия диссоциации связи С—С меньше, чем связи С—Н, то первичный распад под воздействием повышенной температуры происходит по связи С—С. В результате образуются радикалы различном молекулярной массы, например: СН3(СН2)5СН3 → С4Н9. + С3Н7. Доказано, что при температуре около 600 °С и при атмо сферном или пониженном давлении радикалы метил (СН3*) и этил(С2Н5*) способны к кратковременному самостоятельному существованию. При повышенных давлениях этой способностью обладают радикалы и большей молекулярной массы. Ненасыщенные вещества со свободной валентной связью, не распадающиеся мгновенно на более устойчивые соединения, называются свободны ми радикалами. К ним относится также и водородный радикал Н». Радикалы более высокой молекулярной массы, не обладающие в данных условиях хотя бы минимальной стабильностью, мгновенно снова распадаются с образованием устойчивого этиле нового углеводорода и нового радикала, в том числе и водородного атома, например: 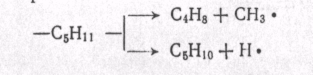 При этом, как видно, концентрация свободных радикалов в реакционной смеси повышается. Свободные радикалы, сталкиваясь с молекулами исходного сырья, порождают цепную реакцию образования новых радикалов: 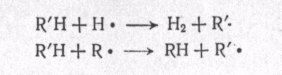 Единственным результатом соударения свободного радикала с молекулой сырья будет отрыв водорода от предельного углеводорода. С разной степенью вероятности этот отрыв будет происходить от третичных, вторичных и первичных атомов углерода, порождая радикалы различного строения, например при пиролизе пропана: 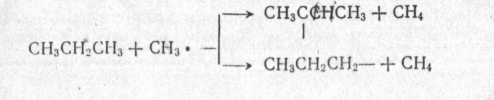 При 600 °С вероятность реакции свободных радикалов с водородом по месту вторичных и первичных атомов углерода находится в соотношении 1:2. Время жизни свободных радикалов очень мало, порядка 103 ÷ 104 с, так как за это время они успевают встретиться с неразложенными молекулами сырья. Энергия активации этого типа реакций 40—80 кДж/моль, т. е. значительно ниже, чем для прямого распада алкана. Свободные радикалы при развитии цепной реакции вновь и вновь возникают, и, таким образом, очень большая часть исходных молекул алкана вовлекается в реакцию. Следовательно, основная масса продуктов реакции получается в результате развития именно цепной реакции через свободные радикалы, а не в результате прямого разрыва углеродной цепи. Эта реакция служит только началом длинного ряда превращений, как бы первичным толчком. 5. При достижении равновесия вероятность встречи свободных радикалов друг с другом становится не меньшей, чем вероятность их соударения с молекулами исходного сырья. Это приводит к обрыву цепи, так как при взаимодействии двух свободных радикалов образуются стабильные низкомолекулярные алканы или молекула водорода: 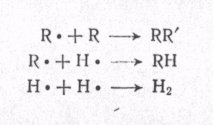 В конечном итоге в продуктах реакции накапливаются устойчивые при данной температуре предельные и непредельные углеводороды, а также молекулярный водород. Термические превращения непредельных углеводородов. В сырье для крекинга ненасыщенные углеводороды отсутствуют, но роль их в химии крекинга очень велика, так как они всегда образуются при распаде углеводородов других классов. Для непредельных углеводородов характерно большое разнообразие химических превращений. На примере олефинов особенно легко проследить решающее влияние температуры на направление превращения. Низкие температуры и высокие давления стимулируют реакции уплотнения низкомолекулярных олефинов nCnН2n → (Сn Н2n)n Чем выше давление, тем глубже идет полимеризация. Однако при повышении температуры термодинамическая вероятность полимеризации резко падает и равновесие смещается в обратную сторону. Чем больше время пребывания сырья в зоне высоких температур, тем глубже идет распад продуктов уплотнения. В обычных условиях крекинга (около 500 °С, давление до 7 МПа) олефины, образовавшиеся при распаде предельных компонентов сырья или в результате уплотнения в начальный период крекинга низкомолекулярных алкеиов, в основном претерпевают распад. Разложение олефинов может протекать в различных направлениях:  Анализ энергетических особенностей молекулы олефина показывает, что наименьшей энергией диссоциации обладает связь С—С, находящаяся в β-положении по отношению к двойной связи: 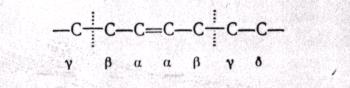 Это так называемое правило β-связи определяет наиболее вероятное место распада в углеродной цепи. Заметим тут же, что в различных реакциях отрыв водорода от атома углерода также идет легче от β-углерода. Термическая устойчивость высших олефинов близка к устойчивости алканов. Механизм распада алкенов, так же как и алканов, имеет цепной характер. Первичный распад по β-связи дает начало двум радикалам. Так, для пентана: Далее 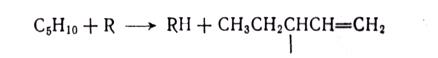 Радикал С5Н9 весьма неустойчив и сразу распадается на бутадиен и радикал метил: 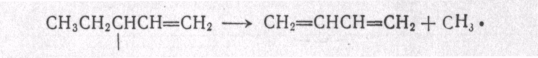 Дальнейшее развитие цепной реакции идет через радикал метил. Этот механизм хорошо объясняет получение из пентана бутадиена и метана: 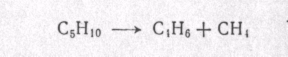 При более высоких температурах (600—700 °С) аналогичные реакции осуществляются и для низших олефинов С2—С4. Так, из этилена получается бутадиен и водород. Эта реакция характерна для пиролиза: 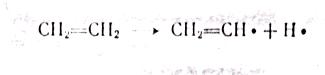 Связь С = С прочнее связи С—Н, поэтому первичный распад приводит к образованию радикала винила и водородного атома. Свободные радикалы реагируют с этиленом: 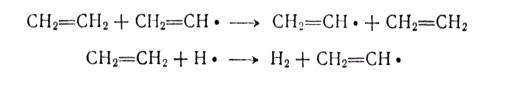 Обе реакции снова приводят к образованию винила, и естественно, что реакция заканчивается в результате их соударения: Суммарно реакция выражается уравнением: 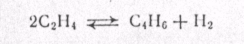 Условия пиролиза (температура до 700°С и низкое давление) способствуют также протеканию реакций дегидрирования алкенов: Итак, в продуктах пиролиза накапливаются диолефины Эти углеводороды весьма склонны при температурах около 700°С к уплотнению путем полимеризации (1) и конденсации с алкенами (2) с образованием циклических углеводородов: 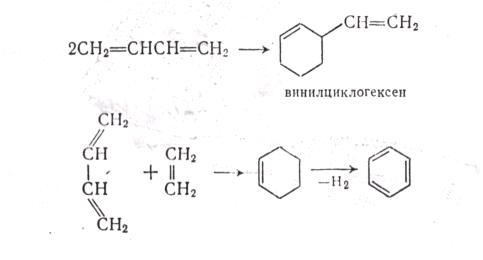 Получающиеся при конденсации циклоолефины легко дегидрируются до ароматических углеводородов. Этот так называемый диеновый синтез является одним из главных путей образования ароматических углеводородов при пиролизе. Крекинг нафтенов. Для нафтеновых углеводородов наиболее характерны следующие типы превращения при высоких температурах: 1) деалкилированис или укорочение боковых парафиновых цепей; 2) дегидрирование кольца с образованием циклоолефинов и ароматических углеводородов; I) частичная или полная дециклизация полициклических нафтенов в после деалкилирования; 4) распад моноциклических нафтенов на олефины или парафин — диолефин. Деалкилирование — реакция, аналогичная распаду алканов. Термическая устойчивость боковых парафиновых цепей значительно ниже устойчивости кольца. Поэтому расщепление цепей является преимущественным направлением первичного распада ал-.. кил нафтенов. При температуре около 500 °С расщепление происходит главным образом посередине цепи. Деалкилирование — типичный пример последовательного типа реакций. По мере увеличения продолжительности нагрева боковые цепи становятся короче. Труднее всего отщепляется метильная и этильная группы. Полное деалкилирование возможно лишь при более высоких температурах. Повышение давлении препятствует деалкилированию. Укороченная боковая цепь, так же как и отщепленный осколок, могут быть либо насыщенными, либо ненасыщенными. При исчерпывающем деалкилировании циклический радикал насыщается водородом, всегда присутствующим в продуктах распада. Дегидрирование — более высокотемпературная реакция, ведущая к накоплению в продуктах крекинга и пиролиза циклоолефинов и ароматических углеводородов. Реакции благоприятствует пониженное давление: 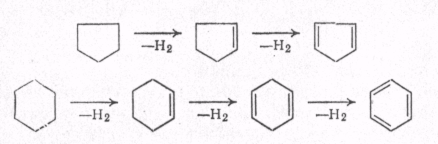 Бициклические нафтены при этой реакции могут дать начало углеводородам рядов тетралина и нафталина. При пиролизе дегидрирование шестичленных нафтенов наряду с диеновым синтезом является наиболее вероятным путем глубокой ароматизации сырья. 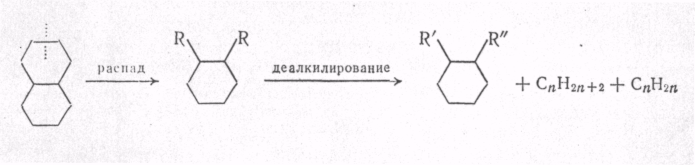 Дециклизация полициклических нафтенов приводит к последовательному упрощению молекул и сопровождается деалкилироранием. Схематично эти превращения можно представить в следующем виде: I Одновременно (особенно при высоких температурах) протекают реакции дегидрирования. Циклопентан, циклогексан и их ближайшие гомологи при 500 – 600 оС распадаются на два непредельных осколка: 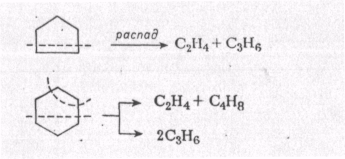 Распад не имеет цепного характера. Термодинамически и кинетически реакции распада конкурирует с реакцией дегидрирования. Поэтому в продуктах крекинга можно обнаружить в сравнимых количествах и непредельные, и ароматические углеводороды. При 700—800°С циклогексан распадается иначе, с образованием бутадиена С6Н12 → С2Нб + С4Н6 Крекинг ароматических углеводородов. Ароматические углеводороды наиболее термически устойчивы. Поэтому они накапливаются в жидких продуктах крекинга тем в больших количествах, чем выше температура процесса. При пиролизе ароматические углеводороды являются главной составной частью так называемой смолы пиролиза. Ароматические углеводороды с длинными боковыми цепями способны деалкилироваться. Преимущественное место отрыва боковой цепи находится между первым и вторым атомами углерода в цепи, т. е. в β-положении от углерода кольца. Поэтому при деалкилировании получаются главным образом монометилированные ароматические углеводороды. Голоядерные углеводороды любой степени цикличности (бензол, нафталин, антрацен и др.), так же как и алкилированные углеводороды с короткими боковыми цепями, практически не подвергаются распаду. Единственным направлением их превращений является конденсация с выделенном водорода. В результате происходит накопление полициклических углеводородов. В результате конденсации бензола, нафталина и других голоядерных углеводородов образуются дифенил, динафтил и им подобные углеводороды: 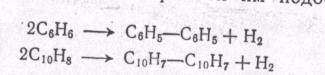 Эти реакции, согласно воззрениям Тиличеева, также легко объясняются радикально-цепным механизмом. Образующийся радикал водорода Н» порождает ароматические радикалы которые в дальнейшем рекомбинируют, что и приводит к образованию конденсированных молекул. Развитие реакций конденсации разнообразных циклических углеводородов приводит в конечном итоге к образованию карбондов (кокса). Постепенное увеличение молекулярной массы, повышение содержания углерода и потерю водорода в результате конденсации ароматических структур можно изобразить следующими схемами: 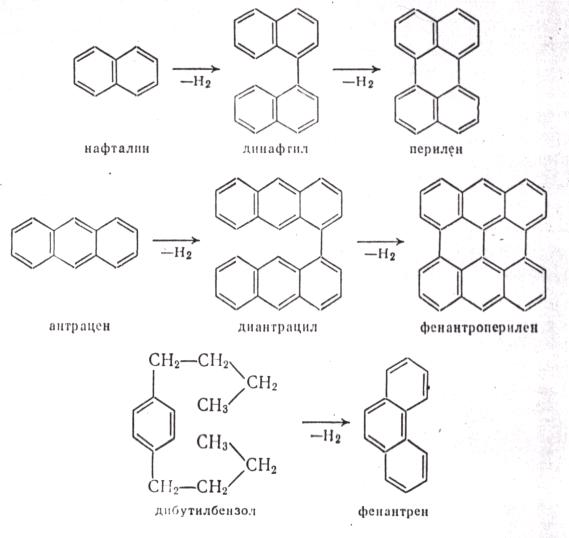 Эти и аналогичные им реакции по мере углубления и приводят к образованию твердых карбоидов, содержащих минимальное количество водорода. Итак, мы видим, что нефтяной кокс не является модификацией углерода, получающейся при распаде углеводородов на элементы, а имеет углеводородное строение. Если и целью процесса не является получение нефтяного кокса, то коксообразование весьма нежелательно. Что касается сернистых соединений, присутствующих в сырье для крекинга и пиролиза, то они либо разлагаются с выделением сероводорода, меркаптанов и углеводородных осколков (см. § 7), либо, благодаря своей термической устойчивости (тиофены и им подобные), накапливаются в более высокомолекулярных продуктах. Подводя итог рассмотрению химических превращений углеводородов различного строения при температурах крекинга и пиролиза, можно сделать вывод, что при деструктивной переработке нефтяного сырья должны осуществляться следующие основные реакции: распад, деалкилирование, дегидрирование, полимеризация, циклизация непредельных, дециклизация нафтенов, деструктивная конденсация олефинов, конденсация моноолефинов в диолефины, конденсации ароматических углеводородов, реакции глубокого уплотнения до кокса. От глубины этих реакций и преобладании того или иного типa превращений углеводородов сырья и зависят выходы газа, бензина, промежуточных фракций, крекинг-остатка и кокса, а также качество и химический состав целевых продуктов. В свою очередь, степень превращения сырья и развитие перечисленных химических процессов зависят и от природы сырья и от параметров процесса. Крекинг углеводородов различных рядов Химические реакции крекинг-процесса обусловлены прежде всего реакциями разложения исходного сырья. Наряду с реакциями разложения при крекинге имеют место реакции уплотнения, в результате которых образуются более сложные и тяжелые соединения, чем исходное сырье. Эти вещества являются продуктами вторичного происхождения. Вместе с распадом и уплотнением возможны различные внутримолекулярные перегруппировки, вызывающие изменение структуры исходной молекулы. Реакции разложения являются основными реакциями, протекающими при крекинге парафиновых углеводородов. Распад парафиновых углеводородов может происходить по различным схемам. Ниже приводятся реакции распада бутана: При крекинге более сложных парафиновых углеводородов число возможных направлений реакций будет значительно возрастать. При умеренных температурах крекинга (ниже 500° С) распад тяжелых парафиновых углеводородов происходит преимущественно в середине цепи. Реакция распада н-додекана в этом случае протекает преимущественно с образованием гексилена и гексана по схеме Образование газов крекинга (в обычных условиях) указывает на то, что вновь образовавшиеся парафиновые углеводороды продолжают распадаться. Реакция распада происходит по схеме    При крекинге парафиновых углеводородов нормального строения в одинаковых условиях образуются продукты разложения различных видов в зависимости от молекулярного веса (длины цепи) углеводорода. При 425° С и времени реакции 1 ч декан Если к тому же принять во внимание сложность химического состава технического сырья, то становится понятным разнообразие схем химических реакций, протекающих при крекинге, и сложность состава продуктов реакции. Реакции уплотнения являются вторичными реакциями. Образование продуктов уплотнения, при прочих равных условиях, в значительной степени зависит от химического состава крекируемого материала. Так, при крекинге парафинистого сырья с малым содержанием ароматических углеводородов и смол кокса образуется значительно меньше. Парафиновые углеводороды в условиях крекинга менее склонны к реакциям уплотнения. Эти процессы происходят при наличии углеводородов ароматического и олефинового ряда. В условиях низкотемпературного крекинга (425°С) олефиновые углеводороды, соединяясь между собой, образуют полимеры непредельного характера, а с ароматическими углеводородами - продукты конденсации. Повышение температуры крекинга резко изменяет ход реакции. Место разрыва смещается ближе к концу цепи, газообразование усиливается, и в результате образуются преимущественно низшие парафины и высокомолекулярные олефиновые углеводороды. Одновременно увеличивается выход продуктов уплотнения. На установках термического крекинга перерабатываются не только дистилляты и остатки атмосферно-вакуумной перегонки, но также и продукты вторичного происхождения: дистилляты коксования, флегма легкого термического крекинга мазута прямой гонки и др. Эти продукты содержат большое количество непредельных углеводородов. Совместно с другими углеводородами они подвергаются термическому крекингу. При термическом крекинге олефиновые углеводороды вступают в различные химические реакции: полимеризуются, разлагаются, соединяются с ароматическими углеводородами и т. д. По сравнению с парафиновыми углеводородами у олефинов преобладают реакции полимеризации и конденсации. Выходы продуктов разложения, как для олефинов, так и для парафинов с одинаковым числом атомов практически равны; продуктов конденсации олефинов получается значительно больше. Стойкость олефинов при нагревании, как и парафиновых углеводородов, снижается по мере увеличения молекулярного веса. Общее количество продуктов реакции, при крекинге в одинаковых условиях у олефиновых углеводородов больше, чем у парафиновых. При высоких температурах и низких давлениях реакции полимеризации олефинов имеют второстепенное значение. Нафтеновые углеводороды нефти принадлежат к рядам циклопентана и циклогексана. В сырье для крекинга содержатся преимущественно алкилированные нафтены с одной или более парафиновыми боковыми цепями, а также соответствующие конденсированные системы. Одной из наиболее важных реакций термического крекинга нафтеновых углеводородов является реакция расщепления боковых цепей нафтенов. Нафтены с длинными боковыми цепями так же термически неустойчивы, как и соответствующие им парафины. При температурах глубокого термического крекинга боковые цепи распадаются преимущественно в середине с образованием низкомолекулярного парафина и нафтена с олефиновой боковой цепью или олефина и нафтена с парафиновой боковой цепью. Например: 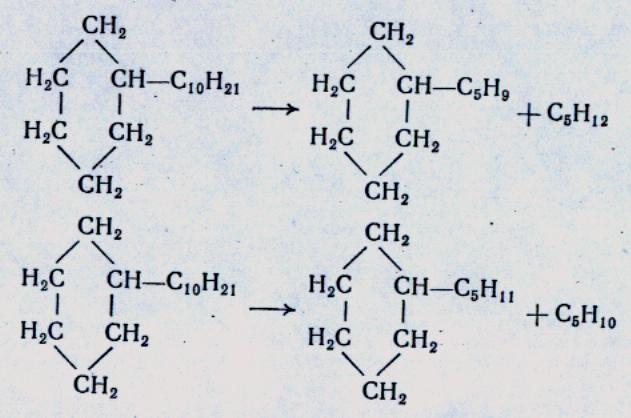 Поскольку разложение боковых цепей происходит в несколько стадий, длинные боковые цепи укорачиваются, и когда в боковой цепи остается метильная или этильная группа, в результате повышения термической стабильности молекул дальнейшее разложение приостанавливается. Наличие высокомолекулярных нафтеновых углеводородов в сырье обусловливает его высокую вязкость. Разложение их снижает вязкость продуктов крекинга. Циклогексан термически более. устойчив, чем н-гексан, но менее устойчив, чем бензол. При температуре 575-650°С протекают реакции разрыва кольца или дегидрирование его до ароматических углеводородов: 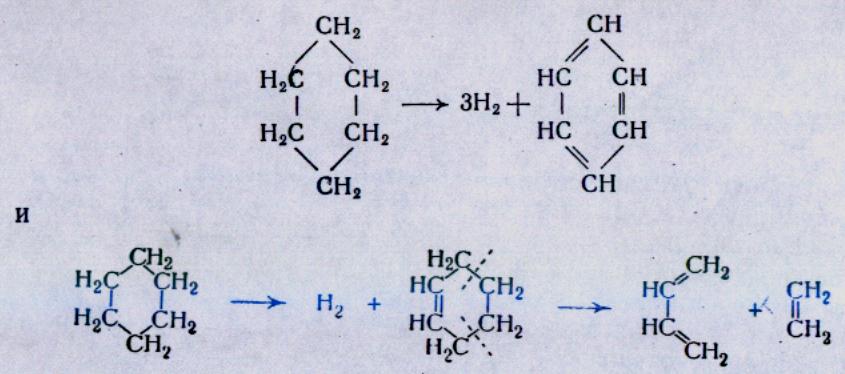 Крекинг в паровой фазе лигроиновых фракций нефтей нафтенового основания при температуре 560°С и давлении 40-50ат. способствует увеличению содержания ароматических углеводородов в крекинг –бензине. Наиболее термически устойчивыми являются ароматические углеводороды. Особенно устойчивы к реакциям крекинга нафталин, бензол и алкилбензолы с короткими боковыми цепями. Реакция разложения бензола при 600°С протекает крайне медленно, а нафталин начинает заметно разлагаться только при температуре 750° С. Основными реакциями при обычных условиях крекинга нефтяного сырья являются реакции распада боковых цепей алкилароматических соединений. Чем длиннее цепь, тем легче она распадается. Характер реакций распада боковых цепей такой же, как и у нафтеновых углеводородов, т. е. при крекинге алкилароматических соединений образуются низкомолекулярный парафин или олефин и алкилароматические углеводороды с короткой боковой цепью. При этих реакциях повышается содержание низкомолекулярных ароматических углеводородов в крекинг-бензине и улучшаются его антидетонационные свойства. Другой вид реакции, сопровождающий процесс термического крекинга, это реакция конденсации ароматических углеводородов с непредельными углеводородами, при которых образуются высокомолекулярные соединения, дальнейшая конденсация которых приводит к образованию кокса. При крекинге сернистых соединений наблюдали, что наиболее термически стабильными соединениями серы являются меркаптаны и тиофены. Моносульфиды и дисульфиды при крекинге превращаются главным образом в элементарную серу, сероводород и меркаптаны. Меркаптаны при глубоком крекинге образуют олефин и сероводород. Например: Образование элементарной серы и сероводорода при крекинге сернистых соединений приводит к интенсивной коррозии аппаратуры, особенно при переработке нефтяного сырья с высоким содержанием серы. Смолы или нейтральные смолы представляют собой высшие полициклические соединения с короткими боковыми цепями, содержащие кислород и серу. Они в значительных количествах встречаются в высококипящих дистиллятах и остатках — мазутах, гудронах. При крекинге нейтральных смол и асфальтенов получаются газы, жидкие продукты и большое количество кокса. Выход кокса при крекинге асфальтенов достигает 60 вес.%, а при крекинге нейтральных смол—от 7 до 20 вес.% (в зависимости от молекулярного веса смол). Легкий крекинг (висбрекинг) При переработке нефтяных остатков – полугудронов и гудронов – целевым продуктом обычно является котельное топливо, получаемое в результате снижения вязкости исходного остатка. Такой процесс неглубокого разложения сырья называется легким крекингом или висбрекингом. Висбрекинг – это термический крекинг для бедных. Установка висбрекинга использует тяжелый остаток от процесса вакуумной перегонки, часть которого подвергается в ней термическому крекингу. Продукт можно снова разделить на фракции, что приводит к уменьшению объема остатка. После этого к остатку добавляют для разбавления некий дистиллятный нефтепродукт (разбавитель), тогда остаток (пек) висбрекинга становится пригодным к применению в качестве остаточного (котельного) топлива. Количество дистиллята, добавляемого для разбавления, меньше, чем количество продуктов крекинга, выходящих с установки – таким образом, в целом, объем остаточного топлива снижается. В качестве разбавителя можно брать тяжелый крекинг-газойль, рециркулирующий газойль или погон, полученный при разделении продуктов на этой же установке. Висбрекинг напоминает термический крекинг, но отличается от последнего по интенсивности. Оборудование в этом случае проще, и весь процесс дешевле. С другой стороны, только 20-30% тяжелого остатка вакуумной перегонки подвергается трансформации. Учитывая возможные источники остаточного топлива, уменьшение количества остатка может сводиться к вакуумной перегонке в сочетании с каталитическим крекингом, а не к термическому крекингу в сочетании с коксованием. Однако это будет именно уменьшение количества остатка, но не деструкция пека. |
