фармакогнозия. Методы анализа биологичеcки активных веществ и их свойства
 Скачать 137.5 Kb. Скачать 137.5 Kb.
|
|
МЕТОДЫ АНАЛИЗА БИОЛОГИЧЕCКИ АКТИВНЫХ ВЕЩЕСТВ И ИХ СВОЙСТВА. 1. Физические, химические и биологические свойства биологически активных веществ. 2. Качественный химический анализ биологически активных веществ. 3. Методы количественного определения биологически активных веществ. В Государственный Реестр лекарственных средств (2001 г.) включено около 300 наименований лекарственного растительного сырья и около 600 препаратов растительного происхождения. Поэтому оценка качества лекарственного растительного сырья, т.е. установление возможности применения его как лекарственного средства (лекарства), является одной из задач специалиста-провизора. Определяют подлинность и доброкачественность лекарственного растительного сырья, т.е. соответствие тем требованиям, которые предъявляет к сырью нормативный документ. Одним из важных показателей качества лекарственного растительного сырья является содержание основных биологически активных веществ (БАВ). Их определение проводится с помощью химических и физико-химических методов анализа, основанных на физических, химических и биологических свойствах БАВ. Физические, химические и биологические свойства БАВ. Физические свойства. По агрегатному состоянию эфирные масла, жирные масла и безкисло- родные алкалоиды представляют собой жидкости. Эфирные масла - летучие жидкости, представляющие собой смеси органических веществ различной природы, вырабатываемые растениями и обусловливающие их запах. Жирные масла - сложные нелетучие органические вещества растительного и животного происхождения, представляющие собой смеси различных глицеридов. По цвету эфирные и жирные масла - чаще всего бесцветные или желтоватые. Эфирные масла могут быть и окрашенными: например, красное - масло тимьяна, синее - от присутствия азуленов масло цветков ромашки и травы тысячелистника. Жирные масла при нагревании оставляют жирное пятно на бумаге, эфирные - испаряются без остатка. Запах масел, особенно эфирных, ароматный, характерный, плотность колеблется от 0,8 до 1,19, но большей частью меньше единицы. Безкислородные алкалоиды (анабазин, кониин, пахикарпин, никотин) бесцветные или окрашенные маслянистые жидкости с неприятным запахом. Все указанные жидкости не растворимы в воде, но хорошо растворяют в спиртах, жирах, неполярных органических растворителях (хлороформ, ди-этиловый и петролейный эфиры), обладают оптической активностью, масла способны к рефракции. При охлаждении, а иногда при комнатной температуре эфирные масла застывают в кристаллическую массу - стеароптен, оставшаяся жидкая часть на зывается элеоптеном. Эфирные масла и безкислородные алкалоиды способны перегоняться с водяным паром. К твердым кристаллическим или аморфным веществам относятся: горечи, полисахариды, сердечные гликозиды, сапонины, простые фенольные соединения, кумарины, хромоны, лигнаны, флавоноиды, антраценпроизводные, дубильные вещества, кислородсодержащие алкалоиды, водорастворимые витамины. Цвет. Бесцветные или слегка желтоватые - горечи (монотерпеноидные иридоиды), полисахариды, сердечные гликозиды, сапонины, простые фенольные соединения, кумарины, хромоны, лигнаны, флавоноиды группы флавана, аскорбиновая кислота, большинство кислородсодержащих алкалоидов. Флавоноиды, производные флавонов, витамин К - желтые; халконы, ауроны и каротиноиды - оранжевые; антоцианы - красного или синего цвета в зависимости от реакции среды (кислая или щелочная); антраценпроизводные - желтого, оранжевого или красного цвета; дубильные вещества - желтые или желто-бурые. Вкус. Большинство БАВ без запаха, горького вкуса: горечи, сердечные гликозиды, кумарины, хромоны, некоторые флавоноиды, антраценпроизводные, алкалоиды. Гомогликозиды без запаха и вкуса. Дубильные вещества вяжущего вкуса, аскорбиновая кислота - кислого. Растворимость. БАВ в растениях встречаются в виде гликозидов и агликонов: иридоиды, полисахариды, сердечные гликозиды, сапонины, простые фенольные соединения, кумарины, хромоны, лигнаны, флавоноиды, антраценпроизводные, дубильные вещества. Гликозиды растворимы в воде и водных растворах низших спиртов (метиловом и этиловом) и плохо растворимы в органических растворителях (бензоле, эфире хлороформе). Полисахариды не растворяются в спирте и неполярных органических растворителях. Растворимость полисахаридов в воде варьирует: некоторые линейные гомополисахариды не растворяются в воде, сложные и разветвленные полисахариды либо растворяются в воде, либо образую гели. Гидрофильные сердечные гликозиды хорошо растворяются в воде, плохо - в липидах, липофильные - легко растворяются в липидах, плохо - в воде. Агликоны нерастворимы в воде, но хорошо растворимы в неполярных органических растворителях (эфире, хлороформе), спиртах, ацетоне. Катехины и лейкоантоцианидины растворимы в воде, спиртах и ацетоне, плохо растворяются в других органических растворителях. Дубильные вещества хорошо растворяются в воде с образованием коллоидных растворов, растворимы также в этиловом и метиловом спирте, ацетоне, этилацетате, бутаноле, пиридине, не растворимы в хлороформе, бензоле, диэтиловом эфире и других неполярных растворителях. Алкалоиды в растениях встречаются в виде солей и виде оснований. Алкалоиды-соли хорошо растворимы в воде и этиловом спирте (особенно в разбавленном), плохо или совсем не растворимы в органических растворителях (хлороформ, этиловый эфир, дихлорэтан и др.). Исключения: хинина сульфат плохо растворяется в воде; скополамина гидробромид растворяется в хлороформе. Алкалоиды-основания обычно плохо растворяются в воде, но легко растворяются в органических растворителях. Исключения: цитизин, кофеин, кодеин хорошо растворяются и в воде и в органических растворителях. Все гликозиды и алкалоиды оптически активны. Возгоняются при высокой температуре: кумарины, антраценпроизводные, отдельные алкалоиды (кофеин, никотин). Флюоресцируют в УФ-свете: - сердечные гликозиды - оттенками желтого, зеленого и голубого цветов; - простые фенолы, кумарины - голубым, синим, фиолетовым, зеленым и желтым цветом; - большинство хромонов и лигнанов - желтым или желто-зеленым цветом; - флавоны, флавонол-3-гликозиды, флаваноны, халконы — коричневым цветом; - флавонолы и их 7-гликозиды - желтым или желто-зеленым цветом; - ксантоны - оранжевым цветом; - катехины - бесцветным и голубым цветом; - антраценпроизводные - розовым, красным, оранжевым, желтым цветом; - некоторые алкалоиды: цитизин - фиолетовым, берберин - желто-зеленым цветом; - витамин К - красным, но под действием УФ-лучей быстро разрушается, флуоресценция переходит в зеленую. Специфическим свойством сапонинов является их способность снижать поверхностное натяжение жидкостей (воды) и давать при встряхивании стойкую обильную пену. Такая поверхностная активность связана с наличием в молекулах сапонинов одновременно как гидрофильного, так и липофильного остатков. Химические свойства Химические свойства гликозидов многообразны и обусловлены наличием гликозидной связи и строением сахаров и агликона. Под действием ферментов при наличии воды гликозиды гидролизуются. Возможен гидролиз ферментативный, кислотный и щелочной. Оптимальной для ферментативного гидролиза является температура 30-50 °С, при температуре свыше 50°С ферменты денатурируют. Химические свойства сердечных гликозидовобусловлены наличием стероидного ядра, лактонного кольца, углеводной цепи и присутствием гликозидной связи. Самыми нестойкими в молекулах сердечных гликозидов являются лактонное кольцо и гликозидная связь. В случае, когда на конце углеводной цепи находятся глюкоза или рамноза, сердечные гликозиды легко обрывают конечную молекулу моносахарида и образуют вторичные гликозиды. Реакции на стероидную структуру основаны на способности стероидного ядра сердечных гликозидов и стероидных сапонинов подвергаться дегидратации под действием кислотных реагентов (уксусный ангидрид, конц. серная кислота, трихлоруксусная кислота) с образованием окрашенных комплексных соединений (реакция Либермана-Бурхарда). Реакции на ненасыщенное лактонное кольцо сердечных гликозидов основаны на способности ненасыщенного лактонного кольца легко окисляться полинитросоединениями (нитропруссид натрия, пикриновая кислота) в щелочной среде с образованием окрашенных в желтый или красный цвет продуктов реакции. Реакции на углеводную часть молекулы гликозида основаны на способности моносахаридов углеводной цепи образовывать окрашенные комплексы с различными реактивами. Моносахара, входящие в состав гликозида вступают во все цветные реакции, свойственные углеводам (с раствором Феллинга, серебряного зеркала). Фенольные гликозиды дают: - растворимые в воде феноляты с гидроксидом натрия: флавоноиды и кумарины - желтого; антрагаикозиды - вишнево-красного цвета; - окрашенные комплексные соли с хлоридом окисного железа или железоаммонийными квасцами от зеленой до фиолетовой окраски (простые фенолы, кумарины, лигнаны, флавоноиды, дубильные вещества); - с хлоридом алюминия - желтую окраску с желто-зеленой флюоресценцией (флавоноиды); - с ацетататом свинца и магния, солями меди, молибдена, циркония (все фенольные соединения); - реакцию азосочетания с солями диазония с образованием азокрасителя в зависимости от структуры от желтого до вишнево-красного цвета. Флавоноиды способны восстанавливаться (проба Синода), простые фенольные соединения – (гидрохинон) окисляться раствором йода. Дубильные вещества легко окисляются кислородом воздуха, перманганатом калия и другими окислителями. Они способны образовывать прочные межмолекулярные связи с белками и другими полимерами (пектиновые вещества, целлюлоза), легко адсорбироваться на кожном порошке, целлюлозе, клетчатке. Из водных растворов дубильные вещества осаждаются желатином, алкалоидами - основным ацетатом свинца, бихроматом калия, сердечными гликозидами. Алкалоиды образуют нерастворимые (или слабо растворимые) осадки с комплексными йодидами металлов, высокомолекулярными неорганическими кислотами, высокомолекулярными органическими веществами кислого характера (общеалкалоидные осадочные реакции). Алкалоиды вступают в реакции, зависящие от наличия в их молекулах различных функциональных групп. Например, морфин содержит фенольный гидроксил, поэтому он со щелочами образует феноляты; дает реакции с хлоридом окисного железа и другими реактивами. ГРУППЫ СЫРЬЯ ПО БАВ Полисахариды с порошком микрохимические реакции на слизь: - с тушью; - с метиленовым синим; - с раствором КОН; - проделать микрореакцию на крахмал с раствором Люголя; - проделать реакцию на одревесневшие элементы - с 1% спиртовым раствором флороглюцина и концентрированной НCl (1-2 капли). Количественное определение полисахаридов ГФ-Х1, вып.2 предлагает для листьев подорожника большого и слоевищ ламинарии. Метод определения - гравиметрический (весовой), основанный на осаждении полисахаридного водного извлечения 95% спиртом. Стадии анализа: 1) экстракция полисахаридов водой; 2) осаждение полисахаридов из водного извлечения 95% спиртом; 3) высушивание осадка и доведение его до постоянной массы. В слоевишах ламинарии, кроме того, определяют содержание йода после сжигания навески бромйодометрическим методом. Там же определяют содержание песка (SiO2). В сырье алтея, липы, льна, мать-и-мачехи, подорожника блошного количественного определения биологически активных веществ и экстрактивных веществ не проводят. Эфирные масла Метод количественного определения содержания эфирного масла в растительном сырье основан на: - физических свойствах эфирного масла - летучести и практической нерастворимости в воде; - на отсутствии химического взаимодействия эфирного масла и воды; - на законе Дальтона о парциальных давлениях. Согласно закону, смесь жидкостей закипает тогда, когда сумма их парциальных давлений достигает атмосферного давления. Следовательно, давление паров смеси жидкостей (вода + эфирное масло) достигнет атмосферного давления еще до кипения воды. В соответствии с ГФ-Х1, вып. 1, стр.290 (раздел «Общие методы анализа») определение проводят одним из 4 методов в зависимости от количества в сырье эфирного масла,его состава, плотности и термолабильности. Метод 1 и 2применяют, если эфирное масло имеет плотность меньше 1 и не растворяется в воде. Метод 3 и 4 применяют для сырья, содержащего эфирное масло, которое претерпевает изменения, образует эмульсию, легко загустевает и имеет плотность близкую к единице. Метод 1 (метод Гинзберга)- применяют для сырья, где много эфирного (масло термостабильное), в его составе преобладают моно- и бициклические монотерпены. Приемник для сбора эфирного масла помещается в экстрактивной колбе. Этим методом определяют содержание эфирного масла в сырье можжевельника, мяты, шалфея, эвкалипта, тмина. Метод 2 (метод Клавенджера) - используют, когда сырье содержит эфирного масла менее 0.2-0.3 %. Этот метод дает меньшую ошибку опыта. Приемник вынесен за пределы экстракционной колбы, что позволяет определить в сырье содержание термолабильного эфирного масла. Этим методом определяют содержание эфирного масла в сырье ромашки, тмина, мяты, шалфея, эвкалипта. Метод 3 (метод Клавенджера). Приемник см. 2-й метод. В приемник прибавляют органический растворитель для разрушения эмульсии или растворения загустевшего или тяжелого масла. Определяют эфирное масло в сырье аниса, аира, тысячелистника. Метод 4 впервые включен в ГФ Х1 и отличается от 3-его метода возможностью контролировать температуру конденсации. Во время гидродистилляции температура в отстойнике не должна превышать 25°С. В ГФ-Х1, вып.2, стр.227 на побеги багульника болотного даны два показателя содержания эфирного масла в сырье: - если сырье предназначено для получения экстемпоральных лекарственных форм, то эфирного масла должно быть не менее 0.1%; - если сырье предназначено для получения ледина, то эфирного масла должно быть не менее 0.7%. В таком эфирном масле дополнительно определяют содержание ледола методом газо-жидкостной хроматографией. Ледола должно быть не менее 17%. Сырье, содержащее эфирное масло, которое при перегонке претерпевает изменения, образует эмульсию, легко загустевает или имеет плотность, близкую к единице, анализируют методами 3 или 4. Количественное определение. Все методы количественного определения антраценпроизводных в сырье основаны на отделении свободных агликонов после кислотного гидролиза. Агликоны экстрагируют в органический растворитель и определяют различными методами. Количественное определение. 1. Гравиметрические или весовые методы – основаны на количественном осаждении дубильных веществ желатином, ионами тяжелых металлов или адсорбцией кожным (гольевым) порошком. Официальным в дубильно-экстрактовой промышленности является весовой единый метод (ВЕМ): В водных вытяжках из растительного материала вначале определяют общее количество растворимых веществ (сухой остаток) путем высушивания определенного объема вытяжки до постоянной массы; затем из вытяжки удаляют дубильные вещества, обрабатывая ее обезжиренным кожным порошком; после отделения осадка в фильтрате вновь устанавливают количество сухого остатка. Разность в массе сухого остатка до и после обработки вытяжки кожным порошком показывает количество подлинных таннидов. 2. Титриметрические методы. К ним относятся: 1) Желатиновый метод - Метод Якимова и Курницкой – основан на способности дубильных веществ образовывать нерастворимые комплексы с белками. Водные извлечения из сырья титруют 1 % раствором желатина, в точке эквивалентности комплексы желатино-таннаты растворяются в избытке реактива. Титр устанавливают по чистому таннину. Точку валентности определяют путем отбора наименьшего объема титрованного раствора, вызывающего полное осаждение дубильных веществ. Метод наиболее точный, т.к. позволяет определить количество истинных дубильных веществ. Недостатки: длительность определения и трудность установления точки эквивалености. 2) Перманганатометрический метод (метод Левенталя в модификации Курсанова). Это фармакопейный метод, основан на легкой окисляемости перманганатом калия в кислой среде в присутствии индикатора и катализатора индигосульфокислоты, которая в точке эквивалентности раствора меняется от синего до золотисто-желтого. Особенности определения, позволяющие оттитровать только макромолекулы дубильных веществ: титрование проводится в сильно разбавленных растворах (извлечение разбавляеттся в 20 раз) при комнатной температуре в кислой среде, перманганат добавляется медленно, по каплям, при интенсивном перемешивании. Метод экономичный, быстрый, прост в исполнении, но недостаточно точен, так как перманганат калия окисляет частично и низкомолекулярные фенольные соединения. 3) Для количественного определения таннина в листьях сумаха и скумпии используется метод осаждения дубильных веществ сульфатом цинка с последующим комплексонометрическимтитрованиемтрилоном Б в присутствии ксиленолового оранжевого. Физико-химические методы. 1) Фотоэлектроколориметрические - основаны на способности ДВ образовывать окрашенные соединения с солями трехвалентного железа, фосфорно-вольфрамовой кислотой, реактивом Фолина-Дениса и др. 2) Хроматоспектрофотометрические и нефелометрические методы используют в научных исследованиях. Химические методы. Качественный анализ. Включает качественные реакции и хроматографические пробы. Фенольные соединения в виде гликозидов извлекают из растительного сырья водой, затем извлечения очищают от сопутствующих веществ, осаждая их растворами ацетата свинца. С очищенным извлечением выполняют качественные реакции. Простые фенолы и агликоны фенологликозидов дают характерные для фенольных соединенийреакции: - с железоаммонийными квасцами - с солями тяжелых металлов - с диазотированными ароматическими аминами. Специфические реакции (ГФ Х1): - на арбутин(сырье толокнянки и брусники) используют цветные качественные реакции: - с кристаллическим сульфатом закисного железа. Реакция основана на получении комплекса, изменяющего окраску от сиреневого до темного с дальнейшим образованием темно-фиолетового осадка. - с 10 %-ным раствором натрия фосфорно-молибденовокислого в кислоте хлористоводородной. Реакция основана на образовании комплексного соединения синего цвета. - на салидрозид (сырье родиолы розовой): - реакция азосочетания с диазотированным сульфацилом натрия с образованием азокрасителя вишнево-красного цвета. 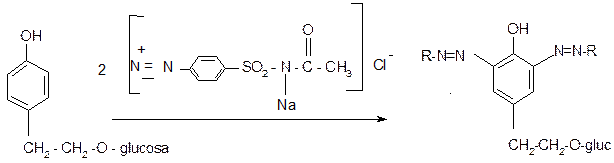 салидрозид азокраситель Количественное определение. Для количественного определения простых фенологликозидов в лекарственном растительном сырье используют различные методы: гравиметрические, титриметрические и физико-химические. 1. Гравиметрическим методом определяют содержание флороглюцидов в корневищах папоротника мужского. Метод основан на извлечении флороглюцидов из сырья диэтиловым эфиром в аппарате Сокслета. Извлечение очищают, отгоняют эфир, полученный сухой остаток высушивают и доводят до постоянной массы. В пересчете на абсолютно сухое сырье содержание флороглюцидов не менее 1,8%. 2. Титриметрический йодометрический метод используется для определения содержания арбутина в сырье брусники и толокнянки. Метод основан на окислении агликона гидрохинона до хинона 0,1 М раствором йода в кислой среде и в присутствии натрия гидрокарбоната. Выделяют стадии определения:
 3. Спектрофотометрический метод используется для определения содержания салидрозида в сырье родиолы розовой. Метод основан на способности окрашенного азокрасителя поглощать монохроматический свет при длине волны 486 нм. Стадии определения: 1. Извлечение салидрозида водой 2. Очистка водного извлечения осаждением балластных веществ раствором ацетата свинца и натрия сульфата 3. Получение окрашенного азокрасителя по реакции салидрозида с диазотированным сульфацилом натрия 4. Определение оптической плотности окрашенного раствора с помощью спектрофотометра при длине волны 486 нм 5. удельного показателя поглощения ГСО салидрозида Е1%1см = 253. Содержание салидрозида не менее 0,8 %. Качественное определение. Специфических реакций для всех групп флавоноидов не существует. Часто используют следующие качественные реакции и хроматографическое исследование: 1. Характерной реакцией на флавоноиды - Цианидиновая проба или проба Синода (проба Chinoda)(основана на восстановление их атомарным водородом в кислой среде в присутствии магния или цинка). Флавоноиды при восстановлении магнием или цинком в присутствии концентрированной хлористоводородной кислоты образуют красное окрашивание, обусловливаемое образованием антоцианидинов: 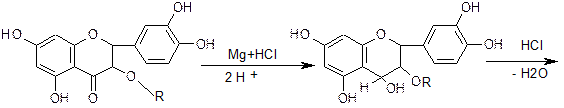 хроменол 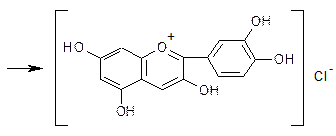 цианидин хлорид Реакция очень чувствительна, основана на восстановлении карбонильной группы и образовании антоцианида. Халконы и ауроны при помощи цианидиновой реакции не обнаруживаются, но при добавлении конц. HCl (без магния) образуют красное окрашивание за счет образования оксониевых солей.
Реакция отличия флавоноидов от фуранохромонов. Флавоноиды дают комплексы с борной кислотой желтой окраски с желто-зеленой флюоресценцией, которые не разрушаются лимонной кислотой (образование батохромного комплекса): 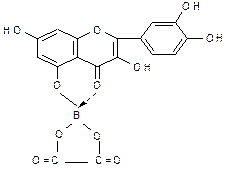 Количественное определение. В последние годы все большее распространение получают различные: 1. физико-химические методы анализа, которые имеют ряд существенных преимуществ в сравнении, например, с гравиметрическими и титрометрическими методами, а именно, быстрота и точность определения, обнаружение даже незначительных количеств и, что особенно важно, возможность выделения отдельных флавоноидов из растительного сырья. К таким методам относятся фотоэлектроколориметрия, спектрофотометрия, денситометрия с использованием хроматографии на бумаге и в тонком слое сорбента. 1. Сущность хроматоденситометрического метода заключается в выделении и разделении флавоноидов с непосредственной количественной денситометрической оценкой окрашенной зоны на хроматограмме. Метод имеет преимущества в быстроте проведения анализа и точности определения, так как в данном случае исключается стадия элюирования. 2. фотоэлектроколориметрический метод, основанный на измерении оптической плотности окрашенных растворов, полученных в цветных реакциях флавоноидов с солями различных металлов (алюминия, циркония, титана, хрома, сурьмы), с лимонно-борным реактивом и на реакции восстановления цинком или магнием в кислой среде, в реакции азосочетания с солями диазония. ГФ Х1 издания дает ФЭК-метод для определения содержания суммы флавоноидов в листьях вахты трехлистной. Предварительно сырье очищают от хлорофилла хлороформом, получают спиртовое извлечение флавоноидов, затем измеряют оптическую плотность окрашенного раствора с помощью фотоэлектроколориметра. Содержание суммы флавоноидов рассчитывают по калибровочному графику, построенному по стандартному образцу рутина. Известна цветная реакция флавоноидов с азотнокислым иуксуснокислым уранилом, позволяющая количественно определять рутин в смеси с кверцитином. В настоящее время широко используется метод спектрофотометричекий. Количественное определение. В последние годы все большее распространение получают различные: 1. физико-химические методы анализа, которые имеют ряд существенных преимуществ в сравнении, например, с гравиметрическими и титрометрическими методами, а именно, быстрота и точность определения, обнаружение даже незначительных количеств и, что особенно важно, возможность выделения отдельных флавоноидов из растительного сырья. К таким методам относятся фотоэлектроколориметрия,спектрофотометрия, денситометрия с использованием хроматографии на бумаге и в тонком слое сорбента. Сущность хроматоденситометрического метода заключается в выделении и разделении флавоноидов с непосредственной количественной денситометрической оценкой окрашенной зоны на хроматограмме. Метод имеет преимущества в быстроте проведения анализа и точности определения, так как в данном случае исключается стадия элюирования. Используется фотоколориметрический метод, основанный на измерении оптической плотности окрашенных растворов, полученных в цветных реакциях флавоноидов с солями различных металлов (алюминия, циркония, титана, хрома, сурьмы), с лимонно-борным реактивом и на реакции восстановления цинком или магнием в кислой среде. Известна цветная реакция флавоноидов с азотнокислым иуксуснокислым уранилом, позволяющая количественно определять рутин в смеси с кверцитином. В настоящее время широко используется метод спектрофотометричекий. Методы анализа кумаринов Для обнаружения кумаринов в растительном сырье проводят качественные реакции и хроматографическое исследование, используя лактонные свойства кумаринов: - вступать в реакцию разрыва лактонного кольца (лактонная проба); - давать окрашенные растворы с диазосоединениями; - флуоресцироватьв УФ-свете. Качественный анализ 1. Лактонная проба (предложена Г.А.Кузнецовой). Параллельно проводят контрольный опыт. Методика: 1 мл извлечения, содержащего кумарины, наливают в две пробирки. В одну добавляют 0,5 мл 10%-ного раствора натрия гидроксида. Обе пробирки нагревают на водяной бане, затем в обе прибавляют 4 мл дистиллированной воды и хорошо перемешивают. Если в пробирке, куда добавляли щелочь, раствор остался желтым и прозрачным, значит, реакция положительная, так как образуется желтая растворимая в воде соль кумаровой кислоты. В контрольной пробирке при добавлении воды раствор мутнеет, кумарины не растворяются в воде и выпадают в осадок. При подкислении щелочного раствора лактонное кольцо замыкается и кумарины выпадают в осадок. 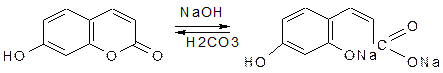 2. Реакция образования азокрасителя. Реакция проводится с продуктами, полученными после реакции разрыва лактонного кольца. Методика: В пробирку добавляют 1 мл свежеприготовленного диазореактива. Чаще всего, в качестве диазореактива используют диазосульфаниловую кислоту. Образуется азокраситель от желтого до вишнево-красного цвета.
- н-бутанол-уксусная кислота-вода БУВ (4:1:5) - н-гексан-бензол-метанол (5:4:1); - петролейный эфир-бензол-метанол (5:4:1); Идентифицируют кумарины по характерной флюоресценции в УФ свете или проявляют хромогенными реактивами. В качестве проявляющих реактивов служат 1%-ный спиртовый раствор алюминия хлорида, 10%-ный раствор щелочи или пары аммиака. Широкие возможности для обнаружения в растениях и сырье кумаринов, не только их суммы, но и отдельных соединений, открылись после внедрения хроматографического анализа. При этом указанные реактивы используют и для обработки хроматограмм. 4. Хроматографические методы удобны для выделения индивидуальных кумаринов. Количественное определение. Для количественного определения кумаринов в лекарственном РС используют гравиметрические, титриметрические и физико- химические методы анализа. По существующей нормативной документации для количественного определения кумаринов в лекарственном растительного сырье используют физико-химические методы анализа. 1. Полярографический метод. Определение кумаринов в плодах пастернака. Основан на восстановлении кумаринов на ртутно-капельном электроде в альфа-пироновом кольце по месту двойной связи в положении 3,4. Присоединяют галоген - йод, в качестве реактива используют тетраэтиламмоний йодид. Содержание комариное в пересчете на ксантотоксин не менее 1%.
для определения содержания простых кумаринов в траве донника лекарственного (не менее 0.4%) и пиранокумаринов в корневищах и корнях вздутоплодника сибирского(не менее 3 %). Получают хлороформное извлечение из сырья и измеряют у него оптическую плотность с помощью спектрофотометра. 3. Хроматоспектрофотометрический метод. Применяют для определения содержания фуранокумаринов в плодах амми большой, псоралеи костянковой, листьях инжира. Стадии определения: 1. Получение хлороформного извлечения из сырья. 2. Разделение суммы кумаринов методом хроматографии на бумаге в системе растворителей, указанной в нормативной документации. 3. Идентификация кумаринов в УФ-свете по характерному свечению. 4. Элюирование веществ с бумаги. Каждое вещество отдельно элюируют 95 %-ным этанолом. 5. Измерение оптической плотности растворов с помощью спектрофотометра при длине волны, указанной в нормативной документации. 6. Расчет содержание каждого соединения с учетом удельного показателя поглощения. Плоды амми большой: бергаптена и изопимпинеллина не менее 0,6 %. Плоды псоралеи костянковой: псоралена и изопсоралена не менее 0,9 %. Листья инжира: псоралена и бергаптена не менее 0,7%, отдельно псоралена менее 0,42 %. 4. Гравиметрический (весовой) метод. Основан на избирательной растворимости отдельных кумаринов в различных растворителях и способности лактонного кольца кумарина к раскрытию и обратному замыканию в зависимости от рН среды. Используется редкотолько для определения суммы кумаринов. 5. Фотоэпектроколориметрический метод. Основан на измерении оптической плотности окрашенного раствора, полученного по реакции азосочетания с солями диазония при определенной длине волны. Содержание суммы кумаринов рассчитывают по калибровочному графику, построенному по известному веществу. Алкалоиды - Различают общие качественные реакции,с помощью которых доказывается присутствие алкалоидов в сырье или в извлечении из сырья, и частные качественные реакции, с помощью которых доказывают или индивидуальный алкалоид или определенную группу алкалоидов. Общие реакции – это либо реакции осаждения, либо реакции окрашивания. Реакции осаждения основаны на способности алкалоидов к комплексообразованию. Образующиеся комплексы нерастворимы или мало растворимы в воде. Общеалкалоидные осадочные реактивы можно разделить на несколько групп: 1 группа. Йод и его растворы. Образуют с алкалоидами перйодиды, плохо растворимые в воде: 1) пары йода используют для открытия алкалоидов на хроматограммах; 2) раствор йода в KJ (реактив Вагнера, реактив Бушарда). С алкалоидами образуют бурые, трудно растворимые в воде осадки. 2 группа. Комплексные йодиды металлов: 1) Реактив Драгендорфа - калия тетрайодовисмутат (KBiJ4) - образует оранжевые или красно-бурые нерастворимые осадки. Реакцию с реактивом Драгендорфа, согласно действующей НД, используют для обнаружения (проявления) алкалоидов крестовника плосколистного на хроматограмме. 2) Реактив Майера - тетрайодомеркурат калия (K2HgJ4) - образует осадки белого или желтоватого цвета. Реакцию с реактивом Майера широко используют для проверки полноты экстракции алкалоидов при их количественном определении в сырье красавки обыкновенной, белены черной, дурмана обыкновенного, анабазиса безлистного. 3 группа. Реакгивы комплексных неорганических кислот (высокомолекулярные органические вещества кислого характера): 1) Реактив Бертрана - раствор кремневольфрамовой кислоты (SiO2 . 12 WO3 . 4 H2O) - образует белый аморфный осадок. Реакцию с реактивом Бертрана используют: - для подтверждения наличия алкалоидов в извлечении из листа барбариса и травы пассифлоры (качественные реакции); - для проверки полноты экстракции алкалоидов при их количественном определении в траве плауна-баранца и чистотела, листьях и корнях барбариса; 2) реактив Шейблера - раствор фосфорно-вольфрамовой кислоты (НзРО4 .12 WО3 . 2Н2О) - образует белые аморфные осадки; 3) реактив Зоненштейна - раствор фосфорно-молибденовой кислоты (НзРО4 • 12МоОз 2Н2О) - образует желтоватые аморфные осадки. Все эти реактивы высокочувствительны и часто используются в исследовательских работах. 4 группа. Органические вещества кислотного характера: 1)раствор пикриновой кислоты - дает осадки желтого цвета. Реакцию используют для осаждения алкалоида скополамина при его гравиметрическом определении в семенах дурмана индейского; 2) раствор танина - образует беловатые или бурые осадки. |
