практическое занятие. методы диагностики микозов. Методы диагностики микозов
 Скачать 288.42 Kb. Скачать 288.42 Kb.
|
|
Практическое занятие №9 Тема: Методы диагностики микозов. Цель занятия Знать: - задачи, структуру, оборудование, правила работы и техники безопасности в микробиологической лаборатории. – общие характеристики микроорганизмов, имеющие значение для лабораторной диагностики - требования к организации работы с микроорганизмами III–IV групп патогенности - механизм иммунологических реакций Уметь: - принимать, регистрировать, отбирать клинический материал, пробы объектов внешней среды и пищевых продуктов; - готовить исследуемый материал, питательные среды, реактивы и оборудование для проведения микроскопических, микробиологических и серологических исследований; - оценивать результат проведенных исследований; - вести учетно-отчетную документацию; - проводить утилизацию отработанного материала, дезинфекцию и стерилизацию, используемой в лаборатории посуды, инструментария, средств защиты рабочего места и аппаратуры; ДИАГНОСТИКА МИКОЗОВ Микроскопический метод, который следует рассматривать как основной. Причины – существенные морфологические особенности разных видов грибов, простота и быстрота исполнения исследования. Результат может быть получен через 1-2 часа. Микроскопия может быть проведена в нативных препаратах (висячая или раздавленная капля) без окрашивания. Для визуализации возбудителя в малопрозрачном биологическом материале (волосы, кожа, ногти и др.) производится обработка 10-20% щелочью (КОН), которая разрушает кератин и не влияет на морфологию клеток грибов. Фиксированные мазки окрашивают по Граму (грибы грамположительны), Романовскому-Гимзе, специальными методами. Диморфные грибы в биологическом материале находятся в дрожжевой форме. Возможна микроскопия гистологических препаратов, позволяющая помимо изучения морфологии гриба изучить патоморфологические процессы в пораженных тканях макроорганизма. Серологический метод: РИФ, которая рассматривается как экспресс-метод серологической идентификации грибковых антигенов. РПГА, латекс-агглютинация, РП, РСК, ИФА, РИФ. Используется для выявления грибковых антигенов и противогрибковых антител в крови, СМЖ, моче. Серологические реакции не всегда высоко специфичны из-за групповых антител, но дают результаты ранее, чем их можно получить культуральным методом. Культуральный (микологический) метод. Большинство патогенных грибов являются мезофилами (растут в интервале 20-45 0 С) и не требовательны к питательным средам, рН сред от 4,0 до 6,5. Время выращивания – в зависимости от вида гриба: от несколько суток до 2-3 недель. Наиболее часто используется среда Сабуро (пептонный агар с мальтозой или глюкозой). Кислотность среды и высокое содержание углевода ингибирует рост бактерий. На питательных средах диморфные грибы (возбудители подкожных, глубоких микозов) растут в мицелиальной форме при 20-25 0 С. Идентификация чистой культуры проводится по морфологическим и биохимическим признакам. Аллергический метод. Проводятся кожные пробы с аллергенами грибов (например – кандид), Метод недостаточно специфичен из-за групповых антигенов грибов разных видов. Биологический метод. Биопробы на лабораторных животных позволяют оценить вирулентность патогена, получить культуру гриба в тканевой (дрожжевой) форме. Молекулярно-генетический метод. Используют молекулярную гибридизацию и ПЦР. Достоинство – возможность применения на ранних стадиях болезни. Алгоритм выполнения манипуляции - нужно взять пинцет, предметное стекло, ложку фолькмана, ножницы; - пациента пригласить в перевязочную; - пациент сидит на стуле или кушетке; - м/с стоит. Техника выполнения - из очага поражения пинцетом взять чешуйки кожи и волосы; - взятый материал положить на предметное стекло и закрыть другим предметным стеклом. - вымыть руки с мылом; - взятый материал отправить в лабораторию. СБОР МАТЕРИАЛА Взятие ногтей на исследование: - взять ножницы и предметные стекла; - ножницами отрезать кусочек от свободного края ногтя; - взятый материал покрыть другим предметным стеклом; - ножницы и пинцет замочить в 3% растворе формалина. Правильный сбор материала из пораженных ногтей - залог успешного микробиологического исследования. Забирая материал, не всегда захватывают участки ногтя, содержащие жизнеспособные грибы. Нежизнеспособные грибы в культуре, естественно, не вырастут, и их вид установить не удастся. Участок ногтя, который надо взять, определяется формой онихомикоза. Так, при поверхностной форме онихомикоза следует делать соскобы с поверхности ногтевой пластинки. При самой распространенной дистальной подногтевой форме наиболее жизнеспособные грибы располагаются под ногтевой пластинкой. Материал, который направляют на исследование, должен включать не только обрезок ногтевой пластинки, но и соскоб с ногтевого ложа, из-под пластинки. Кроме того, следует захватывать и области неизмененного ногтя, поскольку на границе между ними и пораженными участками ногтя располагаются самые активные грибы. При проксимальной подногтевой форме брать материал трудно. В этих случаях иногда, особенно если собираются проводить гистологическое исследование или дифференциальную диагностику, предпринимают биопсию ногтя, изредка используют бормашину. При паронихиях делают соскобы с проксимального валика и из-под него. Во всех случаях, чтобы избежать бактериальной контаминации, перед взятием образца следует обработать ноготь этиловым спиртом. Микроскопическое исследование. Микроскопическое исследование патологического материала на грибы производят в нативных и окрашенных препаратах. Для приготовления неокрашенных препаратов полученный материал размельчают при помощи скальпеля или препаровальной иглы и помещают на середину предметного стекла. Для более четкого выявления элементов гриба производят просветление (мацерацию) материала. С этой целью прибегают к помощи различных веществ, чаще всего едкой щелочи (КОН, NaOH), которые растворяют эпидермальные чешуйки, слизь, гной, просветляют пигмент волоса и тем самым делают грибы доступными для исследования. На размягченные чешуйки кожи или ногтя, которые помещают на середину предметного стекла, наносят 1-3 капли 20 - 30% раствора КОН (NaOH). Исследуемый материал в каплях щелочи осторожно подогревают над пламенем спиртовки до появления нежного белого ободка из кристаллов щелочи по периферии капли. Подогревать до кипячения не следует. После подогревания каплю накрывают покровным стеклом, избегая попадания пузырьков воздуха. Р. А. Аравийский и Г. И. Горшкова (1995) рекомендуют просветленные и накрытые покровным стеклом препараты кожных чешуек и волос оставлять на 5 - 10 мин, а ногтевых пластинок – на 30 - 40 мин до микроскопирования. Просветление препаратов можно проводить без подогревания, для этого их оставляют в 20% растворе КОН на 30 - 60 мин или используют другие методы просветления патологического материала: хлораллактофенолом по Аману; лактофенолом; раствором, содержащим по 15% диметилсульфоксида и КОН в воде. Хорошие результаты получают после просветления ногтевых пластинок, помещенных в 5% раствор КОН на 24 ч, подогревания в этом случае не требуется. Микроскопическое исследование производят на обычном лабораторном микроскопе без иммерсии. Конденсор микроскопа должен быть опущен, диафрагма сужена. В начале препарат находят на стекле при малом увеличении (40х), последующее исследование производят при большем увеличении (100х); Детально препарат изучают при увеличении 400х. Необходимо исследовать несколько препаратов с тем, чтобы увеличить надежность анализа и избежать ложноположительных результатов. Ошибки в микроскопической диагностике грибов могут возникнуть в связи как с дефектами приготовления препарата, так и с недостаточной опытностью лаборанта. Дефекты изготовления прежде всего бывают связаны с перегреванием препарата, что может привести к выпадению кристаллов щелочи, разрушению волоса и появлению мелкозернистого распада в патологическом материале. Линейное расположение удлиненных ровных кристаллов щелочи весьма напоминает нити септированного мицелия даже на чистом стекле без патологического материала. Дифференциально-диагностическими признаками являются исключительное однообразие кристаллов, их стекловидная прозрачность, многогранность краев и отсутствие неразрывной связи одного элемента с другим. В сомнительных случаях рекомендуется добавить к препарату капельки слегка подогретой дистиллированной воды, которые быстро растворяют кристаллы щелочи. За элементы гриба ошибочно могут быть приняты: - капельки жира, - пузырьки воздуха, - хлопчатобумажные нити одежды - и так называемый «мозаичный грибок». Липиды кожных покровов, жировой распад клеток и зерна кератогиалина, особенно имеющие правильную форму, могут напоминать отдельные споры гриба. Но разнообразие формы и, главное, размеров, отсутствие внутренней структуры образований (вакуоли, оболочки) говорят против грибковой природы данных элементов. Липиды также могут попасть в препарат при взятии патологического материала с недостаточно очищенного очага поражения. Пузырьки воздуха могут напоминать споры дрожжеподобных клеток, но в отличие от последних они окружены плотной темной оболочкой, и даже самые маленькие пузырьки воздуха всегда больше клеток гриба. Нити от ткани носков, одежды и т. п. обычно лежат отдельно от патологического материала, они всегда больше гифов, грубее и не септированы. «Мозаичный грибок» представляет собой артефакт, который возникает в процессе кристаллизации (возможно, за счет распада холестерина). Он имеет вид сеточки или петель, очертания которых соответствуют границам роговых чешуек, в отличие от нитей мицелия он никогда не пересекает стенки клеток эпидермиса. В некоторых лабораториях просветление препаратов для микроскопического исследования проводят 15 - 30% раствором КОН, в который добавляют 5 - 10% коммерческих темно-синих чернил фирмы Паркер (Parker's Superchrome Blue-Black Ink). При этой окраске гифы и споры окрашиваются в голубой цвет. При микроскопии обнаруживают нитевидные гифы грибов или почкующиеся клетки (рис.1). 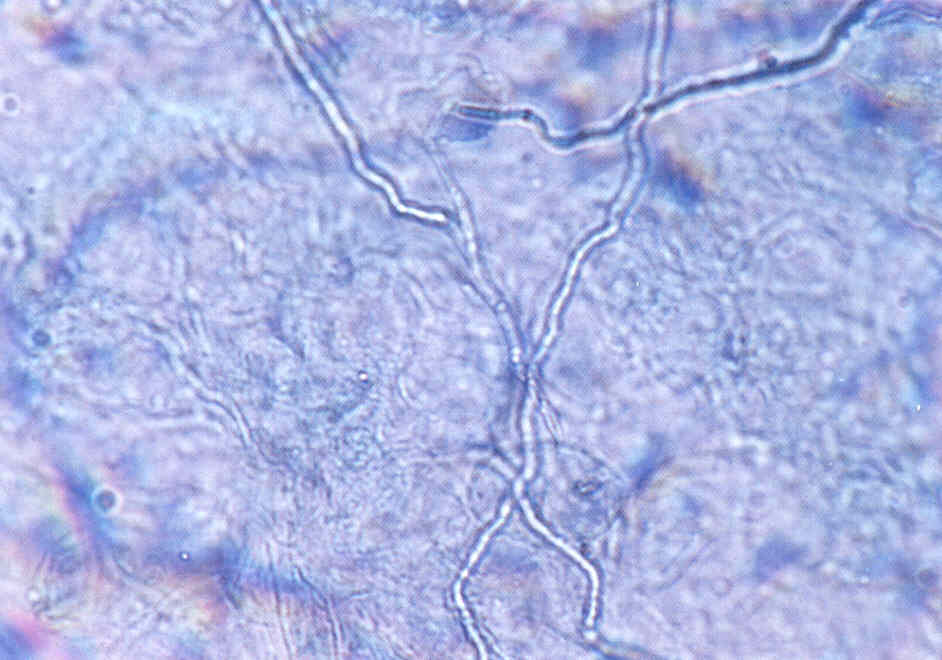 Рис. 1. Микроскопия соскоба с ногтей, пораженных Т. rubrum. Видны гифы гриба. Таким образом, микроскопия дает заключение только о грибковой природе инфекции, но не о виде гриба-возбудителя. Конечно, результативность микроскопического исследования зависит от квалификации сотрудника лаборатории. Культуральное исследование Проводят посев материала на стандартную среду Сабуро, часто с добавками антибиотиков. В диагностике дерматофитных инфекций принято добавлять в среду Сабуро циклогексимид, подавляющий рост грибов-контаминантов, попадающих из воздуха. Существуют готовые коммерческие среды с добавками антибиотиков и циклогексимида. Следует помнить, что многие плесневые грибы-недерматофиты и некоторые виды Candida не растут на среде с циклогексимидом, поэтому рекомендуется делать посев на среду Сабуро с циклогексимидом и на среду без него. Идентификацию видов обычно проводят при микроскопическом исследовании выросшей культуры или путем пересева на селективные среды (рис. 2-15). Рис. 2. Культура гриба Т. rubrum, выделенного из пораженных ногтей. Получена на среде Сабуро (слева) и кукурузном агаре (справа) 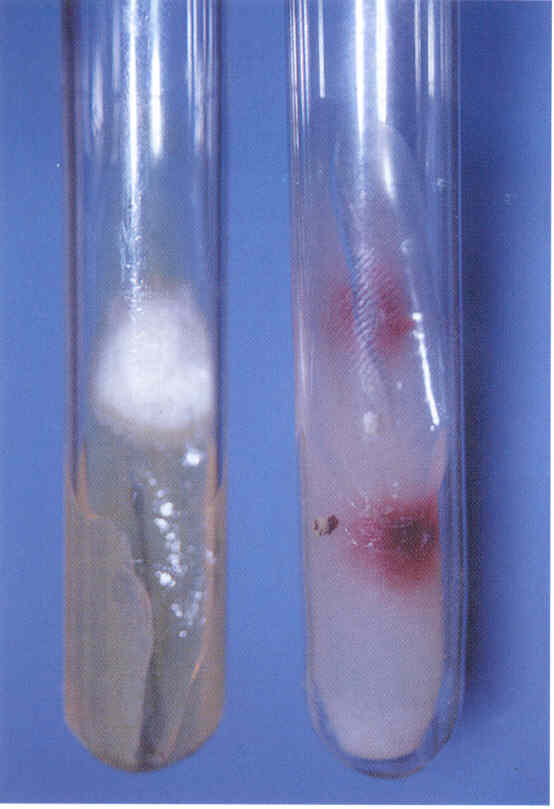 Рис. 3. Культура гриба Т. mentagrophytes var. interdigitale, выделенного из пораженных ногтей. Получена на среде Сабуро. 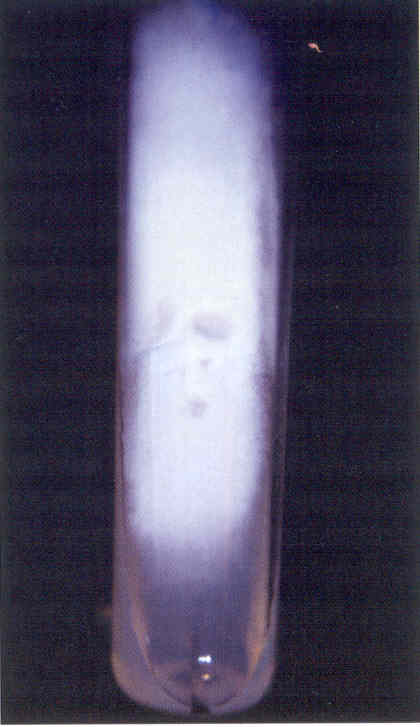 Рис. 4. Культура гриба Candida albicans. Получена на среде Сабуро.  Рис. 5. Культура гриба Torulopsis glabrata, выделенного из пораженных ногтей. Получена на среде Сабуро. 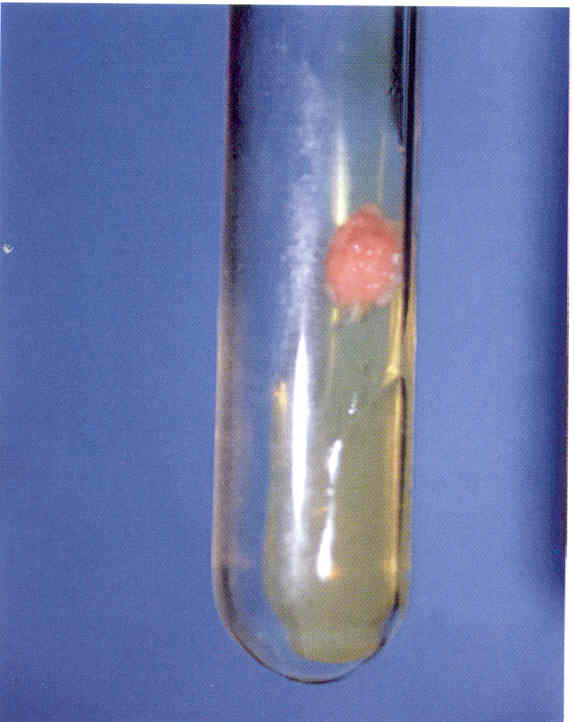 Рис. 6. Культура гриба Ulocladium sp., выделенного из пораженных ногтей. Рис 7. Панель питательных фед для идентификации дерматофитов (слева - культура Т rubrum, справа - Т mentagrophytes var. mterdigitale). Слева направо: среда Сабуро, среда Бакстера, среда Христенсена, кукурузный агар 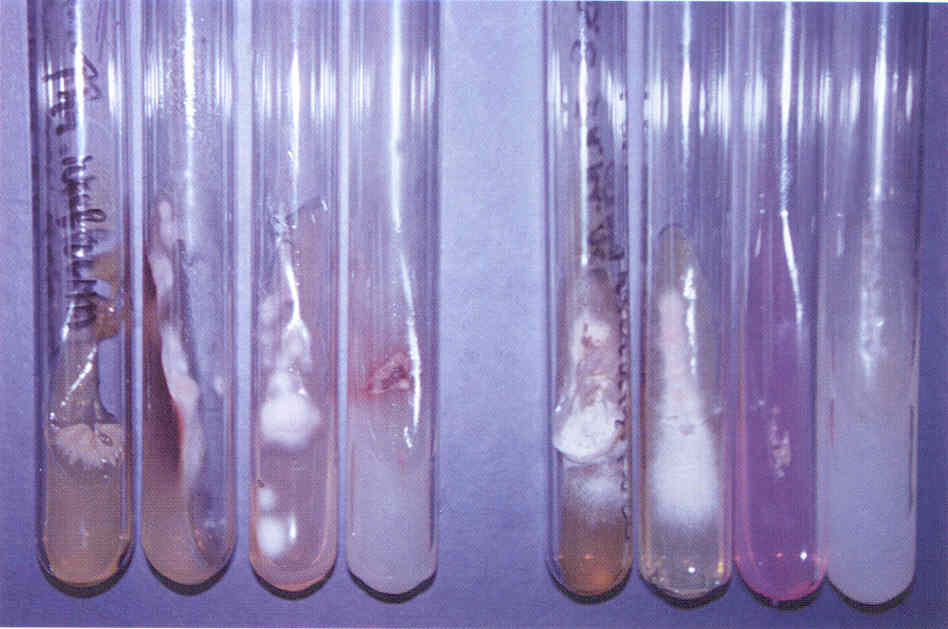 Следует учесть, что некоторые плесневые грибы, в том числе дерматофиты, в культуре вырастают медленно, за 2-3 нед. Даже при соблюдении всех правил сбора материала, при хорошем оборудовании лаборатории и высокой квалификации ее персонала число положительных результатов культурального исследования очень невелико. По данным зарубежной литературы, процент положительных исследований не превышает 50. Процент положительных результатов в лучших отечественных лабораториях едва достигает 30. Таким образом, в 2 из каждых 3 случаев онихомикоза его этиологию установить не удается. Люминисцентное исследование В 1925 г. Margaret и Deveze обнаружили, что волосы, пораженные некоторыми дерматофитами, дают характерное свечение в ультрафиолетовых лучах, пропущенных через фильтр Byда. Стекло Byда состоит из сульфата бария, содержит около 9% окиси никеля; оно пропускает лучи длиной 365 нм. В качестве источника ультрафиолетовых лучей можно использовать различные приборы. Природа свечения точно не установлена. Волос продолжает светиться после гибели гриба и после попыток экстрагировать флюоресцирующий материал горячей водой или холодным раствором бромида натрия. Интенсивность и характер свечения зависят от рН раствора. Полагают, что флюоресцирующая субстанция появляется в процессе взаимодействия гриба и растущего волоса. Свечение в ультрафиолетовых лучах, пропущенных через фильтр Вуда, характерно только для волос, пораженных грибами рода Microsporum (M. canis, M. audouinii, M. ferrugineum, M. distortium, изредка M. gypseum и M. nanum), a также Trichophyton schonleinii. Волосы, пораженные микроспорумами, особенно M. canis и M. audouinii, дают наиболее яркое свечение; волосы, пораженные Т. schonleinii, имеют тусклую зеленоватую флюоресценцию. Свечение наблюдается только в полностью пораженных грибом волосах. Его может не быть в свежих очагах поражения. В этих случаях следует эпилировать волосы из краевой, наиболее активной зоны, и свечение можно обнаружить в корневой части волос. Люминесцентный метод можно использовать как для диагностики и контроля за эффективностью лечения у отдельных больных, так и в эпидемиологических очагах. Компактные передвижные установки удобны для обследования контактных людей в школах, детских садах и т. п. Люминесцентное обследование необходимо производить в затемненной комнате, очаги поражения должны быть предварительно очищены от корок, остатков мази и т. п. Люминесцентный метод можно использовать для диагностики отрубевидного лишая, особенно при локализации очагов поражения на волосистой части головы. Очаги поражения при этом заболевании имеют красновато-желтое или бурое свечение. Это свечение, однако, не является строго специфичным, так как может наблюдаться при наличии перхоти на волосистой части головы и даже у здоровых людей в области устьев волосяных фолликулов на лице и верхней части туловища. Выявленные с помощью люминесцентного метода пораженные волосы должны обязательно подвергаться микроскопическому исследованию. Иммунологическое и биологическое исследования Иммунологические методы исследования используют для выявления специфической перестройки организма и серологической диагностики грибковых заболеваний. Для обнаружения специфических антител в сыворотке пробы проводят следующие серологические реакции: агглютинации, преципитации, связывания комплемента, иммунофлюоресценции с соответствующими антигенами. Аллергическое состояние организма больного выявляют с помощью аллергических кожных проб. Аллергены наносят на скарифицированную кожу по Пирке или втиранием в кожу по Моро, внутрикожно по Манту, а также уколом в кожу. С помощью этих проб выявляют аллергические реакции как немедленного, так и замедленного типа, что позволяет оценить состояние гуморального и клеточного иммунитета. Для выявления специфической сенсибилизации лимфоцитов используют реакции дегрануляции базофилов, агломерации и альтерации, тест бластной трансформации, подавления миграции макрофагов и т. п. Сопоставление результатов серологических и аллергических реакций оказывается полезным как для диагностики, так и для прогноза течения микозов. Биологический метод. Используется для лабораторной диагностики глубоких и особо опасных микозов. Основан на заражении животных патологическим материалом от больного или культурой исследуемого гриба. Осуществляется в специальных лабораториях. 1. Вопросы для самоподготовки: 1. Систематика и классификация грибов Морфология и биология грибов 2. Патогенез микозов. Противогрибковый иммунитет. 3. Классы патогенных грибов, их характеристика. 2. В тетради для практических работ заполните схемы: Грибы, мицелий, высшие грибы, низшие грибы, экзоспоры, эндоспоры. |
