Мфп. МФА Занятие № 10. Методы фармакопейного анализа солодунова г. Н. Новиков м. С
 Скачать 396.71 Kb. Скачать 396.71 Kb.
|
|
ФБГОУ ВО «Волгоградский государственный медицинский университет» Министерства здравоохранения Российской Федерации МЕТОДЫ ФАРМАКОПЕЙНОГО АНАЛИЗА СОЛОДУНОВА Г.Н. НОВИКОВ М.С. ФИЗИЧЕСКИЕ МЕТОДЫ ФАРМАКОПЕЙНОГО АНАЛИЗА ЛЕКАРСТВЕННЫХ ВЕЩЕСТВ ОПРЕДЕЛЕНИЕ РАСТВОРИМОСТИ СУБСТАНЦИЙ ЛЕКАРСТВЕННЫХ ВЕЩЕСТВ Занятие 10 IV семестр Волгоград, 2021 ОПРЕДЕЛЕНИЕ РАСТВОРИМОСТИ СУБСТАНЦИЙ ЛЕКАРСТВЕННЫХ ВЕЩЕСТВ ЗАНЯТИЕ № 10 IV семестр ОПРЕДЕЛЕНИЕ РАСТВОРИМОСТИ Растворимость Р  астворимость – это способность веществ растворяться друг в друге, количественно характеризуется коэффициентом растворимости - это масса растворённого вещества, приходящаяся на 100 или 1000 г растворителя, в насыщенном растворе - при определённой температуре. астворимость – это способность веществ растворяться друг в друге, количественно характеризуется коэффициентом растворимости - это масса растворённого вещества, приходящаяся на 100 или 1000 г растворителя, в насыщенном растворе - при определённой температуре.Растворимость веществ различна, она зависит от: Температуры при которой происходит растворение (для большинства веществ растворимость при повышении температуры увеличивается). Давления (для газов). Природы вещества и растворителя (подобное растворяется в подобном). Это означает, что молекулярные и ионные соединения с полярной связью хорошо растворяются в полярных растворителях, а вещества с неполярной связью – в неполярных. От предела растворимости. Каждое вещество имеет свой предел растворимости (ПРфарм). Предел растворимости – наибольшее количество лекарственного вещества, которое может раствориться в данном растворителе при данной температуре. При растворении твердых веществ в воде объем системы обычно изменяется незначительно. Поэтому растворимость твердых веществ практически не зависит от давления. Жидкости также могут растворяться в жидкостях. Некоторые из них неограниченно смешиваются друг с другом в любых пропорциях (например, спирт и вода), другие – взаимно растворяются лишь до известных пределов. В большинстве подобных случаев с повышением температуры взаимная растворимость жидкостей увеличивается до тех пор, пока не будет достигнута температура, при которой обе жидкости смешиваются в любых пропорциях. Температура, при которой ограниченная растворимость жидкостей переходит в неограниченную, называется критической температурой растворения. Так, при температуре 66,4 °С фенол ограничено растворим в воде, а вода ограниченно растворима в феноле. Температура 66,4 °С – критической температурой растворения для системы вода - фенол: начиная с этой температуры обе жидкости неограниченно смешиваются друг с другом. Итак, растворимость веществ бывает: неограниченная (вода и спирт; калия хлорид и калия бромид; калий и рубидий) – эти вещества смешиваются в любых соотношениях. ограниченная(вода и соль поваренная) – растворяется определенное количество вещества в конкретном растворителе. Совсем нерастворимых веществ не бывает. Даже Au и Ag растворимы в воде, а когда воду наливают в стеклянный сосуд, то незначительная часть молекул стекла переходит в раствор. Некоторые вещества растворяются медленно, хотя в значительных количествах, с целью ускорения растворения таких веществ прибегают к определенным приемам. Процессы ускоряющие растворимость: Нагревание или использование горячего растворителя: - горячий растворитель используется при приготовлении растворов сульфацила натрия, борной кислоты, перманганата калия; - растворов глюкозы в больших концентрациях, - масляные, глицериновые растворы готовят при нагревании; - фурацилин растворяют при нагревании раствора на открытом огне. Перед растворением вещества измельчают (чтобы увеличить поверхность соприкосновения растворяемого вещества и растворителя). Перемешивание (при перемешивании или взбалтывании ускоряется процесс получения раствора). Вещества помещают в верхний слой растворителя (протаргол, йод). Понятие «растворимость» широко используется в фармакологии: По определению растворимости судят о чистоте субстанции и вспомогательных веществ. При изготовлении лекарственных средств, биологически активных добавок (БАД) зная о растворимости, применяют специальные технологические приемы: Изменяют последовательность растворения (смешивания) ингредиентов. Используют приемы раздельного растворения компонентов. Смешивают части лекарственных веществ, различные основы и затем объединяют эти части в единое целое Зная о растворимости веществ, подбирают различные сорастворители, солюбилизаторы и стабилизаторы для создания прочных лекарственных форм. Солюбилизаторы - класс поверхностно-активных веществ. Солюбилизаторы способствуют растворению труднорастворимых ингредиентов в жидкой основе раствора. Процесс солюбилизации состоит в распределении частиц труднорастворимого вещества между раствором и мицеллами солюбилизатора. 3. Для приема лекарственных средств и БАД очень важны знания о растворимости препарата: лекарственное средство легче проникает в растворенном виде в желудочно – кишечный тракт, таким образом, принося более быстрый эффект облегчения больному, в отличие от мало растворимых или трудно растворимых лекарственных форм. Определение растворимости веществ в разных растворителях обычно приводятся в частных статьях на субстанции или вспомогательные вещества. Количественно растворимость выражается концентрацией насыщенного раствора, т.е. раствора, находящегося при данных условиях в равновесии с избытком растворяемого вещества. Растворы Растворы имеют важное значение в жизни человека. Раствором называется жидкая гомогенная система, состоящая из двух или более компонентов (составных частей). Растворы (на латинском «solution») – жидкие лекарственные формы, получаемые путем растворения жидких, твердых и газообразных веществ в соответствующем растворителе, предназначенные для наружного, внутреннего, парентерального применения. Отличие растворов от других смесей в том, что частицы составных частей распределяются в нем равномерно, и в любом микрообъеме такой смеси состав будет одинаков. Физическая теория растворов: Основоположенниками были Вант Гофф, Оствальд, Лррениус, которые считали, что процесс растворения является результатом диффузии (процесс взаимного перемешивания веществ). Химическая теория растворов: В противоположность физической теории растворов – Д.И. Менделеев доказывал, что растворение является результатом химического взаимодействия растворенного вещества с молекулами воды и что правильнее определять раствор как однородную систему, которая состоит из частиц растворенного вещества, растворителя и продуктов их взаимодействия Обычно растворителем считали тот компонент, который в чистом виде существует в таком же агрегатом состоянии, что и полученный раствор (например, в случае водного раствора соли растворителем является вода). Если же оба компонента до растворения находились в одинаковом агрегатном состоянии (например, спирт и вода), то растворителем считается компонент, находящийся в большем количестве Растворы занимают промежуточное состояние между механическими смесями и химическими соединениями. В зависимости от количества растворенного вещества растворы делятся на три группы: Ненасыщенные – предел растворимости не достигнут; Насыщенные – предел растворимости достигнут; Перенасыщенные – предел растворимости превышен. Растворение кристалла в жидкости происходит следующим образом: Когда вносят кристалл в жидкость, в которой он может растворяться, от поверхности его отрываются отдельные молекулы. Процесс растворения идет самопроизвольно и раствор остается ненасыщенным. Молекулы растворяемого вещества, благодаря диффузии, равномерно распределяются по всему объему растворителя. Этот процесс должен был бы продолжаться до полного растворения любого количества кристаллов, если бы одновременно не происходил обратный процесс - кристаллизация. Перешедшие в раствор молекулы, ударяясь о поверхность не растворившегося вещества, снова притягиваются к нему и входят в состав кристалла. Попятно, что выделение молекул из раствора будет идти тем быстрее, чем выше их концентрация в растворе. А так как последняя по мере растворения вещества увеличивается, то, в конце концов, наступает такой момент, когда скорость растворения становится равной скорости кристаллизации. Тогда устанавливается динамическое равновесие при котором в единицу времени столько же молекул растворяется, столько и выделяется из раствора. Когда система окажется в состоянии истинного равновесия - раствор станет насыщенным. В такой системе неопределенно долго могут сосуществовать раствор и избыток растворенного вещества. Растворимость большинства веществ уменьшается с понижением температуры, поэтому при охлаждении горячих насыщенных растворов избыток растворенного вещества обычно выделяется. Однако, если проводить, охлаждение осторожно и медленно, выделения вещества из него может и не произойти. В этом случае получится раствор, содержащий значительно больше растворенного вещества, чем его требуется для насыщения при данной температуре. Такие растворы называются пересыщенные. Растворители Главным растворителем является вода. Но не все вещества, особенно органические, растворяются в воде. Для растворения используют различные растворители, такие как ацетон, спирт, бензол, эфир, хлороформ, метанол и т.д. Применяются также смеси растворителей, например, смеси спирта с водой. Растворители – это индивидуальные химические соединения или их смеси, способные растворять различные вещества и образовывать и ними однородные системы – растворы, состоящие из одного или нескольких компонентов. Растворители подразделяются на неорганические (чаще водные) и органические (неводные). Требования к растворителям: Хорошая растворяющая способность. Инертность к растворенному веществу и аппаратуре. Минимальная токсичность, огнеопасность. Микробная устойчивость. Растворитель должен получаться быстро и дешево. Должен быть фармакологически индифферентным. Не иметь неприятного вкуса и запаха. Способы выражения состава раствора Насыщенными растворами приходится пользоваться сравнительно редко. В медицинской практике, в большинстве случаев, употребляются растворы ненасыщенные, т.е. с меньшей концентрацией растворенного вещества, чем в насыщенном растворе. Концентрация или доля компонента смеси – величина, количественно характеризующая содержание компонента относительно всей смеси. Терминология ИЮПАК под концентрацией компонента понимает четыре величины: соотношение молярного компонента численного количества компонента соотношение массы соотношение объёма к объёму раствора Долей компонента ИЮПАК называет безразмерное соотношение одной из трёх однотипных величин — массы, объёма или количества вещества. Однако в обиходе термин «концентрация» могут применять и для долей, не являющихся объёмными долями, а также к соотношениям, не описанным ИЮПАК. Оба термина могут применяться к любым смесям, включая механические смеси, но наиболее часто применяются к растворам. Способы выражения концентрации растворенного вещества в растворах Массовая доля Массовая доля – отношение массы растворённого вещества к массе раствора. Массовая доля измеряется в долях единицы или в процентах.
ω = , где: m1 – масса растворённого вещества, г mобщ – общая масса раствора, г . Массовое процентное содержание компонента, m% m%=(mi/Σmi)*100 Объёмная доля Объёмная доля – отношение объёма растворённого вещества к объёмураствора раствора. Объёмная доля измеряется в долях единицы или в процентах.
φ = , где: V1 – объём растворённого вещества, л; Vобщ – общий объём раствора, л. Молярная концентрация (молярная объёмная концентрация, молярность) Молярная концентрация — количество растворённого вещества (число молей) в единице объёма раствора. Молярная концентрация в системе СИ измеряется в моль/м³, однако на практике её гораздо чаще выражают в моль/л или ммоль/л. Обозначается как «Cm» , в некоторых источниках как «М».
Сm = , где: ν – количество растворённого вещества, моль; V – общий объём раствора, л. Нормальная концентрация (мольная концентрация эквивалента, «нормальность») Нормальная концентрация — количество эквивалентов данного вещества в 1 литре раствора. Нормальную концентрацию выражают в моль-экв/л или г-экв/л (имеется в виду моль эквивалентов). Для записи концентрации таких растворов используют сокращения «СN», «Н» или «N».
Сn = 1/f , где: ν – количество растворённого вещества, моль; V – общий объём раствора, л; f – число эквивалентности (фактор эквивалентности ). Мольная (молярная) доля Мольная доля — отношение количества молей данного компонента к общему количеству молей всех компонентов. Мольную долю выражают в долях единицы.
χ х = , где: νх – количество v молей искомого компонента, моль; i – число компонентов; χ х – мольная доля искомого компонента. Моляльность (молярная весовая концентрация, моляльная концентрация) Моляльность — количество растворённого вещества (число моль) в 1000 г растворителя. Измеряется в молях на кг, также распространено выражение в «моляльности». Так, раствор с концентрацией 0,5 моль/кг называют 0,5-мольным.
μ = , где: ν – количество растворённого вещества, моль; m – масса растворителя, кг. Титр раствора (массовая концентрация) Титр раствора — масса растворённого вещества в 1 мл раствора.
Т = , где: m – масса растворённого вещества, г; V – общий объём раствора, мл; По рекомендации ИЮПАК, массовая концентрация (титр) обозначается символом ɤ или ρ . В аналитической химии обычно концентрацию титранта пересчитывают прменительно к конкретной реакции титрования таким образом, чтобы объём использованного титранта непосредственного показывал массу определяемого вещества; то есть титр раствора показывает, какой массе определяемого вещества (в граммах) соответствует 1 мл титрованного раствора. Весообъёмные проценты Соответствуют отношению массы одной части вещества (например, 1 г) к 100 частям объёма раствора (например, к 100 мл). Этот способ выражения используют, например, в спектрофотометрии, если неизвестна молярная масса вещества или если неизвестен состав смеси, а также по традиции в фармакопейном анализе. Другие способы выражения концентрации растворов Существуют и другие, распространённые в определённых областях знаний или технологиях, методы выражения концентрации. Например, при приготовлении растворов кислот часто указывают, сколько объёмных частей воды приходится на одну объёмную часть концентрированной кислоты (например, 1:3). Концентрация загрязнений в воздухе может выражать с в частях на миллион. Иногда используют также отношение масс (отношение массы растворённого вещества к массе растворителя) и отношение объёмов аналогично, отношение объёма растворяемого вещества к объёму растворителя) Формулы для перерасчета концентраций. (плотность (ρ) раствора дана в г/мл) Таблица № 1
ЛАБОРАТОРНАЯ РАБОТА ОПРЕДЕЛЕНИЕ ПРЕДЕЛОВ РАСТВОРИМОСТИ ЛЕКАРСТВЕННЫХ ВЕЩЕСТВ ЦЕЛЬ РАБОТЫ: Научиться определять градацию растворимости различных веществ в соответствии с частными фармакопейными статьями. ОБЪЕКТЫ ИССЛЕДОВАНИЯ: Галогениды щелочных металлов, карбонат лития, кислота бензойная. кислота винная, борная кислота. В фармакопее под растворимостью подразумевают свойство вещества растворяться в разных растворителях, принятых Государственной фармакопеей, т.е. имеется в виду не физическая константа, а свойство, выраженное приблизительными данными. Свойство растворяться в воде и других растворителях служит для ориентировочной характеристики лекарственных средств. Показатели растворимости в разных растворителях приведены и частых статьях. В некоторых случаях растворимость может быть показателем чистоты, если в частной статье на лекарственное средство имеется специальное указание. Фармакопея характеризует растворимость лекарственных средств, как правило в воде, а также в ряде органических растворителях (чаще всего в 96 %-ном этиловом спирте, эфире, хлороформе, реже в водных растворах кислот и щелочей). Для обозначения растворимости веществ в фармакопее приняты условные термины (в пересчете на 1 г), значения которых приведены в таблице: Таблица № 2
Изменение растворимости лекарственного вещества укатывает на присутствие или появлением в процессе хранения менее растворимых примесей. Таким образом, характеризуют изменение его качеств. Методика определения растворимости К навеске растертого в тонкий порошок вещества прибавляют отмеренное количество растворителя и непрерывно встряхивают в течение 10 мин при (20 ± 2) ºC. Для медленно растворимых веществ, требующих для своего растворения более 10 мин, допускается нагревание на водяной бане до 30 ºC. Наблюдение производят после охлаждения раствора до комнатной температуры и энергичного встряхивания в течение 1 – 2 мин. Условия растворения медленно растворимых веществ указывают в фармакопейных статьях. Для веществ с неизвестной растворимостью испытание проводят по следующей методике: К 1,0 г растертого вещества прибавляют 1,0 мл растворителя и проводят растворение, как описано выше. Если вещество полностью растворилось, оно очень легко растворимо. Если вещество растворилось не полностью, то к 100 мг растертого вещества прибавляют 1,0 мл растворителя и проводят растворение, как описано выше. Если вещество полностью растворилось, оно легко растворимо. Если вещество растворилось не полностью, то добавляют 2,0 мл растворителя и продолжают растворение. Если вещество полностью растворилось, оно растворимо. Если вещество растворилось не полностью, то добавляют 7,0 мл растворителя и продолжают растворение. Если вещество полностью растворилось, оно умеренно растворимо. Если вещество растворилось не полностью, то к 10 мг растертого вещества прибавляют 10,0 мл растворителя и проводят растворение, как описано выше. Если вещество полностью растворилось, оно мало растворимо. Если вещество растворилось не полностью, то к 10 мг растертого вещества прибавляют 100 мл растворителя и проводят растворение, как описано выше. Если вещество полностью растворилось, оно очень мало растворимо. Если вещество не растворилось, оно практически нерастворимо в данном растворителе. Таблица № 3
Методика определения точного соотношения Растворителя и растворенного вещества Навеску препарата массой 1 г вносят и отмеренное количество растворителя, соответствующее нижнему пределу диапазона, установленного в предыдущем опыте, и при перемешивании на магнитной мешалке при 20 ± 2 °С из бюретки прибавляют по 1 мл раствора с интервалом в 2-3 мин до полного растворения навески препарата (в интервале своей группы). Вывод: В результате проведённых опытов научились давать оценку растворимости лекарственных веществ. Определили, что растворимость всех препаратов соответствует требованиям нормативной документации (Государственная Фармакопея XIII), эти данные позволяют сделать вывод о чистоте лекарственных препаратов. ЗАДАЧИ И УПРАЖНЕНИЯ ПО ТЕМЕ "РАСТВОРЫ" Водный 0,02 % раствор фурациллина используют при гнойных процессах как антибактериальный препарат. Рассчитайте сколько фурациллина и воды необходимо взять для приготовления 10 литров водного раствора. Плотность раствора и воды принять равной 1 г/мл. Сироп алоэ с железом применяют для профилактики и лечения железодифицитных анемий. Раствор состоит: - 135 г раствор FeCl2 20 % - 15 г кислоты хлористоводородной разведённой; - 4 г кислоты лимонной; - сироп из сока алоэ древовидного до 1000 г. Определите массовую долю хлорида железа (II) и кислоты лимонной в полученном растворе. Мазь «Фустин» - однородная густая масса жёлтого цвета применяется при ожёгах, гнойных ранах и пиодермии. Мазь содержит: - 0,02 % фурациллина; - 1, 6 % синтомицина; - 3,0 % анестезина; - ланолин, стеарин и воду до 100%. Рассчитайте, сколько необходимо взять фурациллина, синтомицина и анестезина, если необходимо приготовить 250 г мази. Раствор токоферола ацетата в масле содержит 30% основного вещества. При лечении дистрофии было назначено принимать по 0,1 г токоферола ацетата в сутки в течении месяца. Сколько раствора уйдёт на лечение и сколько токоферола ацетата и масла надо взять для приготовления этого раствора. Драже «Мезим-Форте» содержит 140 мг панкреотина и балластного вещества до 1 г. Одна конвалюта содержит 10 драже. Определите, сколько панкриотина и балластного вещества необходимо для изготовления 20 конвалют. Раствор аскорбиновой кислоты для инъекций (5%) содержит 2,385 г натрия гидрокарбоната на каждые 5 г кислоты аскорбиновой. Разовая доза 3 мл. Назначено 10 дней по три инъекции в день. Сколько грамм кислоты аскорбиновой и гидрокарбоната натрия будет введено в организм. Линимент борно-цинковый, применяющийся наружно как антисептическое средство, имеет состав: - 1 г кислоты борной; - 10 г цинка окиси; - 40 г масла подсолнечного. Сколько грамм каждого компонента необходимо для приготовления 400 г линимента. какова массовая доля кислоты борной в данной смеси. «Формидрон» - жидкость, применяющаяся как дезинфи-цирующее и дезодорирующее средство содержит 37%-ный раствор формальдегида - 10 частей, 95%-ного спирта - 39,5 частей, воды - 50 частей и 0,5 части одеколона. Рассчитайте массовую долю формальдегида в «Форми-дроне». В хирургической практике применяют медицинский эфир 4 об. % для наркоза по открытой (капельной) системе. Рассчитайте, сколько г эфира содержиться в 150 мл этого раствора. Плотность эфира 0,714 г/мл. Назначено таблетки димедрола, как противогистаминный препарат, по 0,05 г три раза в день. Курс лечения 15 дней. Одна конвалюта содержит 10 таблеток по 0,1 г. Сколько конвалют необходимо приобрести на три курса лечения. Спирт этиловый 70% об. применяют как антисептичес-кий препарат. Определить массовые соотношения спирта и воды. Плотность 70% спирта 0,882 г/мл; 96% - 0,812 г/мл. Капли «Вотчала» широко применяют при лёгких формах стенокардии. Их состав: - 10 мл раствора валерианы; - 1 мл 1% раствора нитроглицерина: - 2 мл раствора валидола. Определить содержание (% по массе) нитроглицерина в данном растворе. Плотность раствора принять равной 1 г/мл. Сколько грамм нитроглицерина содержится в 150 мл этих капель. Одна таблетка иодида калия содержит: - калия ийодида.......................0,5 г - калия карбоната................0,005 г. Расчитайте загрузку солей в бункер для таблетирования на 1000 таблеток, учитывая, что ω (KJ) = 99.5 %, а ω (К2СО3) = 98,5 %. Раствор натрия хлорида 0,9 % применяется как изотонический. Рассчитайте, сколько необходимо взять NaCI и воды для приготовления 1 литра раствора для инъекций. ω (NaCI) = 99,6 %. а плотность изотонического раствора равна 1,05 г/мл. Рецепт: Solutionis Natrii bromidi 3% - 100 мл. D.S. По 1 ст. л. 3 раза в день. На титрование 1 мл микстуры пошло 2,75 мл 0,1 моль/л раствора нитрата серебра. Правильно ли приготовлена микстура, если допустимое отклонение равно ± 4 %? М (NaBr) = 102,9 г/моль, а ρ = 1 г/мл. В какой массе воды надо растворить 25 г CuSO4 5Н2О, чтобы получить 8 % (по массе) раствор CuSO4? Вычислить молярные доли спирта и воды в 96 % (по массе) растворе этилового спирта. Рассчитать молярную концентрацию хлористоводородной (соляной) кислоты, содержащей 36,5 % (по массе) НС1. ρ (НCl) = 1,18 г/мл. Правильно ли приготовлен 5 % раствор натрия гидрокарбоната 100 мл, если на титрование 1 мл его пошло 6 мл 0,1 моль/л раствора хлористо- водородной кислоты. Допустимые отклонения H2SO4 ± 2 %. М (NaHCO3) = 84 г/моль. Сколько граммов Na2SО4 10H2O надо растворить в 800 г воды, чтобы получить10% по массе раствор Na2SО4? Процесс растворения веществ с ионной связью  Процесс растворения веществ с ковалентной полярной связью 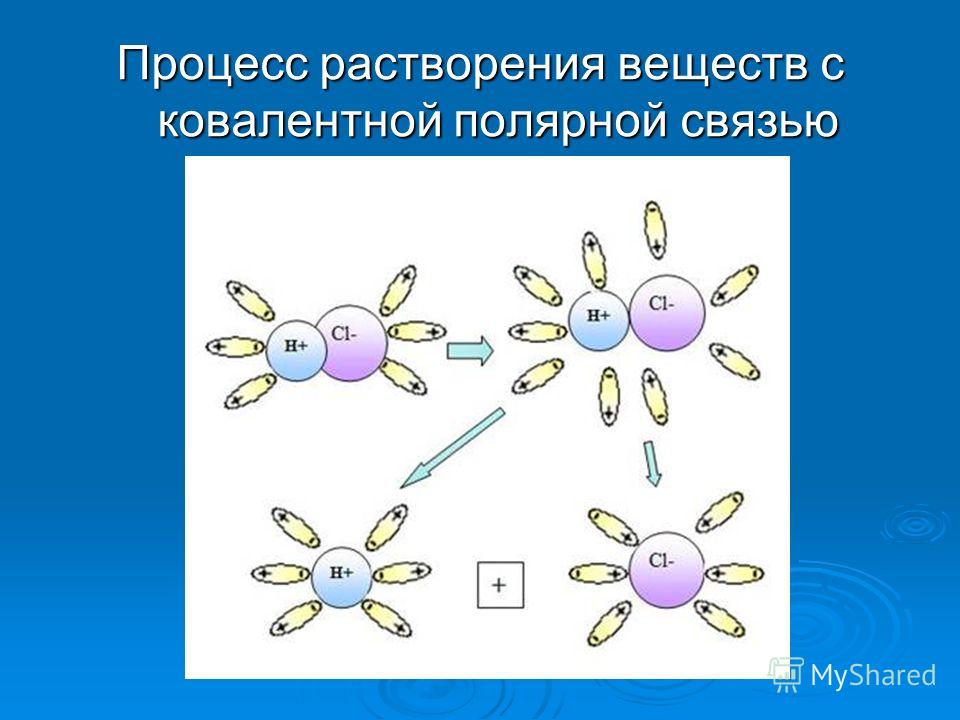 |

 m1
m1