|
|
Методы и техника определения времени жизни зондов в метастабильн. Методы и техника определения времени жизни зондов в метастабильном электронном состоянии
Федеральное государственное бюджетное образовательное учреждение
высшего образования
«Саратовский государственный технический университет
имени Гагарина Ю. А.»
кафедра «Физика»
КУРСОВАЯ РАБОТА
по дисциплине «Физика и техника оптических измерений»
тема: «Методы и техника определения времени жизни зондов в метастабильном электронном состоянии»
Семестр 8 учебный год 2021-2022
Выполнил студент 4 курса
Форма обучения очная
Институт физико-технический
Группа б-ТХФИ41
Номер зачетной книжки 180108
Ступников Артемий Васильевич
Подпись студента
Дата выполнения работы 31.03.2022г
Проверил Профессор, кафедра «Физика»
Мельников Геннадий Васильевич
Оценка
Подпись преподавателя
Саратов 2022
Оглавление
Введение……………….……………………………………….………….………3
Глава 1. Литературный обзор
Понятие метастабильного состояния...………………...…………………4
Зонды в фосфоресценции.…………………………………….……….….6
Время жизни фосфоресценции………………………….……….……..…9
Глава 2 Методы и техники определения времени жизни фосфоресценции…10
2.1. Использованные вещества………………………………………………….11
2.2.Техника фосфоресцентной спектроскопии……………………………..….12
Глава 3 Экспериментальная часть…………......................................................16
3.1 Описание установки…………………………………………………………16
3.2 Оптическая схема……………………………………………………………18
3.3 Кинетические уравнения, описывающие процессы дезактивации молекул в метастабильном состоянии………………………………..…………………..20 3.4 Обработка результатов………………………………………………………23 Заключение ………………………………………………………………………25
Библиографический список …………………………………………………….26
Введение
Фосфоресценция - это процесс, который может медленно высвобождать энергию фотовозбуждения после удаления источника возбуждения. Хотя комплексы переходных металлов и чистые органические материалы с фосфоресценцией при комнатной температуре демонстрируют превосходные свойства фосфоресценции, их применение для биоимиджинга ограничено из-за плохой растворимости в воде. Системы биоимиджинга являются усовершенствованной версией микроскопов с системой видеодокументирования, оснащённой программными модулями для регистрации и обработки изображения. Такое решение не требует от пользователя глубокого знания технических аспектов устройства микроскопа, что существенно упрощает жизнь исследователя.
Из-за проблем, возникающих непосредственно при проведении биоимиджинга следует, что затрудняется также и определение времени жизни зондов для выполнения разного рода исследований. Чтобы преодолеть эту проблему, фосфоресцирующие материалы модифицируют амфифильными или гидрофильными полимерами, чтобы придать им биосовместимость.
Данная работа посвящена обзору методов и техники определения времени жизни зондов фосфоресценции в метастабильных состояниях. Обсуждается фотофизический механизм и принципы проектирования комплексов переходных металлов и чистых органических материалов для стабилизации триплетного возбужденного состояния для усиления фосфоресценции. Обсуждаются текущие проблемы и перспективы для новых материалов и методов в области биоимиджинга.
Метастабильное состояние
В химии и физике метастабильность обозначает промежуточное энергетическое состояние внутри динамической системы, отличное от состояния системы с наименьшей энергией. Шар, покоящийся в углублении на склоне, является простым примером метастабильности (рис. 1). Если мяч только слегка толкнуть, он вернется в свое углубление, но более сильный толчок может привести к тому, что мяч покатится вниз по склону. Кегли для боулинга демонстрируют аналогичную метастабильность, либо просто покачиваясь на мгновение, либо полностью опрокидываясь. Распространенным примером метастабильности в науке является изомеризация. Изомеры с более высокой энергией долговечны, потому что им не позволяют перейти в предпочтительное основное состояние (возможно, большие) барьеры в потенциальной энергии.
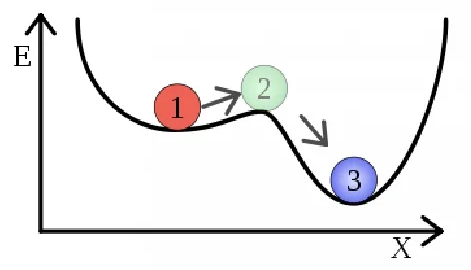
Рис. 1. Метастабильное состояние
Во время метастабильного состояния с конечным сроком службы все параметры, описывающие состояние, достигают и сохраняют стационарные значения. В изоляции:
Состояние наименьшей энергии - единственное, в котором система будет находиться в течение неопределенного периода времени, пока в систему не будет добавлено больше внешней энергии (уникальное "абсолютно стабильное" состояние);
Система самопроизвольно покинет любое другое состояние (с более высокой энергией), чтобы в конечном итоге вернуться (после последовательности переходов) в состояние с наименьшей энергией.
Концепция метастабильности возникла в физике фазовых переходов первого порядка. Затем он приобрел новое значение при изучении агрегированных субатомных частиц (в атомных ядрах или в атомах) или в молекулах, макромолекулах или кластерах атомов и молекул. Позже он был заимствован для изучения систем принятия решений и передачи информации.
Метастабильность широко распространена в физике и химии – от атома (сборки многих тел) до статистических ансамблей молекул (вязкие жидкости, аморфные твердые тела, жидкие кристаллы, минералы и т.д.). Обилие состояний становится более распространенным по мере роста систем и/или если силы их взаимодействия пространственно менее однородны или более разнообразны.
В динамических системах (с обратной связью), таких как электронные схемы, передача сигналов, системы принятия решений, нервные и иммунные системы, – неизменность во времени активных или реактивных паттернов по отношению к внешним воздействиям определяет стабильность и метастабильность. В этих системах эквивалентом тепловых колебаний в молекулярных системах является "белый шум", который влияет на распространение сигнала и принятие решений.
Зонды в фосфоресценции
Молекулярная визуализация может обеспечить визуализацию и характеристику различных физиологических или патологических процессов на клеточном и молекулярном уровне в живых организмах. [2] В сочетании с визуализирующими зондами и методами визуализации молекулярная визуализация сыграла решающую роль как в доклинических исследованиях, так и в клинических приложениях. Для примера, компьютерная томография (КТ) выполняет сканирование для получения трехмерных изображений тканей. Ультразвуковая (УЗИ) визуализация обнаруживает отраженную волну после прохождения высокочастотных звуковых волн через ткани тела, чтобы предоставить информацию; Магнитно-резонансная томография (МРТ) может быть получена путем определения времени релаксации атомов водорода или зондов для визуализации после регулирования в сильном магнитном поле.
Однако из-за относительно низкого пространственного и временного разрешения эти методы визуализации не всегда доступны для предоставления более подробной информации на молекулярном уровне. В этом отношении оптическая визуализация как неинвазивный и неионизирующий метод, обладает высоким пространственно-временным разрешением и чувствительностью и может визуализировать простые анатомические особенности, отображать специфические биологические молекулы и биомаркеры, что приводит к визуализации на молекулярном уровне.
На данный момент, существуют такие методы оптической визуализации, включая флуоресцентную визуализацию (FLI), фотоакустическую визуализацию (PAI) и фосфоресцентную визуализацию. Первые два метода (FLI и PAI) широко применяются в биоимиджинге и получили многочисленные положительные отзывы.
Согласно диаграмме Яблонского (рис 2.), существует три пути рассеивания энергии после возбуждения света, поглощенного оптическими зондами:
1) излучение флуоресценции;
2) межсистемное пересечение (ISC) в триплетное возбужденное состояние;
3) безызлучательная термическая дезактивация.
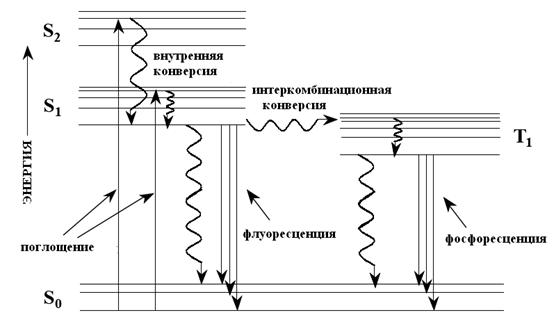
Рис. 2. Диаграмма Яблонского
Фосфоресценция происходит, когда создается триплетное возбужденное состояние, которое энергетически находится между основным состоянием и синглетным возбужденным состоянием. Этот процесс зависит от ISC, который связан с изменением спина из синглетно возбужденного состояния в триплетно-возбужденное состояние. Надежная спин-орбитальная связь или эффективное взаимодействие между отдельными молекулами крайне необходимы для получения разнообразной электронной конфигурации, которая приносит пользу для излучения фосфоресценции. В течение последних десятилетий разработка фосфоресцирующих материалов началась с исследований комплексов переходных металлов.
Сопряженные системы вводятся в качестве лигандов для создания обильных электронных характеристик и гетероатомов, таких как азот и сера, добавленные в конъюгаты, помогают точно настроить фотофизические свойства. Эти комплексы имеют тенденцию образовывать триплетные возбужденные состояния посредством переноса заряда металл-лиганд (MLCT), которые, как сообщалось, демонстрируют отличные свойства фосфоресценции. [3] Богатые электронами и сильно связанные энергетические уровни комплексов переходных металлов приводят к тому, что эффективные ISC создают триплетные экситоны, излучающие фосфоресценцию. Свойство фосфоресценции комплексов переходных металлов может быть дополнительно улучшено путем модификации. В ходе исследования по улучшению лиганда подтверждено, что циклометаллированные комплексы с сопряженными основными лигандами и вспомогательными лигандами являются прикладными материалами для фосфоресцентной визуализации.
Помимо комплексных фосфоресцирующих материалов с переходными металлами, в последние годы также сообщалось о чистых органических материалах с фосфоресценцией при комнатной температуре. Органические соединения впервые были зарегистрированы в 1930-х годах для случайного обнаружения в смеси, в то время как о чистых органических материалах неоднократно сообщалось в 1960-1970-х годах. В последнее время исследователи сосредоточены на структурном проектировании и модификации соединений для улучшения свойств фосфоресценции. [4]
Время жизни фосфоресценции
Изображение времени жизни фосфоресценции (PLIM) аналогично изображению продолжительности жизни флуоресценции, только оно отображает фосфоресценцию образца и, следовательно, охватывает временные диапазоны до миллисекунд. Аналогично изображению жизни флуоресценции, контраст в изображении PILM основан на времени жизни отдельных флуорофоров, а не на спектрах их излучения. Время жизни фосфоресценции определяется как среднее время, в течение которого молекула остается в возбужденном состоянии до возвращения в основное состояние путем испускания фотона.
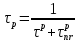 (1) (1)
PLIM, как характеристика фосфоресцирующих соединений, в течение многих лет имела большое значение в области материаловедения, а именно химического зондирования, и в последнее десятилетие возобновила свой интерес благодаря быстрому развитию технологии органических светодиодов (OLED). [5] Другие типичные образцы включают ионы металлов в комплексе с органическими лигандами, которые могут быть использованы, например, для изображения потребления кислорода в живых клетках.
Поскольку переход из триплета в основное состояние квантово-механически запрещен, время жизни триплетного состояния обычно больше по сравнению со временем жизни флуоресценции. Следовательно, время жизни фосфоресценции может быть хорошим показателем микроокружения фосфоресцирующего красителя. Одним из факторов, влияющих на фосфоресценцию, является кислород, который может сильно снизить его интенсивность и сократить срок службы. Таким образом, измерения фосфоресценции могут быть важны для оценки кислородного статуса живых клеток и т.д. [6]
Техники определения времени жизни
Для определения времени жизни фосфоресценции используется многоканальное масштабирование (MCS) или коррелированный по времени подсчет одиночных фотонов (TCSPC) с возможностью многократной остановки. В обоих случаях измеряется время между возбуждением образца импульсным лазером и поступлением испускаемого фотона на детектор. Методы требуют определенного “запуска”, обеспечиваемого электроникой, управляющей лазерным импульсом или фотодиодом, и определенного сигнала “остановки”, реализуемого путем обнаружения с помощью чувствительных к однофотонам детекторов (например, однофотонных лавинных диодов (SPADs) или фотоумножителей (PMTS)). Измерение этой временной задержки повторяется много раз, чтобы учесть статистический характер излучения флуорофоров. Времена задержки сортируются в гистограмму, которая отображает возникновение излучения с течением времени после импульса возбуждения.
Чтобы получить изображение времени жизни фосфоресценции, фотоны должны быть отнесены к разным пикселям, что делается путем сохранения абсолютного времени прихода фотонов в дополнение к относительному времени прихода относительно лазерного импульса. Сигналы маркеров линий и кадров со сканера конфокального микроскопа дополнительно записываются для сортировки временного потока фотонов по разным пикселям.
В отличие от изображения времени жизни флуоресценции на основе кореллированного по времени подсчета одиночных фотонов, изображение времени жизни фосфоресценции обычно может эффективно выполняться с помощью сканеров для соединений со временем жизни до нескольких мкс только благодаря их высокой скорости сканирования, которая ограничивает время задержки на пиксель. Если время выдержки меньше времени, необходимого для полного затухания фосфоресценции, фотоны будут отсортированы в неправильные пиксели, что приведет к искажению изображений. Поэтому PLIM лучше всего выполнять с помощью пьезосканирующих устройств, которые обеспечивают более низкую скорость сканирования, чем сканеры galvo. Поскольку идеальное время пребывания пикселя в 50-100 раз превышает время жизни люминесценции, измерения на красителях с медленной фосфоресценцией могут занять очень много времени.
Таким образом, основными компонентами системы PLIM являются:
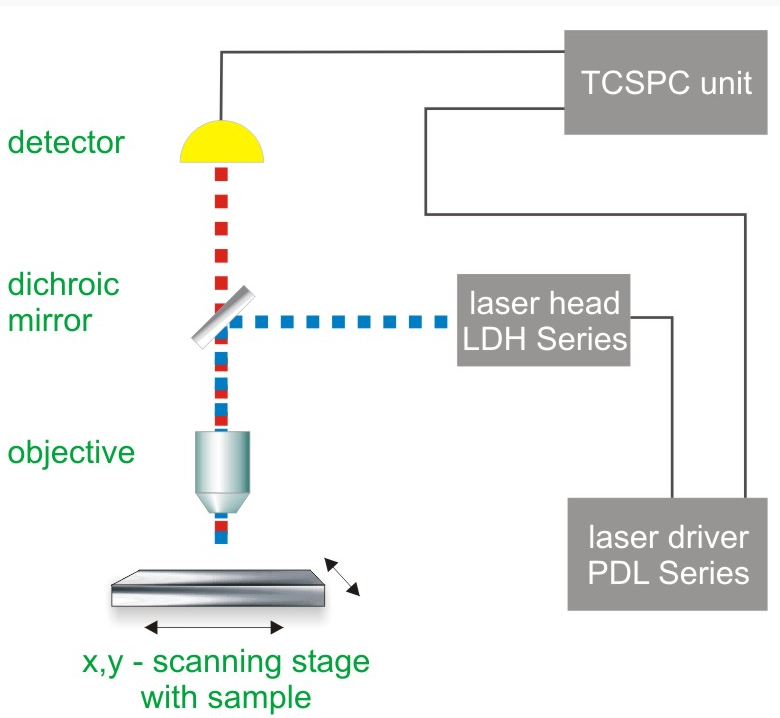
Рис. 3. PLIM для измерения времени жизни флуоресценции
- импульсный лазерный источник - для компонентов со временем жизни > 1 мкс рекомендуется возбуждение с использованием последовательностей импульсов для повышения эффективности возбуждения
- однофотонный чувствительный детектор
- дихроичное зеркало (для отделения сигнала фосфоресценции от света возбуждения)
- объектив (для фокусировки света возбуждения на образце и сбора сигнала фосфоресценции)
- Блок MCS или TCSPC с возможностью многократной остановки для измерения времени между возбуждением и излучением фосфоресценции
Измерение люминесценции с длительным временем жизни с помощью лазерных сканирующих систем сталкивается с рядом проблем. Первый связан с возбуждением люминофора. Очевидно, что период лазерного импульса должен быть больше, чем время жизни люминесценции. Время жизни комплексов, например, рутения находится в нижнем диапазоне; для комплексов лантаноидов с европием и тербием в качестве центрального иона оно может находиться в диапазоне миллисекунд. (FLIM) с использованием этих красителей требует частоты повторения лазера не более 100 кГц или 100 Гц соответственно. Генерирование таких низких частот повторения с помощью импульсного лазерного сканирующего микроскопа может быть проблемой. Как правило, коммерческие микроскопы оснащены пикосекундными или фемтосекундными лазерами с частотой повторения десятков МГц. Чтобы уменьшить частоту их повторения, потребуется установить акустооптические или электрооптические модуляторы снаружи или выполнить сброс внутри резонатора. Для этого потребуется высоковольтная электроника, что приведет к усложнению и высокой стоимости системы.
Что еще более важно, уменьшение частоты повторения при заданной мощности импульса также приводит к снижению средней мощности возбуждения. Попытки компенсировать падение средней мощности более высокой мощностью импульса ограничены возможностями лазера, а также нелинейными эффектами или даже ионизацией в образцах. Более того, любой образец, который излучает фосфоресценцию, обязательно также излучает флуоресценцию. Поскольку флуоресценция происходит быстро, пиковая мощность флуоресценции становится очень высокой. Это вызывает эффекты временной перегрузки в детекторах, препятствующие обнаружению фосфоресценции в первые микросекунды после лазерного импульса. Поэтому лучшим способом получения более высокой средней мощности может быть использование большей длительности лазерного импульса.
К сожалению, для большинства лазеров это нелегко сделать. Более того, большая ширина лазерного импульса несовместима с многофотонным возбуждением.
Вторая проблема связана со сканированием. Время, в течение которого сканер остается в пределах объема возбужденного образца, должно превышать время жизни люминесценции. Если сканер выключится, то возбужденный объем во время затухания люминесценции, фотоны в хвосте функции затухания будут потеряны, и записанный профиль затухания будет искажен. Таким образом, адекватная запись, даже изображений с чистой интенсивностью, может быть получена только при очень медленном сканировании.
Третья проблема заключается в согласовании частоты повторения лазера с частотой пикселей: если в течение времени пребывания пикселя имеется всего несколько импульсов возбуждения, количество импульсов возбуждения в пикселях систематически меняется. Это вызывает муаровые эффекты на изображениях. [7] Проблема может быть решена путем синхронизации лазерных импульсов и частоты пикселей, но обычно, в обычном лазерном сканирующем микроскопе это не предусмотрено. Без синхронизации время пребывания пикселя должно быть как минимум в 100 раз больше, чем период работы лазера. Это приводит к недопустимо длительному времени получения изображения. Конечно, проблем со сканером можно избежать, используя широкополосное возбуждение и обнаружение с помощью камеры со стробированием. Однако технология камеры страдает от общих недостатков широкополосной съемки: рассеянный свет обнаруживается от всех пикселей, а не только от одного, и нет присущего разрешения по глубине. Разрешение по глубине может быть получено с помощью методов структурного освещения, но это приводит к снижению эффективности системы. [8]
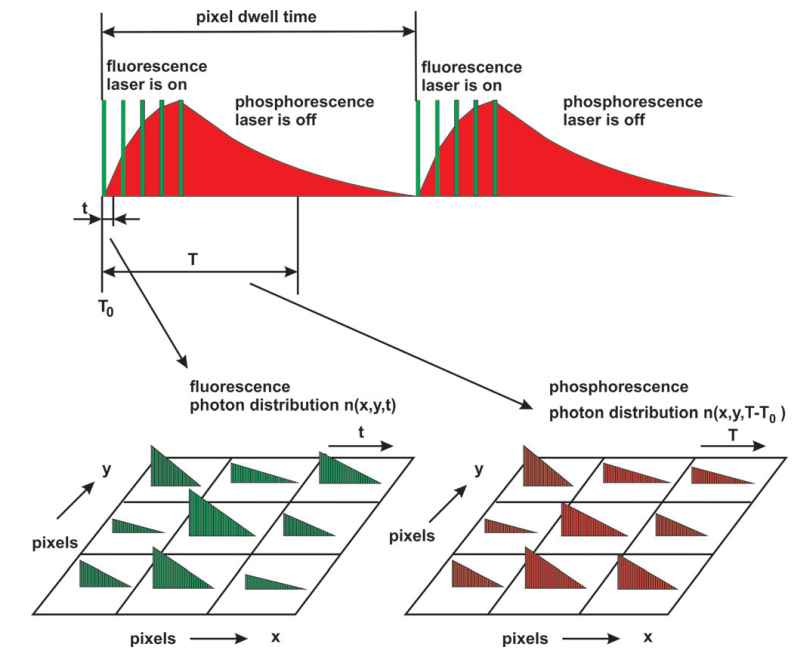
Рис 4.Принцип одновременной визуализации флуоресценции и фосфоресценции в течение всего времени жизни. Времена фотонов определяются как отношение периода лазерного импульса к относительному периоду лазерной модуляции
Описанные выше проблемы устраняются с помощью принципа возбуждения, показанного на рис. 4. Используется высокочастотный импульсный лазер. Однако лазер не работает непрерывно. Вместо этого он включается только на короткий промежуток времени в начало каждого пикселя. В течение оставшегося времени пребывания пикселя лазер выключен. В течение времени включения лазер возбуждает флуоресценцию и создает фосфоресценцию. В течение оставшегося времени пребывания пикселя получается чистая фосфоресценция.
Изображения в режиме реального времени создаются с использованием двойных кинетических функций модулей подсчета одиночных фотонов (SPC). [9] Принцип показан в нижней части рис. 4. Для каждого фотона модуль SPC определяет время t в течение периода лазерного импульса и время T-T0 после начала модуляционный импульс. Изображение времени жизни флуоресценции получается путем построения распределения фотонов по “микро временам”, t, фотонов и положения сканера, x, y, во время периодов включения лазера. Изображение времени жизни фосфоресценции получается путем построения распределения по разностям времени T-T0 между временами фотонов T и фронтами импульсов “лазер включен” T0. Пространственные координаты исходят из положения сканера в момент обнаружения фотона. Таким образом, изображения продолжительности жизни флуоресценции и фосфоресценции получаются одновременно, в одном и том же сканировании, и из фотонов возбуждается теми же лазерными импульсами. Многоволновая работа возможна благодаря использованию возможностей маршрутизации (или мультидетектора) модулей счета одиночных фотонов. В этом случае фотоны дополнительно помечаются каналом с длиной волны, в котором они были обнаружены. Затем создаются индивидуальные изображения продолжительности жизни флуоресценции и фосфоресценции для отдельных каналов длины волны.
Экспериментальная часть. Устройство люминесцентного спектрометра Perkin Elmer LS 55
Прибор предназначен для регистрации стационарных спектров флуоресценции образцов в различных агрегатных состояниях. Люминесцентный спектрометр LS 55 (рис. 5) может работать в одном из четырех режимов – флуоресценция, фосфоресценция, хеми- и биолюминесценция. В комплектующие прибора входят следующие приставки: устройство быстрой смены фильтра, приставка для исследования люминесценции твердых и жидких образцов, поляризаторы.

Рис.5. Люминесцентного спектрометра Perkin Elmer LS 55.
Технические характеристики:
Однолучевой люминесцентный спектрометр, работающий в режимах флуоресценции, фосфоресценции, хеми- или биолюминесценции;
Монохроматоры типа Монка-Джиллисона;
Диапазон длинны волны - возбуждение 200 - 800 нм, эмиссия: 200 - 900 нм;
Спектральная линия щели – возбуждение 2,5 - 15 нм, эмиссия 2,5 - 30 нм;
Скорость сканирования 10 - 1500 нм/мин;
Эмиссионные фильтры 290, 350, 390, 430, 515 нм;
Точность установки длины волны ± 1 нм;
Воспроизводимость установки длины волны ± 0.5 нм;
Источник 150 Вт ксеноновая лампа, работающая в пульсирующем режиме с частотой 50 Гц;
4-позиционный термостатируемый держатель кювет с перемешиванием;
Управление осуществляется с персонального компьютера с помощью программы FL WinLab
Области применений люминесцентного спектрометра LS 55:
Клеточная биология: цитотоксичность, жизнеспособность, пролиферация, злокачественное перерождение, подсчет и адгезия клеток, репликация генов, экспрессия генов и т.д.
Клинические анализы: энзимология, анализ порфиринов, стероидов, анализ крови
Фармацевтика: определение витаминов, биологически активных соединений, наркопрепаратов, продуктов метаболизма, токсичности фармпрепаратов
Неорганический анализ: определение Al, Pb, Zn, Mg, Mn, Se, Sn, U и др.
Молекулярная биология: определение ДНК, структуры и функции мембран, экспрессии генов, активности ферментов, превращения белков, определение продуктов ПЦР
Промышленность: анализ конструкционных материалов, анализ стабилизаторов и добавок в полимерах, анализ деталей LCD и TFT дисплеев и т.д.
Оптическая схема
Оптическая схема прибора показана на рисунке (6) Источником возбуждения служит ксеноновая лампа, работающая в пульсирующем режиме с частотой 50-60 Гц. Излучение фокусируется эллиптическим зеркалом и отражается торическим зеркалом на входную щель монохроматора возбуждения. Монохроматор состоит из входной щели, дифракционной решетки (1440 линий/мм), сферического зеркала и выходной щели. Из выходной щели выходит узкий интервал длин волн с центром, определяемым установками решетки. Большая часть излучения попадает в область образца через фокусирующее торическое зеркало, и небольшая часть отражается.
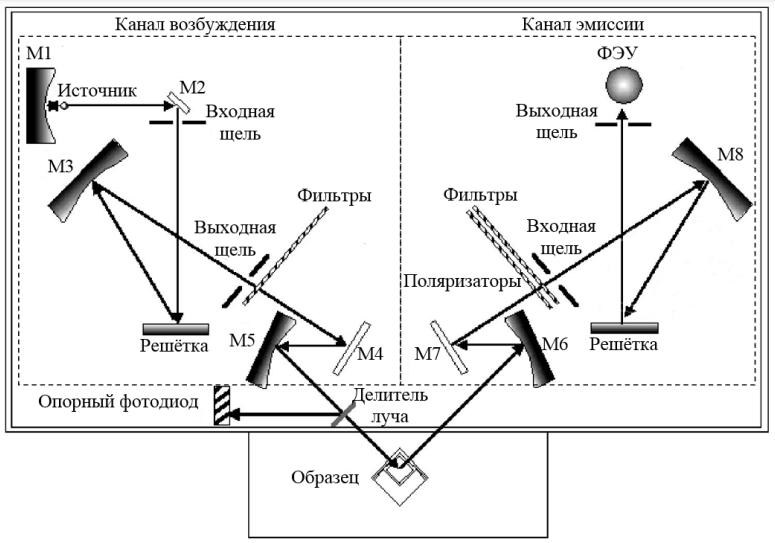
Рис. 6. Оптическая схема люминесцентного спектрометра Perkin Elmer LS 55. M1 – эллиптическое зеркало; M2, M5, M6 – тороидальные зеркала; M3, M8 – сферические зеркала; M4, M7 – плоские зеркала
Энергия, излучаемая образцом, фокусируется торическим зеркалом на входную щель эмиссионного монохроматора. Он состоит из входной щели, сферического зеркала, дифракционной решетки (1200 линий/мм) и выходной щели. Из выходной щели выходит узкий интервал длин волн с центром, определяемым установками решетки.
Спектральные диапазоны монохроматоров следующие:
Монохроматор возбуждения: 200–800 нм
Эмиссионный монохроматор: 200–900 нм
Ширины щелей можно варьировать для получения разрешения в диапазоне 2.5–15 нм для монохроматора возбуждения и 2.5–30 для эмиссионного монохроматора с шагом 0.1 нм.
Кинетические уравнения, описывающие процессы дезактивации молекул в метастабильном состоянии
Интенсивность фосфоресценции пропорциональна концентрации [T] триплетных молекул. При незначительной концентрации люминофоров, когда концентрационным тушением люминесценции можно пренебречь, скорость их дезактивации после прекращения возбуждения определяется выражением:

|
(2)
|
где k – суммарная константа скорости мономолекулярных и псевдо - мономолекулярных (тушение примесями) процессов дезактивации энергии триплетных молекул, γ - бимолекулярная константа скорости дезактивации триплетных молекул.
При импульсном возбуждении после прекращения возбуждающего импульса получается уравнение процесса первого порядка, решение которого имеет вид экспоненты. Интенсивность фосфоресценции после прекращения возбуждения спадает со временем по экспоненциальному закону:
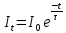
|
(3)
|
где It — интенсивность свечения в момент времени t; I0 — интенсивность свечения в момент прекращения возбуждения люминесценции, τ— длительность люминесценции (среднее время жизни возбужденного состояния):
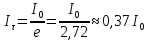
|
(4)
|
Таким образом, при экспоненциальном затухании люминесценции весь ход процесса свечения определяется величиной τ, временем, в течение которого интенсивность фосфоресценции уменьшается в ℮ раз.
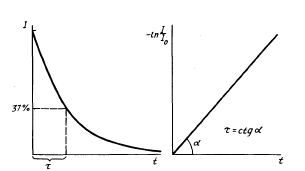
Рис. 7. Типичная осциллограмма дезактивации триплетных молекул эозина, зарегистрированная по затуханию его фосфоресценции
По полученным зависимостям относительной интенсивности фосфоресценции эозина от времени после импульсного фото возбуждения раствора, определена константа скорости затухания фосфоресценции зонда.
Если триплетные молекулы дезактивируются, в основном, в результате реакции первого порядка, т.е. k >> γ [T], то уравнение, описывающее процесс дезактивации энергии триплетных молекул упрощается:
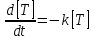
|
(5)
|
Решая уравнение относительно [T], получим:
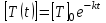
|
(6)
|
Для интенсивности фосфоресценции известно следующее выражение
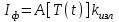
|
(7)
|
откуда
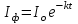 , ,
|
(8)
|
где Iф – интенсивность фосфоресценции в момент времени t, А – аппаратная функция спектрофлуориметра, kизл – константа скорости затухания фосфоресценции зонда, [T]0 – концентрация триплетных молекул в начальный момент времени, I0 –интенсивность фосфоресценции в начальный момент времени, k – константа скорости дезактивации триплетных состояний зонда, t – время.
Таким образом, аппроксимация экспериментальных данных в координатах 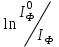 от t, позволяет определить суммарную мономолекулярную константу скорости дезактивации триплетных молекул (k) по кинетике затухания фосфоресценции и получить значения времени жизни триплетных состояний зонда согласно соотношению τ = 1/k. от t, позволяет определить суммарную мономолекулярную константу скорости дезактивации триплетных молекул (k) по кинетике затухания фосфоресценции и получить значения времени жизни триплетных состояний зонда согласно соотношению τ = 1/k.
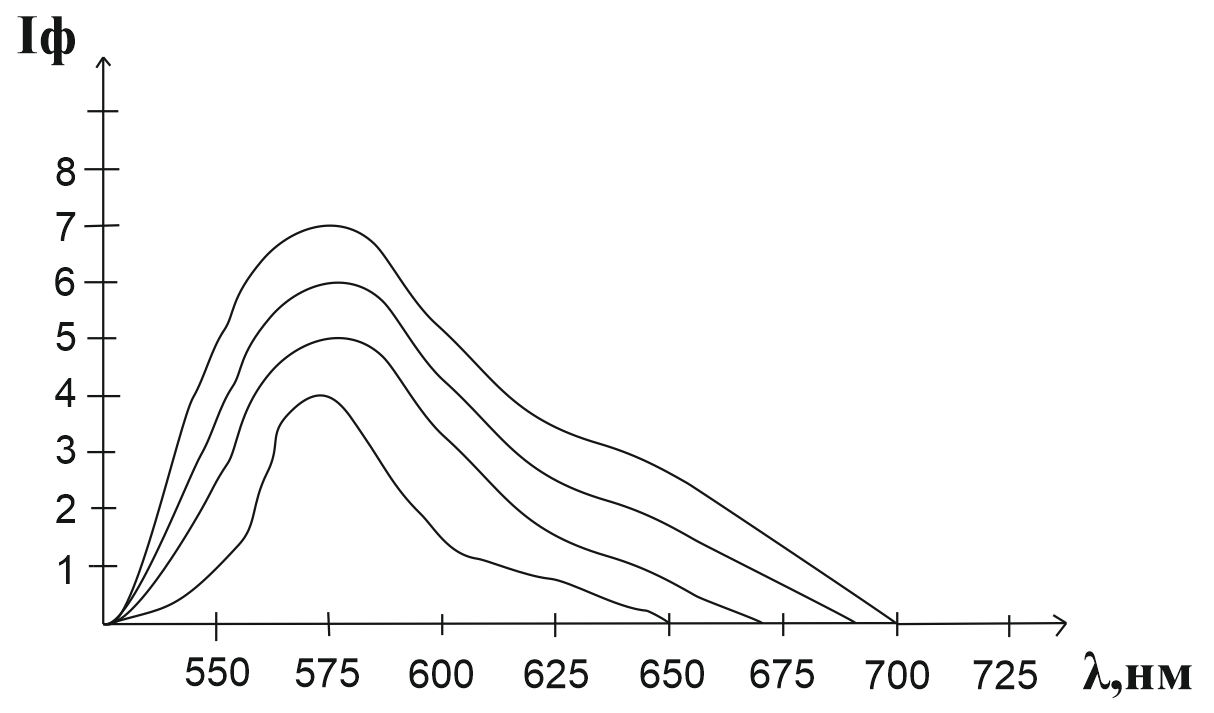
Рис. 8. Типичное представление зависимости интенсивности фосфоресценции от длины волны
Обработка результатов
Вводим снятые экспериментальные данные в таблицу:
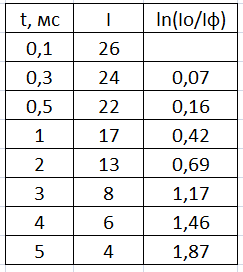
Рис. 9. Полученные экспериментальные данные
По полученным спектрам строим график зависимости интенсивности фосфоресценции от времени после вспышки для эозина:
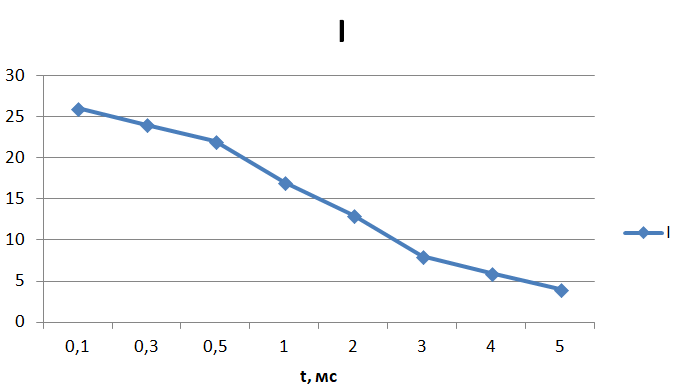
Рис. 10. График зависимости интенсивности фосфоресценции от времени после вспышки
Далее строим график зависимости ln(Iзф/I₀) от t:
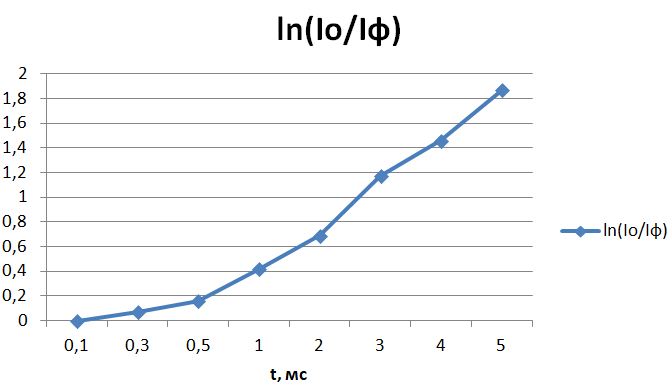
Рис. 11. График зависимости ln(Iзф/I₀) от t
По данному графику определяем значение времени жизни τ. Сначала находим k:
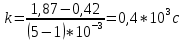 (9) (9)
Затем, определяем непосредственно время жизни:
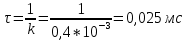 (10) (10)
Заключение
В заключение, описанные в данной работе методы одновременной записи изображения времени жизни флуоресценции и фосфоресценции, производится в системах конфокального лазерного сканирования. Это устраняет необходимость использования датчика импульсов для уменьшения частоты следования импульсов и позволяет избежать чрезмерно высокой мощности импульсов при низкой скорости возбуждения.
Работы в данном направлении достаточно перспективны по ряду причин. Потенциальными областями применения фосфоресцентных зондов в метастабильном состоянии достаточно широки: могут быть произведены измерения концентрации кислорода с одновременным мониторингом клеточного метаболизма с помощью сигналов автофлуоресценции, идентификацией наночастиц солнцезащитных кремов и косметических средств в коже и наблюдением за возможной миграцией этих частиц в глубокие слои кожи или внутренние органы.
Изучена также возможность применения люминесцентно-кинетической зондовой методики для исследования структурных изменений бычьего сывороточного альбумина (БСА) при неферментативном термическом гликировании. С возрастанием времени гликирования наблюдались уменьшение интенсивности и длинноволновое смещение максимума флуоресценции зонда — эозина, а также возрастание интенсивности его фосфоресценции, что свидетельствует о связывании эозина с гидрофобными участками белка для любого времени инкубации раствора БСА с глюкозой. По уменьшению константы скорости триплет-триплетного переноса энергии между донором (эозином) и акцептором (антраценом), связанным с белками, установлено, что наблюдаемые изменения спектральных характеристик эозина обусловлены структурными изменениями в глобулах альбумина в результате гликирования. [10]
Библиографический список
1) Xu Zhena, Rui Qua, Weizhi Chena, Wei Wua and Xiqun Jianga, Development of phosphorescent probes for in vitro and in vivo bioimaging, 2021.
2) W. Chen, X. Zhen, W. Wu and X. Jiang, Science China Chemistry, 2020.
3) L. Liu, X. Wang, N. Wang, T. Peng and S. Wang, Angew. Chem. Int. Ed., 2017, 56, 9160-9164.
4) Kenry, C. Chen and B. Liu, Nat. Commun., 2019, 10, 2111.
5) J. Yang, Q. Cao, H. Zhang, L. Hao, D. Zhou, Z. Gan, Z. Li, Y. X. Tong, L. N. Ji and Z. W. Mao, Biomaterials, 2018, 176, 94- 105.
6) Shcheslavskiy, V. & Neubauer, Antje & Bukowiecki, R. & Dinter, Franziska & Becker, Wolfgang. (2016). Combined fluorescence and phosphorescence lifetime imaging. Applied Physics Letters. 108. 091111. 10.1063/1.4943265.
7) J. Pawley, Handbook of Biological Confocal Microscopy (Springer, 2006)
8) M. Cole, J. Siegel, S. Webb, R. Jones, K. Dowling, P. French, M. Lever, L. Sucharov, M. Neil, R. Juskaitis, and T. Wilson, Opt. Lett. 25, 1361 (2000).
9) W. Becker, Advanced Time-Correlated Single Photon Counting Techniques (Springer, 2005).
10) А. Б. Правдин, В. И. Кочубей, А. Г. Мельников, ФОСФОРЕСЦЕНТНЫЙ ЗОНД ЭОЗИН, В ИССЛЕДОВАНИИ СТРУКТУРНЫХ ИЗМЕНЕНИЙ В ГЛИКИРОВАННЫХ БЕЛКАХ, ОПТИКА И СПЕКТРОСКОПИЯ, 2010, том 109, № 2, с. 222-225.
|
|
|
 Скачать 0.91 Mb.
Скачать 0.91 Mb.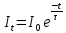
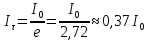

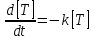
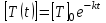
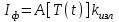
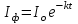 ,
,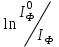 от t, позволяет определить суммарную мономолекулярную константу скорости дезактивации триплетных молекул (k) по кинетике затухания фосфоресценции и получить значения времени жизни триплетных состояний зонда согласно соотношению τ = 1/k.
от t, позволяет определить суммарную мономолекулярную константу скорости дезактивации триплетных молекул (k) по кинетике затухания фосфоресценции и получить значения времени жизни триплетных состояний зонда согласно соотношению τ = 1/k.



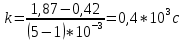 (9)
(9)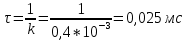 (10)
(10)


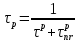 (1)
(1)


