Методические рекомендации по организации и проведению практических работ по учебной дисциплине Теория горения и взрыва по специальности 20. 02. 02 Защита в чрезвычайных ситуациях
 Скачать 360.5 Kb. Скачать 360.5 Kb.
|
|
Тема 1.2 Распространение горения газов, жидкостей и твердых тел Практическая работа №3 (2ч) Тема: Расчет объема и состава продуктов горения Цель работы: научиться производить расчеты объема и состава продуктов горения Все горючие вещества разделены на три типа: индивидуальные, сложные, смеси горючих газов Таблица 1.
Практический (полный) объём продуктов горения состоит из теоретического объёма продуктов горения и избытка воздуха или Состав продуктов горения, т.е. содержание i-го компонента определяется по формуле где Пример 1. Определить объём продуктов горения при сгорании 1 кг фенола, если температура горения 1200 К, давление 95000 Па, коэффициент избытка воздуха 1,5. Решение. Горючее -индивидуальное химическое соединение(формула 2). Запишем уравнение химической реакции горения C6H5OH+ Молекулярная масса горючего 98. Теоретический объём продуктов горения при нормальных условиях Практический объём воздуха при нормальных условиях Объём продуктов горения при заданных условиях Пример 2. Определить состав продуктов горения метилэтилкетона. Решение. При такой постановки задачи рационально определить непосредственно из уравнения горения объём продуктов в кмолях, выделившихся при сгорании 1 кмоля горючего По формуле (11) находим состав продуктов горения Ход работы: 1. Решите задачи по вариантам: Определить объем продуктов горения при сгорании 1 кг заданного вещества, если тепература горения ... К, давление ... мм рт.ст., = ... .
2. Решите задачи по вариантам: Определить объем и состав (% об.) продуктов горения, выделившихся при сгорании 1 м3 горючего газа, если температура горения составила ... К, давление ... мм рт.ст.
Тема 1.3. Прекращение и предотвращение процессов горения. Практическая работа №4(2ч) Тема: Расчет температурных пределов распространение пламени (воспламенения) Цель работы: научиться рассчитывать концентрационные и температурные пределы распространения пламени Ход работы: Расчетный метод применяют для ориентировочного нахождения предполагаемых ТПР перед началом их экспериментального определения, а так же для расчета безопасных режимов работы технологического оборудования на стадии проектирования. ВКПВ и НКПВ можно определить по эмпирической зависимости КПВ от количества молекул кислорода, необходимых для полного окисления молекул горючего: Сн (в) = 100 / а* · n* + b* (1) , где n* - число молекул кислорода в уравнении горения; а* и b* - постоянные Таблица 1. Значения постоянных а* и b*
Пример 1. Определить концентрационные и температурные пределы воспламенения ацетона. Решение: 1. Запишем термохимическое уравнение горения метана: С3Н6О + 4О 2 + 4 ·3,76 N 2 = 3СО2 + 3Н2О + 4 · 3,76 N 2 По таблице 1 определяем значения констант для НКПВ и ВКПВ. НКПВ: а* = 8,684, b* = 4,679. ВКПВ: а* = 1,55, b* = 0,56 2. Используя формулу (1) и таблицу 1, записываем: Сн = 100 / 8,684 ·4 + 4,679 = 2,54%, Св = 100 / 1,55 ·4 + 0,56 = 14,8% 3. Находим давление насыщенных паров жидкости, соответствующее НКПВ и ВКПВ: Рн.п. = 2,5 · 101325 / 100 = 2533,1 Па Рв.п. = 14,8 · 101325 / 100 = 14996,1 Па По таблице Приложения 1 определяем, что НКПВ ацетона находится между температурами 241,9 и 252,2 К при давлении Рmax = 2666,4Па и Рmin = 1333,2Па, а верхний - между 280,7 и 295,7 К при давлении Рmax = 26664 Па и Рmin = 13332,3Па4. Методом линейной интерполяции определяем НКПВ и ВКПВ: Тн = Тmin + (Тmax - Тmin) · (Рн - Рmin) / (Рmax - Рmin) = 241,9 + (252,2 - 241,9) · (2533,1 - 1333,2) / (2666,4 - 1333,3) = 251К Тв = Тmin + (Тmax - Тmin) · (Рв - Рmin) / (Рmax - Рmin) = 280,7 + (295,7 - 280,7) · (14996,1 - 13332,3) / (26664 - 13332,3) = 283К Ход работы: Задача 1. Определите концентрационные и температурные пределы воспламенения вещества при атмосферном давлении 101325Па
Практическая работа №5 (1ч) Тема: Расчет теплоты сгорания веществ Цель работы: Усвоить основные понятия энергетического баланса процессов горения. Научиться делать расчет теплоты сгорания для разного типа горючего вещества (индивидуальные вещества, сложные вещества, газы) При расчетах теплового баланса на пожаре определяют, как правило, низшую теплоту сгорания(табл.1): Таблица 1.
Пример №1Определить низшую теплоту сгорания уксусной кислоты, если теплота ее образования 485,6 кДж/моль; Решение: Для расчета по формуле (1) запишем уравнение горения уксусной кислоты в кислороде: СН3СООН+2О2=2СО2+2Н2О; QH=(2∙396,9+2∙242,2-1∙485,6)=792,6 кДж/моль=792,6∙103 кДж/моль; Для расчета количества тепла, выделяющегося при горении 1кг горючего, необходимо полученную величину разделить на его молекулярную масса (64): QH=792,6∙103/64=12384кДж/кг. Пример №2 Рассчитать низшую теплоту сгорания органической массы состава: С-62%, Н-8%, О-28%, S-2%. Решение: По формуле Д.И.Менделеева (2) QH=339,4∙62+1257∙8-108,9(28-2)-25,1∙9∙8=26460кДж/кг. Пример №3 Определить низшую теплоту сгорания газовой смеси, состоящей из СН4-40%, С4Н10-20%, О2-15%, Н2S-5%, NH3-10%, CO2-10% Решение: Для каждого горючего компонента смеси по формуле (2) находим теплоты сгорания (табл.2) Таблица 2
По формуле (3) определим теплоту сгорания газовой смеси: QH=1/100∙(547.8∙40+2666,1∙20+338,6∙5+317,2∙10)103=1020∙103 кДж/кг. Для определения теплоты сгорания 1м3газовой смеси необходимо полученное значение разделить на объем, занимаемый 1 Кмолем газа при стандартных условиях(24,4м3): QH=1020∙10 3/24,4=41803 кДж/кг. Контрольные задачи 1. Определить низшую теплоту сгорания 1м3этана, пропана, пентана, гексана. Теплоты образования горючих веществ: этан-88,4кДж/моль, пропан-109,4 кДж/моль,бутан-132,4 кДж/моль,пентан-184,4 кДж/моль,гексан-211,2 кДж/моль. 2. Определить низшую теплоту сгорания древесины состава: С-49%, Н-8%, О-43%. 3. Определить низшую теплоту сгорания, при горении газовой смеси состава: СО-15%, С4Н8-40%, О2-20%, Н2-14%, СО2-11%/ Теплота образования для: углекислого газа - 393,51 кДж/моль ; для воды (г) -241,8 кДж/моль Теплота образования горючего: С4Н8 - 0,13 кДж/моль; Н2 - 285,8 кДж/моль ; СО - 110,52 кДж/моль Практическая работа №6 (2ч) Тема: Расчет температуры горения. Цель работы: Изучить вещества с различной температурой горения. Уметь применять уравнение теплового баланса для определения температуры горения различных веществ. Рассчитать действительную температуру горения фенола (∆Нобр=4,2 кДж/моль), если потери тепла излучением составили 25%от Qн, а коэффициент избытка воздуха при горении-2,2 Решение: 1. Определим состав продуктов горения: С6Н5ОН+7О2+7∙3,76N2= 6СО2 + 3Н2О + 7 · 3,76 N 2 V co2 =6 моль, VН 2О=3 моля, VN2=26,32моля, ∆Vв=(7+7∙3,76)(2,2-1)=39,98моля, VПr= 39,98 + 6 + 3 +26,32 = 75,3моля. 2. Определим низшую теплоту сгорания фенола: Qн=6∙393,51+3∙242,2-1∙4,2=3083,5 кДж/моль; 3. Так как по условию задачи 25% тепла теряется, то определим количество тепла , пошедшее на нагрев продуктов горения (теплосодержание продуктов горения при температуре горения)(формула Qпr= QH(1-a) Q пr=3083,5(1-0,25)=2312,6 кДж/моль 4. По формуле определим действительную температуру горения: Т где Срi - теплоемкость i-го продукта горения (Двуокись углерода - 50,85∙10-3 ; Двуокись серы - 51,07∙10-3 ; Вода (пар) - 39,87∙10-3 ; Азот - 31,81∙10-3 ; Воздух - 32,26∙10-3 ) Тr=273+2312,6/10-3∙(50,85∙6+39,87∙3+31,81∙26,32+32,26∙39,98) =1302К. Решите задачу: Рассчитать действительную температуру горения вещества метана, этана, пропана , бутана, пентана, гексана, бензола (∆Нобр= ), если потери тепла излучением составили %от Qн, а коэффициент избытка воздуха при горении - a Раздел 2. Взрывные процессы Тема 2.1. Формы взрывчатых превращений Практическая работа №7 (2ч) Расчет избыточного давления при взрыве газопаровоздушных, пылевоздушных, газовоздушных смесей и конденсированных взрывчатых веществ. Решение задач Цель работы: научиться рассчитывать избыточное давление при взрыве сжиженного газа и оценивать степень разрушения при действии ударной волны Пример. Произошел взрыв облака ГВС, образованного при разрушении резервуара с 106 кг сжиженного пропана. Определить давление воздушной ударной волны на расстоянии г- 200 м. Решение: 1. Определяем радиус зоны детонации но формуле: 2. Определяем отношение расстояния от центра взрыва до рассматриваемого здания к радиусу детонационной волны: по табл. П7 приложения путем интерполяции получаем ∆Рф = 400 кПа. Полученные параметры воздушной ударной волны анализируются и наносятся на схему возможной обстановки при возникновении ЧС. Ход работы: 1.Решить задачу по вариантам. Задача. Произошел взрыв облака ГВС, образованного при разрушении резервуара с m кг сжиженного газа. Определить давление воздушной ударной волны на расстоянии г. Исходные данные брать из табл. П6 приложения. Пользоваться таблицей П7 приложения. 2. После расчетов оцените степень разрушений при данном избыточном давлении фронта ударной волны. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

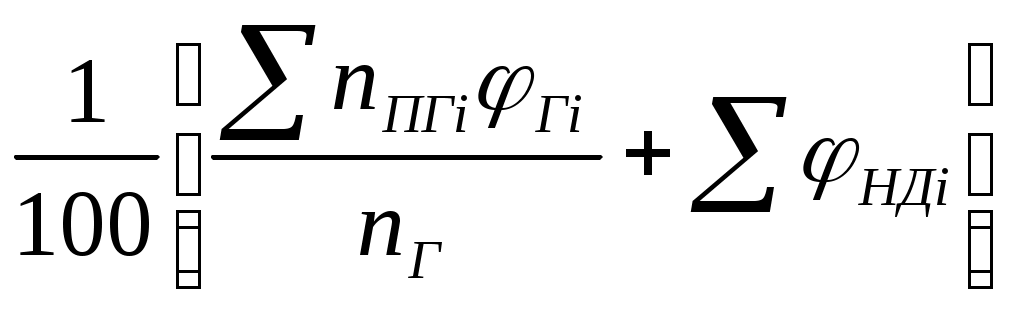 (8)
(8)