Исследование фекалий и их клиническое значение. Методические указания Екатеринбург, 2007 ббк 48р У745 удк 591Л49. 1 Исследование фекалий и их клиническое значение
 Скачать 6.56 Mb. Скачать 6.56 Mb.
|
|
Методика Элементы, отделяемые стенкой кишечника (слизь, эритроциты, лейкоциты, эпителиальные клетки и др.), определяют также микроскопически, при этом их лучше обнаруживают в слизи. Для их определения слизь ополаскивают в изотоническом растворе NaCl и готовят препараты. Микроскопически слизь представлена в виде гомогенной прозрачной массы или тяжей, в которых заложены различные форменные элементы (лейкоциты, эпителий и др.) Большое количество слизи является признаком воспалительного процесса слизистой оболочки кишечника. Клетки кишечника эпителия во многих случаях находят вкрапленными в комочки слизи. В большом количестве их обнаруживают при воспалении слизистой оболочки кишечника. Кристаллические образования, в частности кристаллы триппельфосфатов, напоминающие по форме «гробовые крышки», встречают при усилении гнилостных процессов в кишечнике. Щавелевоуксусный кальций в виде октаэдров, похожих на почтовые конверты, выявляют при понижении кислотности желудочного сока. Кристаллы билирубина в виде очень мелких ромбических или игольчатых образований или зерен оранжевого цвета содержится в норме в меконии новорожденных, фекалиях молодняка в первые дни жизни, а у взрослых животных регистрируют при быстром прохождении химуса и фекалий по кишечнику. Кристаллы гематоидина находят в фекалиях после кровотечений, форма их игольчатая или ромбическая, цвет красновато-коричневый (см. таб. 3, 4). 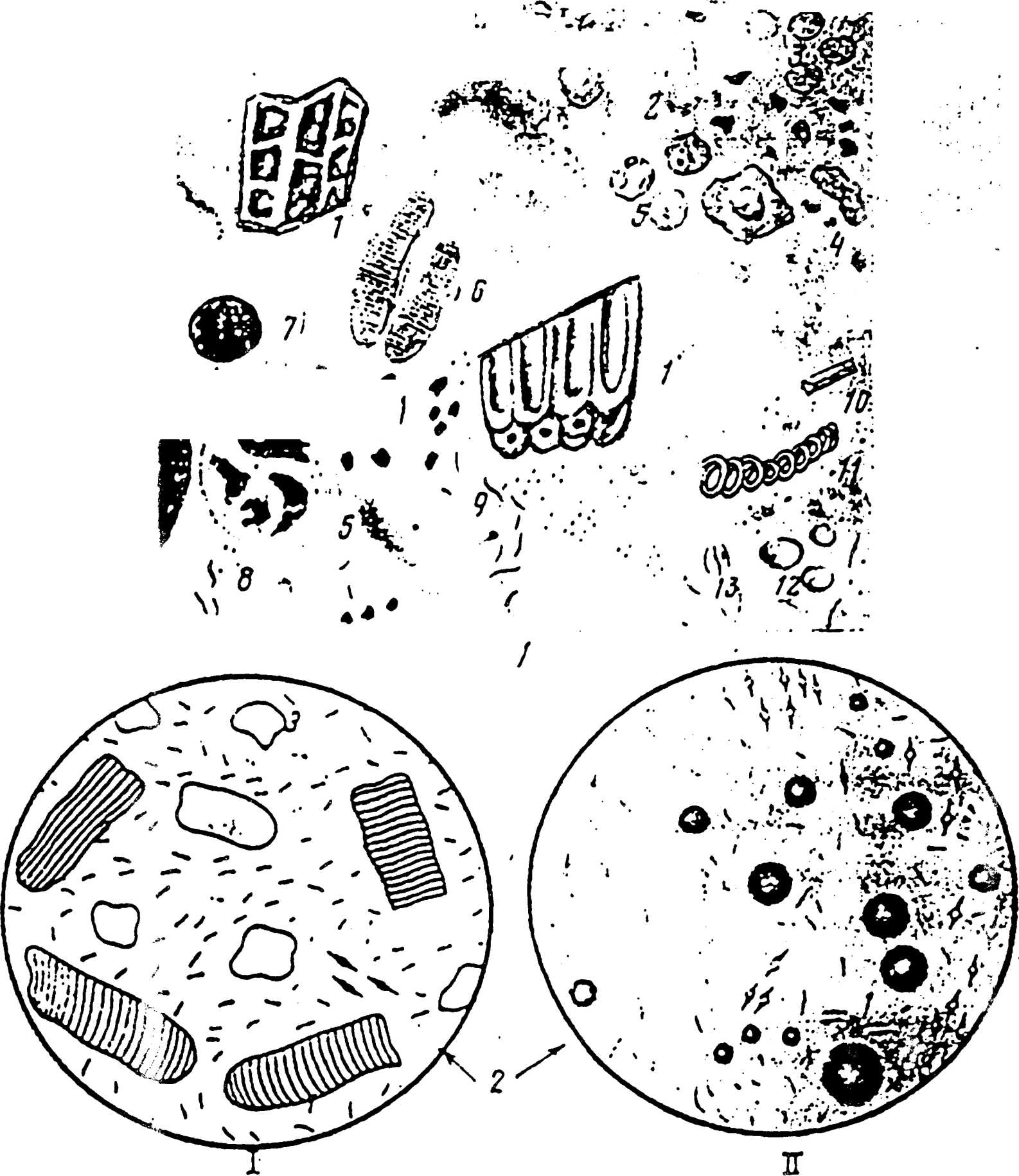 Рис. 1. Микроскопия фекалий: 1-переваримая клетчатка. 2 - непереваримая клетчатка. 3 - растительный сосуд, 4 крахмал внеклеточный. 5 - крахмал внутриклеточный, 6 - мышечные волокна неизмененные, 7 - мышечные волокна измененные, 8 - нейтральный жир, 9 -кристаллы жирных кислот. 10 - мыла, 11 - эритроциты. 12 -лейкоциты, 13 – йодофильная флора. Рис. 2. Микроскопия фекалий: 1-мышечные волокна в испражнениях (нативный препарат, ув.140)сс поперечной (1), продольной (2) исчерченностыо и без нес (3): 11 - нейтральный жир в испражнениях (окраска Суданом-3.ув.140). Таблица № 3. Микроскопия кала травоядных
Таблица № 4.
Микроскопия кала плотоядных и всеядных Химическое исследование кала. Оно имеет целью определить реакцию кала, его рН, наличие в нем «скрытой» крови, желчных пигментов, белковую экссудацию, а также активность ферментов. Определение реакции кала производят с помощью лакмусовой или индикаторной бумаги, а лучше с помощью рН-метра. У здоровых травоядных реакция чаще нейтральная или слабокислая; у плотоядных—нейтральная или слабощелочная. Она обусловлена жизнедеятельностью кишечной флоры—бродильной и гнилостной. При недостаточном усвоении углеводов активизируется бродильная флора, продуктами жизнедеятельности которой являются двуокись углерода и органические кислоты, в результате чего реакция кала становится кислой. При плохом усвоении белков, а также при воспалительных изменениях с экссудацией белка повышается жизнедеятельность гнилостной микрофлоры, кал становится резко щелочным вследствие образования аммиака. Методика Определение реакции фекалий. Красную и синюю лакмусовую бумагу, а лучше универсальную индикаторную бумагу смачивают дистиллированной водой и прикладывают к фекальным массам. При кислой реакции синяя бумажка краснеет, при щелочной - красная синеет, при нейтральной - обе бумажки не изменяют цвета. Изменение цвета универсальной индикаторной бумаги сравнивают с цветной шкалой, имеющей цифровые обозначения рН. Наиболее точно реакцию фекалий можно определить с помощью рН-метра (разводят фекалии дистиллированной водой в соотношении 1:10). Определение органических кислот («молочной, маслиной, уксусной, пропионовой, валериановой и др.) Реактивы. 30% водный раствор полутора хлористого железа; 1% спиртовой раствор фенолфталеина; раствор гидрата окиси кальция. 0.1 и раствор соляной кислоты: 0.5% спиртовой раствор диметиламидоазобензола. Ход определении. 10 г фекалий, размешивают в 100 мл дистиллированной воды, прибавляют I мл 30% раствора полутора хлористого железа, 25—30 капель спиртового раствора фенолфталеина и 2 мл гидрата окиси кальция, хорошо перемешивают. Жидкость окрашивается в красный цвет. После 20 - 30 минутного отстаивания смесь фильтруют через бумажный фильтр. В колбу отмеривают 25 мл фильтрата, прибавляют 10-15 капель 0,5% спиртового раствора диметиламидоазобензола до появления слабо - розового окрашивания. Затем титруют из бюретки 0,1 н раствором соляной кислоты до перехода в оранжевый цвет. Количество миллилитров 0,1 и раствора соляной кислоты, пошедшее на титрование, умножают на коэффициент 4. что и будет соответствовать количеству органических кислот в 10 г кала. Содержание органических кислот в норме у здоровых животных (овец, коз) составляет 10-13 ед. титра. Определение аммиака. Реактивы: 1% спиртовой раствор фенолфталеина, 0,1 н раствор едкого натра, формалин. Ход определения. Для исследования на аммиак кал берут из прямой кишки. 10 г кала заливают 100 мл дистиллированной воды, хорошо смешивают и фильтруют через бумажный фильтр. Затем к 25 мл фильтрата добавляют 5—10 капель 1% спиртового раствора фенолфталеина и титруют из бюретки 0,1 н раствором едкого натра до появления розового окрашивания. Количество израсходованной на титрование щелочи умножают на 4; полученное число соответствует содержанию аммиака в 10 г кала. У здоровых овец, коз содержание аммиака составляет 2— 4 ед. Более точные сведения о соотношении бродильных и гнилостных процессов в кишечнике получают путем определения в кале органических кислот и аммиака по Гуаффону и Ру. В норме содержание органических кислот выражается следующей величиной: у лошади* 12 мл (С. Н. Болховитинов): у телят (по данным А. М. Смирнова) однодневного возраста-2,7 (1,2-6,4) мл; в возрасте 2-15 дней-7,8(2,4-22) мл; в возрасте 15-30 дней-8,1 (2,0-15,6) мл; в возрасте старше 30 дней-9,9 (4,0-19,0) мл; у собак-7,9-18,0 мл (А. X. Шайхаманов). Содержание аммиака соответствует у лошади 2-3 мл (С. Н. Бояховитинов); у телят (по данным А М. Смирнова) однодневного возраста-2,4 (1,0-3,6) мл; в возрасте 2-15 дней-6,4 (1,6-12,0) мл; в возрасте 15-30 дней-5,6 (2,8-10,8) мл; в возрасте старше 30 дней-2,3 (0,6-6,0) мл; у собак 3,2-8,0 мл (А. X. Шайхаманов). Увеличение содержания органических кислот свидетельствует об усилении процессов брожения, аммиака - процессов гнилостного распада белка в кишечнике. При диарее количество органических кислот и аммиака может уменьшиться, в таких случаях о преобладании процессов брожения или гниения судят по соотношению количества органических кислот и аммиака (А М. Смирнов). Для выяснения вопроса о том, полностью ли прекратилось поступление желчи в кишечник или только уменьшено, ставят реакцию на стеркобилин и другие желчные пигменты. Проба на билирубин может быть положительной у здорового молодняка в первые дни жизни; у молодняка же более старшего возраста и у взрослых животных билирубин может быть при энтерите, дисбактериозе (после лечения антибиотиками). Обнаружение крови в кале имеет большую диагностическую ценность при тромбоэмболических коликах, травматическом ретикулите, кокцидиозе и др. Цвет кала меняется только при обильных кровотечениях; малые, скрытые примеси крови определяются химическими пробами; наиболее чувствительной из них является бензидиновая проба. Методика. Определение крови и билирубина в фекалиях. Это исследование особенно важно в тех случаях, когда имеется подозрение на наличие так называемой скрытой крови (гемоглобина и его дериватов), «ускользающей» при макро- и микроскопическом исследовании. Для определения крови и билирубина в фекалиях применяют следующие пробы. 1. Бензидиновая проба. На предметное стекло наносят фекалии толстым слоем, добавляют 2-3 капли свежеприготовленного раствора бензидина в уксусной кислоте (берут на кончик ножа небольшое количество бензидина и растворяют в 5 мл ледяной уксусной кислоты) и столько же 3%-ного раствора перекиси водорода. Перемешивают стеклянной палочкой. При положительной реакции на кровь появляется сине-зеленое окрашивание в течение первых 2 мин. Окрашивание, появившееся после 2 мин, не учитывают. Проба выявляет незначительное содержание крови (0,2%) в фекалиях. 2. Проба на стеркобилин с уксуснокислым цинком (по Шлезингеру). Комочек фекалий растирают приблизительно с 10-кратным объемом дистиллированной воды, приливают равное количество реактива Шлезингера (10 г ацетата цинка, растворенного и 90 мл 96° алкоголя) и несколько капель раствора Люголя. Фильтруют, фильтрат дает зеленую флюоресценцию, которая лучше видна на черном фоне. 3. Проба Фуше на билирубин. Комочек фекалий растирают с дистиллированной водой в соотношении 1:20 и добавляют по каплям реактив Фуше (25 г трихлоруксусной кислоты растворяют в 100 мл дистиллированной воды и добавляют 10 мл 10 %-ного раствора полуторахлористого, или хлорного железа) в количестве, не превышающем объем эмульсии. В присутствии билирубина появляется зеленое или синее окрашивание. Билирубин в фекалиях может быть у здоровых животных и первые дни жизни, у молодняка более старшего возраста и у взрослых животных он может содержаться при энтеритах, дисбактериозах (после лечения антибиотиками). Определение реакции па белковую экссудацию проводят по методу Трибуле—Вишнякова; нахождение в кале растворимого белка свидетельствует об усилении его выделения кишечной стенкой, что имеет большое диагностическое значение. Наличие растворимого белка свидетельствует о воспалительных процессах слизистой оболочки кишечника. Для определения функционального состояния кишечника при диспепсии и гастроэнтероколите у телят, по данным И. В. Никишиной, имеет значение определение активности энтерокиназы и щелочной фосфатазы в кале (по Шлыгину, Фоминой и Михлину), при этом в продромальный период, а особенно в период выраженной болезни, активность. ферментов резко увеличивается, что дает возможность использовать этот тест также для ранней диагностики названных болезней. Методика. Определение реакции на белковую экссудацию. Готовят 3%-ную эмульсию фекалий (3 г фекалий с 100 мл дистиллированной воды, растирают в ступке). В 3 пробирки разливают эмульсию по 15 мл. В первую пробирку наливают 2 мл насыщенного раствора сулемы (7 г сулемы растворяют в 100 мл дистиллированной воды при нагревании, яд!) или 20%-ного раствора трихлоруксусной кислоты, во вторую - 2 мл 20%-ного раствора уксусной кислоты и в третью, контрольную, - 2 мл дистиллированной воды. Пробирки встряхивают и оставляют при комнатной температуре на 24 ч, после чего отмечают степень просветления жидкости над осадком, сравнивая с контрольной пробиркой. Учет реакции и ее оценка таковы: полное просветление (+++++) - реакция резко положительная, значительное просветление (+++) - реакция положительная; незначительное просветление (+) - реакция слабоположительная и одинаковое с контролем помутнение — реакция отрицательная. Просветление, в первой пробирке указывает на наличие сывороточного белка (растворимого белка), что свидетельствует о воспалительных процессах слизистой оболочки кишечника. Просветление во второй пробирке свидетельствует об увеличении содержания слизи - муцина. По реакции в пробирке с раствором сулемы можно судить о содержании стеркобилина и билирубина. При наличии стеркобилина появляется розовое, а билирубина - зеленое окрашивание. В пробирке с трихлоруксусной кислотой при выявлении билирубина также получается зеленое окрашивание. Содержание стеркобилина и билирубина можно оценивать в пятибалльных плюсовых единицах. При этом минимальный балл (+ ) ставят, когда единичные частицы фекалий окрашены в зеленый (розовый) цвет, максимальный балл (+++++), когда весь кал имеет зеленый (кирпично-красный цвет). Отсутствие окрашивания обозначают знаком минус (-). Ферменты. В кале содержится ряд ферментов. Наибольшее практическое значение имеет определение энтерокиназы и щелочной фосфотазы, количественное определение которых используется как биохимический тест для оценки деятельности кишечника. Определение щелочной фосфатазы (по Фоминой, Михлину, Шлыгину). Щелочная фосфатаза - характерный кишечный фермент, присутствующий в ферменте и слизистой оболочке тонкой кишки в больших количествах. В других пищеварительных секретах фермента содержится мало. Принцип. В качестве субстрата используют фенолфталеинфосфат натрия, при инкубации которого с ферментом освобождается фенолфталеин, дающий красную окраску в щелочной среде. Появившаяся окраска визуально сравнивается с окраской стандартного щелочного раствора фенолфталеина. Определение проводится в условиях, оптимальных для действия щелочной фосфотазы в присутствии активатора (0,001 М Мg+, при температуре 37° и при рН 10,0). Реактивы. 1. 0,1% раствор фенолфталеинфосфата натрия в 0,1 н аммиачном буфере рН 10,1. Для приготовления буфера смешивают 1 объемную часть 0,1 н раствора хлорида аммония (NH4Cl) и 4 части 0,1 н раствора аммиака (проверенного титрометрически). Исходные для буферной смеси растворы удобнее приготовлять и сохранять в виде 1 н концентрации и перед употреблением разбавлять в 10 раз. 2. 1,5% раствор сульфата магния, 3. Стандартный раствор фенолфталеина: смесь 1 мл 0,05% полуспиртового раствора (50 частей спирта + 46 частей воды) фенолфталеина, 1 мл 0,1 н раствора аммиака и 4 мл 0,1 н раствора хлорида аммония. Степень окраски раствора проверяют в фотоэлектроколориметре. Оптическая плотность при зеленом светофильтре и толщине слоя 1 см должна быть 0,17-0,19. Стандартный раствор сохраняют в темном месте в посуде, не подвергшейся выщелачиванию, в течение 1-2 нед. 4. Этиловый спирт. Оборудование. 1. Термостат на 37-38°. 2. Центрифуга на 2500-3000 об/мин, с центрифужными стаканами емкостью 10-25 мл. 3.Ступки фарфоровые емкостью 50-100 мл. 4. Градуированные пипетки емкостью 2,5 и 10 мл. 5. Пробирки и штативы, 6. Кварцевый песок. 7.Фотоэлектроколориметр. Ход определения. Готовят вытяжку из фекалий 1:10 (см. определение энтерокиназы). Степень разведения вытяжки зависит от ожидаемых результатов анализа. При исследовании фекалий взрослых берут разведение 1:30 (1 часть вытяжки и 2 части дистиллированной воды). При исследовании фекалий детей первых 2-3 лет жизни разведение 1:200 или 1:1000, т. е. Вытяжку дополнительно разводят в 20 или 100 раз. Определение начинают с ориентировочной пробы: к 0,5-1 мл вытяжки добавляют равный объем раствора фенолфталеинфосфата в аммиачном буфере (реактив № 1). Если в течение 2 мин появляется значительное розовое окрашивание то вытяжку разводят дополнительно в 10 раз и снова испытывают тем же образом. В случае появления розовой окраски разводят вновь. Отсутствие окраски в течение 2 мин свидетельствует о достаточной степени разведения материала (исходное разведение). Для исследования берут 8-10 пронумерованных пробирок из бесцветного стекла одинакового диаметра. В каждую пробирку, за исключением первой, наливают по 1 мл дистиллированной воды. В первую пробирку наливают 1 мл исследуемого раствора в исходном разведении, установленном в ориентировочной пробе. Во вторую пробирку наливают 2 мл исследуемого раствора и хорошо перемешивают с водой, набирая в пипетку жидкость и выдувая обратно. После этого 2 мл смеси из второй пробирки переносят в третью и т.д. до конца ряда. Из последней пробирки 2 мл жидкости отбрасывают. Таким образом, получают ряд разведений с уменьшением количества ферментного материала в каждой пробирке на 1/3. Во все пробирки добавляют по капле 1,5% раствора МgSO4 (реактив № 2), служащего активатором, и по 1 мл реактива № 1. Пробирки закрывают пробками . перемешивают и помещают в термостат при 37а С на час. По истечении времени наблюдается постепенное изменение окраски от интенсивно-красной на одном краю до полного отсутствия красного окрашивания на другом. Поднося пробирку со стандартным раствором фенолфталеина (2 мл), нахолят степень окраски в ряду, равную стандартной. Количество фермента, вызывающее в описанных выше условиях появление такой окраски, принято за единицу фосфатазы. |
