Методические указания к лабораторным работам
 Скачать 473 Kb. Скачать 473 Kb.
|
Оборудование и реактивыВ лаборатории: штатив – 1 шт., лапа – 2 шт., кристаллизатор – 1 шт., колба Вюрца объемом 50 мл с присоединенной изогнутой стеклянной трубкой – 1 шт., резиновая пробка – 1 шт., фильтровальная бумага. В вытяжном шкафу: соляная кислота – раствор концентрацией 1 моль/кг; мерный цилиндр, объемом 25 или 50 мл – 1 шт. Получать в лаборантской: термометр – 1 шт., барометр – 1 шт., бюретка, объемом 25 мл – 1 шт., навеска исследуемого металла с указанной массой – 1 шт., полоска миллиметровой бумаги длиной 30 см. Выполнение работы1. Наполнить водой кристаллизатор и бюретку (стеклянную трубку с делениями и краном для выпуска жидкости внизу). Проверить, плотно ли закрыт кран бюретки. 2. Закрыв верхнее отверстие пальцем, перевернуть бюретку и опустить ее в кристаллизатор с водой. Палец убрать под водой, при этом вода из бюретки не вытечет. 3. Закрепить бюретку в штативе. Уровень воды в ней не должен быть выше крайнего деления шкалы. 4. В колбу Вюрца (круглодонная колба с боковым отводом) при помощи мерного цилиндра отобрать 15−20 мл соляной кислоты. 5. Вытереть насухо горло колбы фильтром. 6. Расположив колбу горизонтально, поместить в ее горло навеску металла и плотно закрыть колбу пробкой. 7. Поместить присоединенную к боковому отводу колбы Вюрца стеклянную трубку в опущенный в воду конец бюретки. 8. После этого отметить уровень жидкости в бюретке. Показания следует снимать по положению нижнего края вогнутого мениска жидкости при нахождении его на уровне глаз. Цифры на шкале бюретки означают объем в мл, при снятии показаний необходимо учитывать, что бюретка со шкалой перевернута. 9. Затем колбу переводят в вертикальное положение, сбрасывая навеску металла в кислоту. В результате реакции выделяется водород, который вытесняет воду из бюретки. Во время протекания реакции не следует держать колбу в руках во избежание ее нагрева и искажения результатов за счет теплового расширения газа. 10. Когда выделение пузырьков водорода прекратится, отметить конечный уровень воды в бюретке. 11. При помощи полоски миллиметровой бумаги измерить высоту столба воды в бюретке от нижнего края мениска до уровня воды в кристаллизаторе. 12. По показаниям барометра и термометра определить атмосферное давление и температуру в лаборатории. Содержание протокола лабораторной работыМасса навески металла, mМе = ……….г. Объем соляной кислоты, VHCl = …………….мл. Объем воды в бюретке в начале эксперимента V1 = ……..мл. Объем воды в бюретке в конце эксперимента V2 = ……..мл. Объем выделившегося водорода Vизм = V1 − V2 = ……….мл. Высота столба воды в бюретке, h = …………..мм. Атмосферное давление в лаборатории Pатм = ……..мм.рт.ст. Температура в лаборатории, Т = ……°С. Обработка результатов эксперимента1. Водород находится в бюретке под давлением ниже атмосферного на величину давления водяного пара, а также разрежения, создаваемого за счет давления столба жидкости в бюретке. Поэтому давление водорода вычисляют по формуле: P = Pатм − P1 − P2, где Р1 – давление столба воды в бюретке, Па, Р1 = 9,8hdaq, 9,8 – переводной коэффициент из мм вод.ст. в Па; daq – плотность воды, равная 1 г/см3; Р2 – давление насыщенного водяного пара, которое находят по таблице 1. Таблица 1 Зависимость давления насыщенного водяного пара от температуры
2. Массу выделившегося водорода mH вычисляют по уравнению Менделеева–Клапейрона: 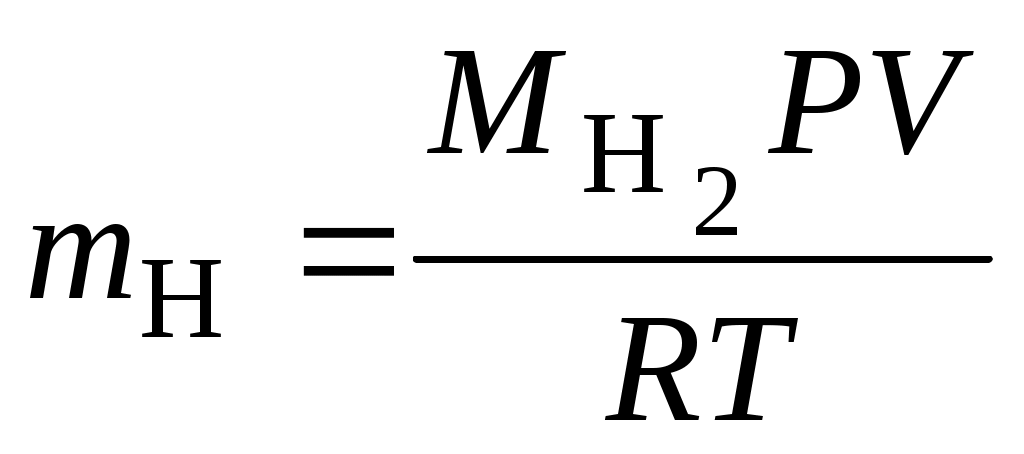 , ,где 3. Вычислить эквивалент металла по закону эквивалентов: где ЭМ(Н) – эквивалентная масса водорода, равная 1 г/экв 4. По степени окисления металла, указанной преподавателем, определить молярную массу металла. Установить, что это за металл. 5. Вычислить точное значение эквивалентной массы металла и найти относительную погрешность эксперимента: 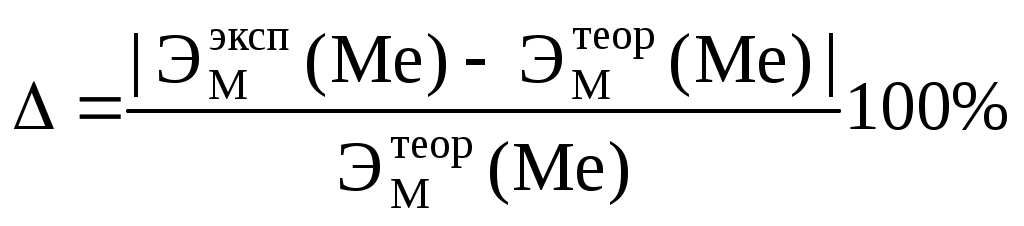 . . |
