Методические указания к лабораторным работам
 Скачать 473 Kb. Скачать 473 Kb.
|
Содержание протокола лабораторной работыОпыт 1 – таблица 2. Зависимость времени реакции от количества тиосульфата натрия
Опыт 2 – таблица 3. Зависимость времени реакции от температуры
Опыт 3 – таблица 4. Зависимость времени реакции от степени измельчения
Опыт 4 – таблица 5. Зависимость времени реакции от состава системы.
Опыт 5 – таблица 6. Зависимость положения равновесия от состава системы
Обработка экспериментальных данныхОпыт 11. Заполнить таблицу 7. Таблица 7 Зависимость скорости реакции от концентрации тиосульфата натрия
2. По данным таблицы 7 построить график зависимости скорости реакции от концентрации тиосульфата натрия. 3. По данным таблицы 7 построить график зависимости в координатах lnCотн – . Провести линию тренда – должна быть прямая зависимость. Определить тангенс угла наклона прямой. Значение тангенса угла наклона соответствует величине константы скорости реакции. Опыт 21. По данным таблицы 3 заполнить таблицу 8. Таблица 8 Зависимость скорости реакции от температуры
2. Значение температурного коэффициента (коэффициента Вант-Гоффа) рассчитать по формуле: 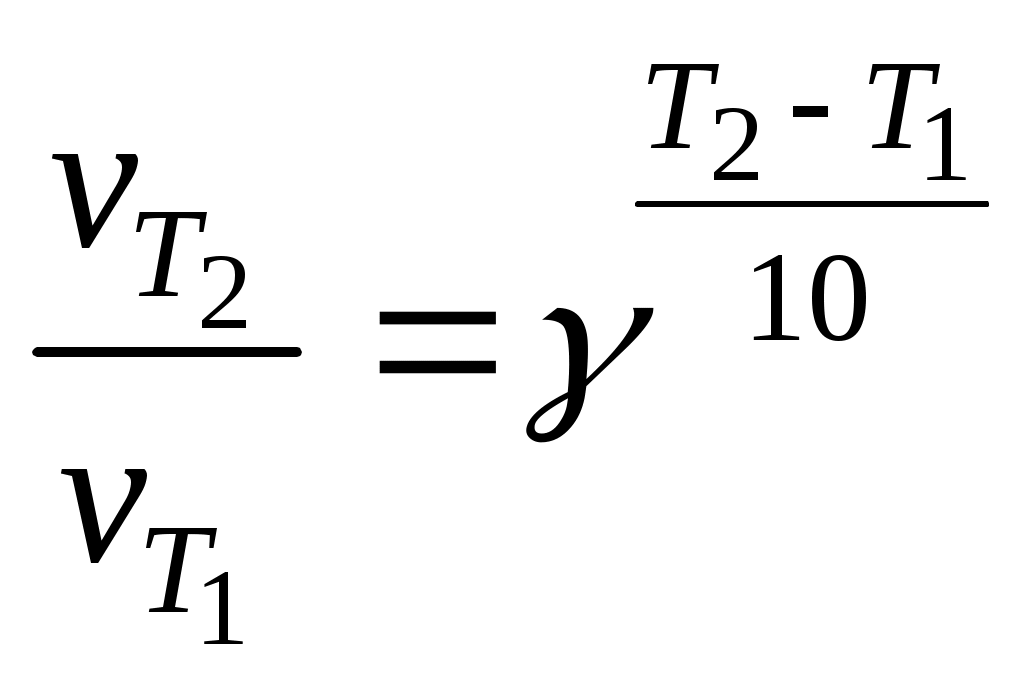 , , рассматривая попарно Т2 − Т1 и Т3 − Т2. 3. Значение энергии активации рассчитать исходя из формулы: 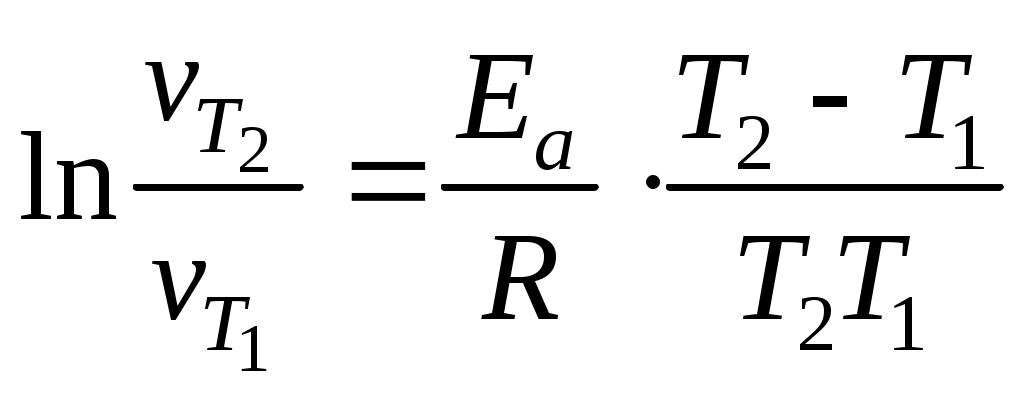 , , рассматривая попарно Т2 − Т1 и Т3 − Т2. 4. Определить среднее значение коэффициента Вант-Гоффа ср. 5. Определить среднее значение энергии активации Ea, ср. |
