Методические указания к лабораторным работам
 Скачать 473 Kb. Скачать 473 Kb.
|
Оборудование и реактивыВ лаборатории: штатив с лапкой. Получать в лаборантской: колба мерная объемом 100 мл – 1 шт., колба коническая объемом 100 мл – 2 шт., пипетка мерная объемом 5 мл – 1 шт., бюретка объемом 25 мл – 1 шт., цилиндр мерный объемом 100 мл – 1 шт., ареометр – 1 шт.; кислота соляная – раствор концентрацией 10 %, гидроксид натрия – раствор концентрацией 0,2 н., фенолфталеин. Выполнение работыПриготовление раствора1. Рассчитать, какой объем исходного раствора соляной кислоты следует взять для приготовления 100 мл раствора заданной преподавателем концентрации. 2. Рассчитанный объем исходного раствора из бюретки отобрать в мерную колбу, довести уровень жидкости в колбе дистиллированной водой до метки по нижнему краю мениска и перемешать раствор путем переворачивания плотно закрытой колбы. Определение концентрации приготовленного раствора титрованием1. В 2 конические колбы пипеткой Мора отобрать аликвотные объемы приготовленного раствора 5 мл, добавить немного дистиллированной воды (до толщины слоя жидкости около 5 мм) и 2−3 капли индикатора – фенолфталеина. 2. Бюретку на 25 мл наполнить титрованным раствором едкого натра. Кончик бюретки должен быть заполнен раствором, а уровень жидкости доведен точно до нулевого деления. Затем медленно, по каплям, добавлять раствор щелочи из бюретки к аликвоте кислоты, непрерывно перемешивая раствор в конической колбе. 3. Эквивалентную точку определить по переходу окраски фенолфталеина от бесцветной к малиновой, сохраняющейся при перемешивании в течение 30 с. 4. Титрование повторить 2−3 раза, измеренные эквивалентные объемы щелочи усреднить. Протокол лабораторной работы1. Заданная преподавателем концентрация соляной кислоты 2. Расчет объема соляной кислоты, необходимого для приготовления 100 мл раствора кислоты заданной концентрации. 3. Объем аликвоты соляной кислоты, взятый для титрования, Va= ……., мл. 4. Концентрация раствора щелочи CNaOH = …….., экв/л. 5. Объем щелочи, пошедший на титрование пробы соляной кислоты: VNaOH, 1 = …………., мл; VNaOH, 2 = …………., мл; VNaOH, ср = …………, мл. Обработка результатов экспериментаРассчитать концентрацию соляной кислоты по результатам титрования и определить отклонение от заданного значения концентрации соляной кислоты 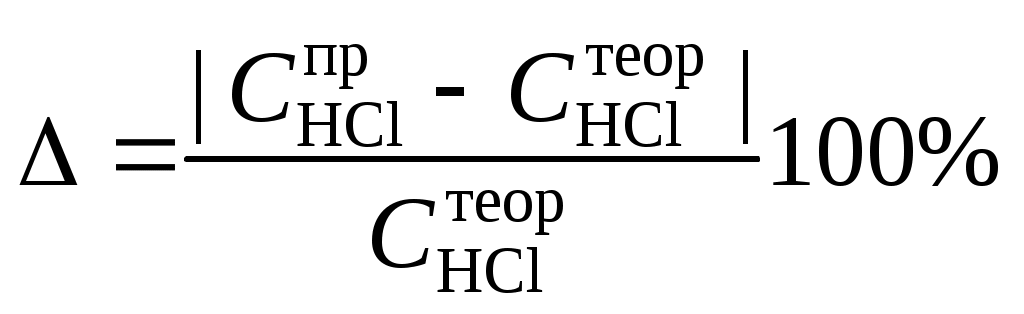 . .Содержание отчета по лабораторной работе1. Название работы. 2. Цель работы. 3. Ход эксперимента. 4. Результаты эксперимента согласно протоколу лабораторной работы. 5. Обработка результатов эксперимента. 6. Выводы. Лабораторная работа № 6. Исследование реакций в растворах электролитовЦель работы: Ознакомиться с практическими выводами теории электролитической диссоциации, с реакциями в растворах электролитов и научиться составлять их уравнения. Общие сведенияЭлектролитической диссоциацией называется процесс распада молекул электролитов на ионы под действием полярных молекул растворителя. Количественно способность электролита распадаться на ионы характеризуют степенью диссоциации: = n/n0, где n – число продиссоциированных молей; n0 – исходное число молей электролита. Процесс диссоциации обратимый, он приводит к равновесию между недиссоциированными молекулами и ионами и, следовательно, должен подчиняться закону действующих масс. Вещество АВ при растворении в воде диссоциирует по уравнению: АВ = А+ + В− При постоянной температуре отношение произведения концентраций конечных и исходных веществ постоянно и называется константой диссоциации: где А+, В, АВ – концентрации ионов и молекул электролита в растворе, моль/л или моль/кг. По степени и величине константы диссоциации все электролиты принято условно делить на сильные и слабые. Сильные электролиты в растворе диссоциируют практически полностью, слабые - частично. Закон действующих масс справедлив лишь для слабых электролитов. К сильным электролитам относят: = Кислоты: азотную HNO3, серную H2SO4, соляную HCl, бромисто- и йодистоводородные HBr и HI, хлорную HClO4. = Гидроксиды щелочных металлов, стронция и бария. = Соли. Остальные электролиты являются слабыми. Мало диссоциированными соединениями являются также комплексные ионы в растворе. Константы их диссоциации даны в справочниках. Правила написания молекулярно-ионных уравнений реакций в растворах электролитов. = Сильные электролиты записывают в диссоциированной форме, в виде отдельных составляющих их ионов. = Слабые электролиты, сложные ионы, в том числе и комплексные, а также малорастворимые соединения и газы записывают в молекулярной, недиссоциированной форме. = Одинаковые ионы в левой и правой частях уравнения сокращают, подобно правилам алгебры. Отсюда вытекают условия протекания реакций в растворах электролитов. = Образование или растворение малорастворимого соединения, выпадающего в осадок. Растворимость соединений определяют по таблицам растворимости. = Образование или разрушение мало диссоциированного соединения, иона или комплекса. = Выделение или растворение газа. Примеры написания уравнений реакций. а) CaCl2 + 2AgNO3 = 2AgCl + Ca(NO3)2 Ag+ + Cl = 2AgCl б) 2NH4OH + H2SO4 = (NH4)2SO4 + 2H2O |
