Методические указания к лабораторным работам
 Скачать 473 Kb. Скачать 473 Kb.
|
Содержание отчета по лабораторной работеОпыт 1.Привести таблицу с результатами эксперимента. Написать уравнения реакций гидролиза в молекулярной и ионной формах. Сделать выводы о характере растворов (кислый или щелочной). Опыт 2. А. Написать молекулярное и ионное уравнения реакции образования ацетата алюминия и ионное уравнение его гидролиза. Ответить на вопросы, приведенные ниже. Продуктом какой ступени гидролиза является образовавшийся осадок основной соли? При гидролизе каких солей могут получаться основные соли? Б. Составить молекулярное и ионное уравнение гидролиза сульфита натрия. Ответить на приведенные ниже вопросы. На присутствие каких ионов в растворе указывает найденное значение рН раствора сульфита натрия? В результате какого процесса эти ионы появились? Какая соль является продуктом гидролиза сульфите натрия по первой ступени? Написать молекулярное и ионное уравнения реакции гидролиза сульфита натрия. При гидролизе каких солей получаются кислые соли? Опыт 3.По результатам опыта 3А и 3Б заполнить таблицу
*) Для гидроксидов металлов найти в справочной литературе значение констант нестойкости гидроксокомплексов Составить молекулярные и ионные уравнения гидролиза. Ответить на ниже приведенные вопросы. В каком растворе при гидролизе по аниону концентрация ионов ОН– более высокая? Степень гидролиза какой соли больше? Почему? Степень гидролиза какой соли при одинаковых концентрациях и температуре должна быть больше: А1Сl3 или MgCl2? В растворе какой соли концентрация ионов Н+ выше? Сделать общий вывод о влиянии силы кислоты и основания, образующих соль, на степень ее гидролиза. Опыт 3В.Написать ионные уравнения первой и второй ступеней гидролиза хлорида сурьмы (III) и общее уравнение ее гидролиза до образования Sb(OH)2Cl. Написать формулу для вычисления константы гидролиза хлорида сурьмы (III) для первой ступени. Показать при помощи этой константы, как влияет разбавление на степень гидролиза этой соли. Сделать общий вывод о влиянии разведения на степень гидролиза солей. Степень гидролиза каких солей не меняется при разбавлении раствора? Добавлением какого реактива можно уменьшить степень гидролиза хлорида сурьмы? Опыт 3Г.Составить уравнение гидролиза хлорида олова (II) в молекулярной и ионной форме. Ответить на вопросы. Почему при растворении хлорида олова в воде образуется осадок основной соли? Добавлением какого реактива можно уменьшить степень гидролиза хлорида олова (II)? Опыт 4 и 5.Составить ионные и молекулярные уравнения гидролиза. Объяснить причину растворения цинка в растворах солей цинка и алюминия. Лабораторная работа № 8. Приготовление буферного раствораЦель работы: научиться выбирать состав буферного раствора с заданным значением рН, рассчитывать количества компонентов, необходимые для приготовления буферного раствора. Познакомиться с понятием емкости буферного раствора и научиться ее определять. Освоить современные методы измерения водородного показателя растворов с помощью рН-метров. Общие сведенияБуферными называют растворы, способные поддерживать постоянное значение концентрации ионов водорода или гидроксила при разбавлении, а также при добавлении некоторых количеств сильной кислоты или щелочи. Способность раствора поддерживать определенную кислотность среды называют буферным действием. Буферное действие основано на связывании добавляемых ионов Н+ или ОН в молекулы малодиссоциированных соединений. Основные типы буферных растворов следующие: Смесь слабой кислоты и ее соли, например, ацетатный буфер: CH3COOH + CH3COONa. Механизм буферного действия следующий: а) при добавлении кислоты ионы Н+ связываются анионами соли в молекулы слабой кислоты по реакции: б) при добавлении щелочи ионы гидроксила нейтрализуются слабой кислотой по реакции: Смесь слабого основания и его соли, например, аммиачный буфер: NH4OH + NH4Cl. Буферное действие обусловлено протеканием следующих процессов: а) при добавлении кислоты ионы Н+ нейтрализуются слабым основанием по реакции: б) при добавлении щелочи ионы гидроксила связываются катионами соли в молекулы слабого основания: Расчет рН кислого буфера проводят на основании константы диссоциации слабой кислоты: где pKd – показатель константы диссоциации слабой кислоты, pKd = –lgKd; Сс и Ск – концентрации соли и килоты соответственно, моль/л Для основного буфера можно вывести аналогичную формулу, но для расчета гидроксильного показателя: где pKd – показатель константы диссоциации слабого основания; Сс и Сосн – концентрации соли и основания соответственно, моль/л Водородный показатель основного буфера вычисляют по формуле: рН = 14 − рОН. Интегральной емкостью буферного раствора называют число молей сильной кислоты или щелочи, которое требуется прибавить к 1 л буферного раствора для изменения его рН на единицу. После этого раствор практически утрачивает буферное действие. Дальнейшее добавление сильной кислоты или щелочи вызывает резкое изменение рН раствора. Поэтому емкость буферного раствора можно определить экспериментально путем титрования сильной кислотой или, соответственно, щелочью с цветными индикаторами. Рассчитывают емкость буферных растворов на основе формул вычисления рН. Емкость кислого буфера по щелочи, ВЩ рассчитывают исходя из уравнения: при решении которого получается формула: Емкость кислого буфера по кислоте вычисляют на основе уравнения: из которого выводят расчетную формулу: Емкости основного буфера по кислоте и по щелочи определяются согласно уравнениям: Выбор состава буферного раствора. Отношение Сс/Ск или Сс/Сосн выбирают в пределах 0,1Ссоли/Ск-ты 10. По таблицам констант диссоциации подбирают слабую кислоту с pKd = pH (или слабое основание с pKd = pOH ), исходя из заданного значения рН вычисляют отношение концентраций Сс/Ск (или Сс/Сосн). Оборудование и реактивыВ лаборатории: рН-метр; бюретка объемом 100 мл – 4 шт (или мерные цилиндры); уксусная кислота – 0,2 М раствор, ацетат натрия – 0,2 М раствор, гидроксид натрия – 0,2 М раствор, хлорид аммония – 0,2 М раствор, соляная кислота для титрования – 0,05 н. раствор, гидроксид натрия для титрования – 0,05 М раствор. В штативе с реактивами: метилоранж. Получать в лаборантской: пипетка Мора объемом 5 мл – 2 шт., мерная или коническая колба объемом 100 мл – 2 шт., коническая колба для титрования объемом 50 мл – 2 шт., стакан химический объемом 100 мл – 4 шт., стакан химический объемом 50 мл – 2 шт., бюретка объемом 25 мл – 2 шт.; фенолфталеин. Выполнение работыI. выбрать реактивы для приготовления буферного раствора.Определение состава буфера с заданным рН начинают с подбора слабой кислоты или слабого основания таким образом, чтобы показатель их константы диссоциации отличался от заданного значения рН или рОН не более, чем на единицу в соответствии с формулой рKd = рН 1. При этом пользуются справочными данными. II. Рассчитать объемы реактивов для приготовления буферного раствора.Т.к. концентрации компонентов буферного раствора одинаковы, при расчете объемов компонентов можно пользовать в формуле расчета рН буферного раствора соотношение объемов компонентов. Для ацетатного буферного раствора объемы кислоты и соли можно вычислить исходя из системы уравнений: 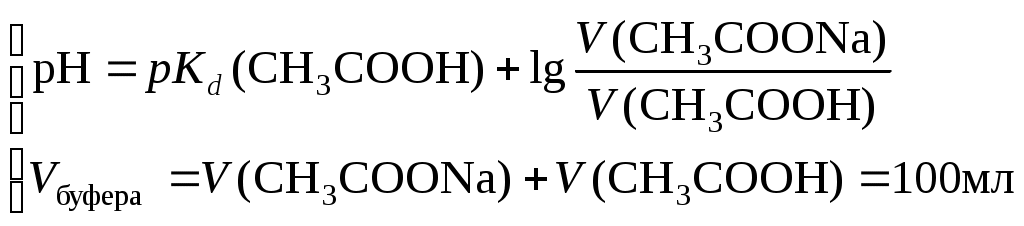 , pKd(CH3COOH) = 4,756. , pKd(CH3COOH) = 4,756.Для аммиачно-хлоридного буферного раствора следует рассчитать объемы гидроксида натрия и хлорида аммония. Необходимый для формирования буферного раствора гидроксид аммония получится по реакции: NH4Cl + NaOH = NH4OH + NaCl. 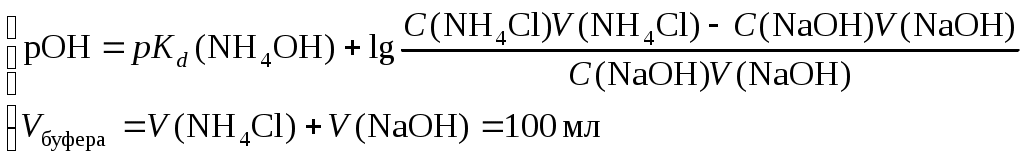 , pKd(NH4OH) = 4,752. , pKd(NH4OH) = 4,752.III. Приготовить буферный раствор и определить его рН1. Рассчитанные в п. 2 объемы выбранных растворов отбирают с помощью бюретки на 100 мл и смешивают в колбе на 100 мл. 2. Пробу буферного раствора отобрать в химический стакан объемом 50 мл 3. Включить рН-метр. 4. Вынуть электрод рН-метра из раствора хранения и протереть его кусочком фильтровальной бумаги. 5. Опустить электрод рН-метра в химический стакан с пробой буферного раствора. 6. После того как показания прибора установятся, считать значение рН на экране рН-метра. IV. Определить буферную емкостьДля ацетатного буфера определяют емкость по щелочи 1. В две конические колбы объемом 50 мл отбирают пипеткой по 5 мл буферного раствора. 2. К каждой пробе добавляют по 3−4 капли фенолфталеина 3. Титруют 0,05 М раствором NaOH до перехода окраски индикатора от бесцветной к розовой. 4. Записать объем титранта VТ для каждой пробы. Для аммиачного буфера определяют емкость по кислоте 1. В две конические колбы объемом 50 мл отбирают пипеткой по 5 мл буферного раствора. 2. К каждой пробе добавляют по 3−4 капли метилового оранжевого 3. Титруют 0,05 М раствором HCl до перехода окраски индикатора от желтой к красной. 4. Записать объем титранта VТ для каждой пробы. Протокол лабораторной работы1. Значение рН буферного раствора, заданное преподавателем рНтеор. = …….. 2. Реактивы для приготовления буферного раствора и их концентрации. Для ацетатного буфера – С(СН3СООН) = …………, моль/л С(CH3COONa) = ……….., моль/л Для аммиачно-хлоридного буфера – C(NaOH) = …….., моль/л C(NH4Cl) = ………, моль/л 3. Расчет объемов выбранных растворов Для ацетатного буфера: V(CH3COOH) = …………, мл V(CH3COONa) = ………….., мл Для аммиачно-хлоридного буфера – V(NaOH) = ……., мл V(NH4Cl) = ………, мл 4. Результат измерения рН приготовленного буферного раствора рНпракт. = …… 5. Объем пробы буфера, взятый для определения буферной емкости Va = …мл 6. Концентрация титранта Для ацетатного буфера – С(NaOH) = …………, моль/л Для аммиачно-хлоридного буфера – C(HCl) = …….., моль/л 7. Результаты титрования Для ацетатного буфера – V(NaOH)1 = …………, мл V(NaOH)2 = …………, мл V(NaOH)ср. = …………, мл Для аммиачно-хлоридного буфера – V(HCl)1 = …….., мл V(HCl)2 = …….., мл V(HCl)ср. = …….., мл Обработка результатов эксперимента1. Вычислить экспериментальное значение буферной емкости: где СТ и VТ – концентрация и эквивалентный объем титранта, а Va – аликвотный объем буферного раствора, отобранный мерной пипеткой для титрования. 2. Рассчитать теоретическое значение буферной емкости. Для ацетатного буфера вычислить буферную емкость по щелочи: где С(CH3COONa) и C(CH3COOH) – концентрация соли и кислоты в полученном буферном растворе, моль/л. Для аммиачно-хлоридного буфера вычислить буферную емкость по кислоте: где С(NH4OH) и C(NH4Cl) – концентрации основания и соли в полученном буферном растворе, моль/л. Содержание отчета по лабораторной работе1. Название работы 2. Цель работы 3. Ход эксперимента 4. Экспериментальные данные согласно протоколу лабораторной работы 5. Обработка экспериментальных данных 6. Выводы Содержаниеметодические указания к лабораторным работам 1 Введение 1 Лабораторная работа № 1. Исследование комплексных соединений 1 Лабораторная работа № 2. Исследование окислительно-восстановительных реакций 6 Лабораторная работа № 3. Определение эквивалентной массы металла 9 Лабораторная работа № 4. Исследование скорости химических реакций и химического равновесия 12 Лабораторная работа № 5 Приготовление раствора и определение его концентрации 19 Лабораторная работа № 6. Исследование реакций в растворах электролитов 22 Лабораторная работа № 7. Исследование гидролиза солей 27 Лабораторная работа № 8. Приготовление буферного раствора 31 Содержание 36 |
