zadanie химия. Методические указания по их выполнению для студентов заочной и дистанционной форм обучения
 Скачать 404 Kb. Скачать 404 Kb.
|
2.1.5. Бескислородные килотыОбщая формула таких кислот HхЭу. Эта группа соединений по химическим свойствам и характеру диссоциации в водных средах (образование ионов гидроксония Н3О+) сходна с кислородсодержащими кислотами, однако может быть выделена в отдельную группу, т.к. они не являются гидроксидами. Аналогично кислородным кислотам, они могут быть различной основности. Название по систематической номенклатуре формируют следующим образом: на первом месте стоит слово «водород» с соответствующими количественными приставками, затем следует латинское название элемента с суффиксом «ид», например: HCl- водород хлорид H2S – диводород сульфид HCNS - водород роданид Наиболее распространенные бескислородные кислоты, название по полусистематической (международной) номенклатуре их кислотных остатков и солей приведены ниже:
Название бескислородной кислоты: сочетание корня русского названия элемента и слова «водородная». (По полусистематической номенклатуре на первом месте - название кислотного остатка + слово «водорода», например HCl-хлорид водорода, H2S- сульфид водорода, в современной русской учебной литературе наиболее распространены названия, которые приведены в таблице). Название кислотного остатка: корень латинского названия элемента с суффиксом «ид». Как и основания, все кислоты, независимо от их состава являются электролитами разной силы и подразделяют в зависимости от степени диссоциации на сильные, слабые кислоты и кислоты средней силы. Следует запомнить, что сильными кислотами являются следующие: H2SO4, HCl, HBr, HI, HNO3, HClO4, HMnO4. Такие кислоты, как H2CO3, H2S, H2SiO3, HNO2, H3BO3, HСlO, HCN являются слабыми кислотами. 2.1.6. СолиСоли – сложные вещества, состоящие из катионов (положительно заряженных частиц, чаще всего атомы металла) и отрицательно заряженных кислотных остатков. Разделяют по видам на нормальные (средние), гидросоли (кислые соли), гидроксосоли (основные соли), двойные соли, смешанные и комплексные. Двойные соли содержат атомы двух металлов и общий кислотный остаток, например, алюмокалиевые квасцы - KAl (SO4)2·12H2O. Смешанные соли имеют в своем составе разные кислотные остатки, например CaOCl2- смешанная соль кислот HCl и HСlO. В составе комплексных солей присутствует комплексный катион, например, [Ag(NH3)2]Cl, или комплексный анион – Na[Al(OH)4]. Как правило, вне зависимости от растворимости, большинство солей являются сильными электролитами. 2.1.6.1. Нормальные (средние) солиНормальные, или средние соли представляют собой продукт полной нейтрализации кислоты основанием (полное замещение атомов водорода атомами металла (более строго - катионами оснований) или полное замещение гидроксид-ионов основания кислотными остатками. В растворах диссоциируют с образованием катионов и анионов (кислотных остатков). По международной систематической номенклатуре названия солей формируются аналогично описанным ранее названиям других классов соединений.. Например, Na2CO3 - динатрий триоксокарбонат, К2SO4- дикалий тетраоксосульфат(VI), СaSiO3- кальций триоксосиликат (IV), NaClO – натрий хлорат (I), NaClO2 –натрий хлорат (II), NaCl- натрий хлорид, Na2S- динатрий сульфид и т.д. По полусистематической (международной) номенклатуре на первое место ставят название кислотного остатка (см. таблицы кислот), на второе – название катиона соли с указанием римскими цифрами без алгебраического знака степени окисления металла, если это, как отмечали ранее, необходимо. Например, Na2CO3 – карбонат натрия, NaClO – хлорит натрия, FeSO4- сульфат железа (II), Fe2(SO4)3 –сульфат железа (III), Na2S – сульфид натрия. Допускается запись: FeSO4 – сульфат Fe(II), Fe2(SO4)3 – сульфат Fe(III). В редких случаях для высших степеней окисления элемента в кислотном остатке используется приставка «пер» или «пиро» с суффиксом – «ат», а в низшей степени окисления в названии соли приставка «гипо» с суффиксом «ит». Например, NaClO можно назвать гипохлоритом натрия, NaClO4- перхлоратом натрия, а знаменитую «красную ртуть» Hg2Sb2O7 - пиростибатом ртути, без указания степени окисления элемента в кислотном остатке. По русской номенклатуре, считающейся в настоящее время устаревшей, названия нормальных солей образуют от названия соответствующей кислоты с прибавлением слова «кислый» (для солей, образованных от кислородсодержащих кислот) и названия катиона (при различных степенях окисления металла используют слова «окисное» или «закисное»), например: Na2SO4- сернокислый натрий (высшая степень окисления у атома серы) Na2SO3- сернистокислый натрий (степень окисления у атома серы меньше максимальной). Fe(NO3)2 – азотнокислое закисное железо Fe(NO2)3 – азотистокислое окисное железо Названия нормальных солей бескислородных кислот по русской номенклатуре начинают с кислотного остатка (русское название элемента в нем записывают в виде прилагательного с суффиксом «ист») и заканчивают названием катиона: Na2S - сернистый натрий, КСN - цианистый калий. Если катион (атом металла) проявляет несколько степеней окисления, то в солях с высшей степенью окисления атома металла название кислотного остатка имеет окончание «ая, ое» (CuCl2 – хлорная медь, FeCl3 – хлорное железо). При более низкой степени окисления атома металла окончание кислотного остатка будет «истая, истое» (CuCl – хлористая медь, FeCl2 – хлористое железо). Названия нормальных солей по русской номенклатуре достаточно сложны, и менее универсальны, поэтому встречаются только в старой литературе. Тем не менее, мы сочли необходимым дать их, поскольку они пока еще используются в технической литературе, некоторых справочниках, на этикетках химреактивов и др. Примеры названий некоторых солей по полусистематической и систематической номенклатуре приведены ниже:
Основные способы получения нормальных, гидро- и гидроксосолей Напомним, что условием протекания реакции в растворе электролита до конца является: а) образование плохо растворимого вещества; б) газа; в) слабого электролита; г) устойчивого комплексного аниона или катиона. Гидросоли и гидроксосоли, как правило, можно получить теми же способами, которые используют для получения нормальных солей, но при другом соотношении исходных веществ. Основные способы их получения приведены в этом разделе: 1. Реакция нейтрализации (в зависимости от соотношения основания и кислоты можно получить разные виды солей ): Fe(OH)2 + H2SO4 = FeSO4 + 2 H2O Fe(OH)2 + 2 H2SO4 = Fe(HSO4)2 + 2 H2O 2 Fe(OH)2 + H2SO4 = (FeOH)2SO4 + 2 H2O (FeOH)2SO4 + H2SO4 = 2 FeSO4 + 2 H2O 2. Взаимодействие металлов с кислотами, неметаллами и солями: Ca + H2SO4 p = CaSO4 + H2 ↑ 4 Ca + 5 H2SO4 к = 4 CaSO4 + H2S + 4 H2O Pb + H2SO4 p = PbSO4 + H2 ↑ PbSO4 + H2SO4 = Pb(HSO4)2 2 Fe + 3 Cl2 = 2 FeCl3 CuSO4 + Zn = Cu + ZnSO4 3. Реакции с участием оксидов: CaO + CO2 = CaCO3 Fe2O3 + 3 H2SO4 = Fe2(SO4)3 + 3 H2O SO3 + 2 Ca(OH)2 = (CaOH)2SO4 + H2O SO3 + Ca(OH)2 = CaSO4 + H2O 2 SO3 + Ca(OH)2 = Ca(HSO4)2 4. Реакции с участием солей (реакции обмена): Na2SO4 + BaCl2 = 2NaCl + BaSO4 CuSO4 + 2NaOH = Cu(OH)2 + Na2SO4 Na2CO3 + 2HCl = 2NaCl + H2O + CO2 Ca(HSO4)2 + Na2CO3 = CaCO3 + 2 NaHSO4 Таким образом, нормальные, гидросоли и гидроксосоли получают многими способами. При этом, использование одинаковых исходных веществ при различном их соотношении (п.1,3) позволяет получить разные соли. Достаточно много ошибок допускают при составлении названий солей. Номенклатура нормальных солей была рассмотрена выше. Однако обязательным условием составления правильных названий различных солей по полусистематической (международной) номенклатуре (наиболее широко используемой в русской учебной, научной и технической литературе) и написания их формул является хорошее знание номенклатуры кислот и кислотных остатков (см. таблицы кислот выше). 2.1.6.2. Гидросоли (кислые соли)Гидросоли представляют собой продукты неполного замещения катионов водорода в кислоте. Эти соли содержат в составе кислотного остатка один или несколько атомов водорода: Сa(HSO4)2 , KH2PO4 и др. Такого вида анионы можно обнаружить в водном растворе соли: Ca(HSO4)2 Ca2+ + 2 HSO4- Приведем примеры названий гидросолей по международной систематической номенклатуре: NaHCO3- натрий водородтриоксокарбонат NaH2PO4- натрий диводородтетраоксофосфат (V) Na2HPO4- динатрий водородтетраоксофосфат (V) NaHSO4- натрий водородтетраоксосульфат (VI) По русской номенклатуре названия кислых солей образуют из названий нормальных солей с добавлением слова «кислый». Если кислая соль образована от трех- и четырехосновных кислот, то необходимо также указывать количество замещенных атомов водорода , например: NaHCO3- кислый углекислый натрий NaH2PO4- кислый однозамещенный фосфорнокислый натрий Na2HPO4- кислый двузамещенный фосфорнокислый натрий Формулы и названия гидросолей по полусистематической (международной) номенклатуре При написании формул гидросолей необходимо помнить, что одноосновные кислоты, содержащие один атом Н (НCl, HNO3 и другие), гидросолей не образуют. Диссоциация такой кислоты приводит к образованию одного вида кислотного остатка: HCl H+ + Cl- (который входит в состав солей). Составим формулы гидросолей: гидросульфид магния (разберем последовательно по названию состав соли ): H+ S2- Mg2+ HS- кислотный остаток гидросоли ( его заряд определяют по сумме составляющих его атомов), формула соли имеет вид: Mg(HS)2. По латыни водород в русской транскрипции - гидрогениум, поэтому приставка «гидро» в названии соли по полусистематической (международной) номенклатуре указывает на присутствие одного атома водорода в составе кислотного остатка; наличие двух или трех атомов водорода отражают приставками: дигидро и тригидро. Дигидро(орто)фосфат железа (III) (приставку «орто» в данном случае можно не писать, т.к. метакислота не образует гидросолей): 2H+PO43- Fe3+ H2PO4- - кислотный остаток, соль имеет вид: Fe(HPO4)3; гидрофосфат калия: H+PO43- K+ HPO2- , соль - K2HPO4. Рассмотрим обратную задачу – по формуле соли составим ее название: NaH3SiO4 – название соли начинаем с кислотного остатка ( подчеркнут): тригидро(орто)силикат ( SiO44- - ортосиликат-ион), название соли - тригидроортосиликат натрия. Ca(HSO4)2 стехиометрический коэффициент, стоящий за скобками и указывающий количество кислотных остатков (подчеркнуты) не входит в название соли. Он вводится для сохранения ее электронейтральности (равенства положительных и отрицательных зарядов). Кислотный остаток – гидросульфат-ион, соль - гидросульфат кальция. Получают гидросоли перечисленными выше способами, наиболее часто можно использовать следующие: 1. основание + кислота (или кислотный оксид) - избыток по сравнению с получением средней соли (см. число молей кислоты на 1 моль (1 м) основания): 2KOH + H2CO3 (СО2) = K2CO3 + 2 H2O (1 ) 1 м 0,5 м карбонат калия (нормальная соль) KOH + H2CO3 = KHCO3 + H2O ( 2 ) 1 м 1 м гидрокарбонат калия (гидросоль) В реакции (2) используют избыток кислоты по сравнению с получением нормальной соли. 2. взаимодействие нормальной соли с кислотой: MgCO3 + H2CO3 (CO2 + H2O) = Mg(HCO3)2 Данная реакция происходит, например, при взаимодействии подземных вод, насыщенных углекислым газом, с карбонатными породами, содержащими CaCO3 и MgCO3. Поскольку гидросоли растворимы лучше средних солей, воду, обогащенную катионами Ca2+ и Mg2+ , называют жесткой. Такая вода при кипячении образует накипь, т.к. соли нестойчивых кислот легко разлагаются при нагревании: Mg(HCO3)2 Мыло утрачивает свою моющую способность в такой воде из-за образования нерастворимых солей органических кислот: C17H35COONa + Ca2+ = (C17H35COO)2Ca + Na+ (К) (Mg2+) (Mg2+) (K+) стеарат натрия (калия) - основа мыла Небольшое содержание катионов кальция и магния в воде является полезным для человека, т.к. Ca2+ и Mg2+ являются важными компонентами живых организмов. При их малом присутствии в воде последнюю называют мягкой водой. Гидросоли легко переходят в средние при действии оснований (желательно использовать сильные хорошо растворимые основания), происходит реакция нейтрализации: Ca(HSO4)2 + Ca(OH)2 = CaSO4 + H2O 2NaOH = Ca SO4 + Na2SO4 + H2O Часто возникает вопрос, какие соли может образовать данная кислота. Рекомендуем сначала представить схему ступенчатой диссоциации кислоты (многоосновные кислоты при диссоциации последовательно отщепляют ионы H+), такая операция позволяет определить вид всех кислотных остатков и их заряд, например: H2SO4 H+ + HSO4- (1 ступень) НSО4- Н+ + SО42- (2 ступень) При взаимодействии такой кислоты, например, с гидроксидом калия KOH, можно, используя ступенчатую диссоциацию кислоты и диссоциацию основания, проанализировать, какие соли возможны: + - + 2- KOH + H2SO4 = ? OH- + K+ H+ + HSO4- гидросульфат - ион H+ + SO42- сульфат – ион В данном случае возможно образование двух солей: KHSO4 и K2SO4. Определив виды солей, следует записать уравнения реакций их образования при различном соотношении основания и кислоты: KOH + H2SO4 = KHSO4 + H2O гидросульфат калия 2 KOH + H2SO4 = K2SO4 + H2O сульфат калия Рассмотрим еще один пример: + - + 3- NaOH + H3PO4 = OH- + Na+ H+ + H2PO4- [(2+) + (3-) =1-] * H+ + HPO42- [(1+) + (3-)= 2-] * H+ + PO43- Примечание: для определения заряда кислотных остатков, содержащих атомы водорода, рекомендуем в формуле кислоты указать заряд атома водорода (Н+) и кислотного остатка, в данном случае РО43-. Запишем формулы возможных солей: NaH2PO4 - дигидро(орто)фосфат Na Na2HPO4 - гидро(орто)фосфат Na Na3PO4 - ортофосфат Na 2.1.6.3. Гидроксосоли (основные соли)Гидроксосоли представляют собой продукт неполного замещения гидроксид-ионов основания кислотными остатками. В составе сложного катиона основной соли присутствуют один или несколько гидроксид-ионов: Al(OH)Cl2 AlOH2+ + 2Cl- Al(OH)2Cl Al(OH)2+ + Cl- По международной систематической номенклатуре названия основных солей имеют, например,следующий вид: Zn(OH)Cl- цинк гидроксид хлорид Al(OH)2NO3 – алюминий дигидроксид триоксонитрат (V) Полусистематическая (международная) номенклатура использует для основных солей термин «гидроксосоли», при этом соответствующие количественные приставки в названиях гидроксосолей указывают количество гидроксид-ионов в формуле соли. На первом месте в названии соли указывается анион кислотного остатка, приставка «гидроксо» пишется далее слитно с названием соответствующего катиона, например: Mg(OH)Cl - хлорид гидроксомагния (допускается запись без круглых скобок: MgOHCl) [(Al(OH)2]2SO4 – сульфат дигидроксоалюминия Al(OH)SO4 сульфат гидроксоалюминия В русской номенклатуре названия основных солей образовывали от средних солей с прибавлением слова «основной». Для трех- и четырехкислотных оснований указывали число замещенных гидроксид-ионов, например, (ZnOH)2SO4 – основной сернокислый цинк FeOHCl- основное хлористое железо [Al(OH)2]3PO4- основной однозамещенный ортофосфорнокислый алюминий [Al(OH)]3(PO4)2- основной двузамещенный ортофосфорнокислый алюминий Большое затруднение, обычно, возникает, как и для гидросолей, при составлении формул и названий гидроксосолей, поэтому рассмотрим этот вопрос более подробно. Формулы и названия гидроксосолей по полусистематической (международной) номенклатуре Также как в случае гидросолей, в названии гидроксосоли отражен ее состав, при этом необходимо помнить:
NaOH OH- + Na+
Составим формулы гидроксосолей по их названиям: сульфат гидроксомеди (II ), состав соли: SO42- OH- Cu2+ CuOH+ - катион соли (его суммарный заряд определяют по заряду катиона металла и гидроксид-иона или сумме зарядов OH- , если их несколько ). Формула соли имеет вид: (CuOH)2SO4. Приставка «гидроксо» указывает на присутствие в составе катиона соли одной -ОН группы, «дигидроксо» – двух -ОН групп (в растворе после диссоциации – гидроксид-ионов ОН-) . При этом напоминаем еще раз, что в первую очередь называют кислотный остаток в составе соли, а потом катион (это правило продемонстрировано в названиях средних и гидросолей ). Приведем еще два примера: нитрат гидроксоалюминия NO3- OH- Al3+ AlOH2+- катион соли, формула – AlOH(NO3)2 Сульфит дигидроксоалюминия SO32- 2OH- Al3+ Al(OH)2+ - катион соли (его суммарный заряд [(3+)+2(1-)=1+]) Формула соли: (Al(OH)2)2SO3. Теперь давайте назовем соль по ее формуле: +2 (FeOH)3PO4 - стехиометрический коэффициент, стоящий за скобками и указывающий количество катионов, не будет входить в название соли: FeOH+ - катион гидроксожелеза (II). Название соли: ортофосфат гидроксожелеза (II). +3 (Fe(OH)2)2SO4 - кислотный остаток– SO42- - сульфат-ион, Fe(OH)2+ - катион дигидроксожелеза (III), название соли -сульфат дигидроксожелеза (III). Получают гидроксосоли выше перечисленными способами. Наиболее часто встречаются следующие:
(избыток по сравнению с получением нормальной соли – см. число молей основания (м) на 1 моль кислоты). Fe(OH)2 + 2HCl = FeCl2 + H2O 0.5 м 1 м хлорид железа(II) Fe(OH)2 + HCl = Fe(OH)Cl + H2O 1м 1м хлорид гидроксожелеза (II) избыток основания ( по сравнению с предыдущей реакцией ). 2. взаимодействие средней соли с основанием: FeSO4 + Fe(OH)2 = (FeOH)2SO4 Как правило, гидроксосоли соли растворимы хуже средних солей. Так же, как гидросоли, они часто встречаются в природе в составе различных пород. Образование осадков карбонатов, хлоридов и сульфатов гидроксомеди (II) наблюдается в городах на поверхности бронзовых памятников (бронза содержит медь) при протекании ряда реакций с компонентами окружающей среды (O2, H2О, HCl, H2СО3, H2SO4 ): 2Cu + O2 + 2H2O = 2 Cu(OH)2 2Cu + O2 + 2H2SO4 = 2CuSO4 + 2H2O Cu(OH)2 + CuSO4 = (CuOH)2SO4 - зелено-голубой осадок на бронзе (патина). Гидроксосоли можно перевести в средние при добавлении кислот (рекомендуется добавлять сильную кислоту). При этом происходит реакция нейтрализации: Fe(OH)Cl + HCl = FeCl2 + H2O 2Fe(OH)Cl + H2SO4 = FeCl2 + FeSO4 + 2H2O Чтобы определить, какие гидроксосоли может образовать данное основание, необходимо рассмотреть его ступенчатую диссоциацию (основание может последовательно отщеплять гидроксид-ионы). Это позволяет определить вид и заряд всех возможных катионов в растворе данного основания: Са(ОН)2 ↔ ОН- + СаОН+ - 1 ступень – катион гидроксокальция СаOH+ ↔ OH- + Са2+ - 2 ступень – катион кальция При взаимодействии такого основания с кислотой, например HCl, могут образоваться следующие соли: Ca(OH)Cl и CaCl2. Определив виды солей, можно записать уравнения реакций их образования при различном соотношении основания и кислоты: Ca(OH)2 + HCl = Ca(OH)Cl + H2O хлорид гидроксокальция Ca(OH)2 + 2 HCl = CaCl2 + H2O хлорид кальция Рассмотрим еще один пример: 3+ 3(1-) 1+ 1- Al(OH)3 + HNO3 = ? OH- + Al(OH)2+ H+ + NO3- OH- + AlOH2+ OH- + Al3+ Примечание: для определения заряда сложного катиона соли рекомендуем указать заряд гидроксид-иона и катиона металла в формуле основания (например, Al3+ и OH- ). Как правило, при единичных заряда цифра 1 может не ставиться. Эта схема позволяет написать следующие формулы солей: Al(OH)2NO3 - нитрат дигидроксоалюминия AlOH(NO3)2 - нитрат гидроксоалюминия Al(NO3)3 - нитрат алюминия Очень часто встречаются более сложные случаи взаимодействия оснований и кислот, а именно, многоосновной кислоты и многокислотного основания. В таком случае образуется несколько видов солей (нормальная, одна или несколько гидро- и гидроксосолей). Рассмотрим пример, используя как вспомогательное действие ступенчатую диссоциацию кислоты и основания: 2+ 2 (1-) 2(1+) 2- Be(OH)2 + H2SO4 = ? OH- + BeOH+ HSO4- + H+ OH- + Be2+ SO42- + H+ Эта схема позволяет записать формулы трех солей: BeSO4 – сульфат бериллия Be(HSO4)2 - гидросульфат бериллия и (BeOH)2SO4 - сульфат гидроксобериллия. Примечание: не бывает солей, в которых присутствуют одновременно ион Н+ и ОН-, т.к. они взаимодействуют с образованием Н2О. Определив возможные соли, можно записать уравнения реакций их образования: Be(OH)2 + H2SO4 = BeSO4 + H2O Be(OH)2 + 2 H2SO4 = Be(HSO4)2 + 2H2O 2Be(OH)2 + H2SO4 = (BeOH)2SO4 + H2O Рассмотрим еще один пример: 3+ 3(1-) 2(1+) 2- Fe(OH)3 + H2SO4 = ? OH- + Fe(OH)2+ HSO4- + H+ OH- + FeOH+ SO42- + H+ OH- + Fe3+ Запишем формулы возможных солей: Fe2(SO4)3 – сульфат железа (III); Fe(HSO4)3 – гидросульфат железа (III); (Fe(OH)2)2SO4 – сульфат дигидроксожелеза (III); Fe(OH)SO4–сульфат гидроксо железа (III). Предложенная схема позволяет проанализировать, какие соли могут образоваться при взаимодействии основания с кислотой при их различном соотношении. Напомним, что гидросоли (кислые соли) и гидроксосоли (основные соли) образуются также при гидролизе средних (нормальных) солей. Примечание. При написании названий солей вы можете использовать любую разновидность химической номенклатуры, по наиболее узнаваемой и понятной для вас же будет полусистематическая (международная) номенклатура, которую мы и рекомендуем в качестве основной. Вернемся теперь к нашему заданию (п. 2). По полусистематической (международной) номенклатуре названия солей будут такими: Al2S3 – сульфид алюминия, либо сульфид Al (нормальная или средняя соль); Al(HS)3 – гидросульфид алюминия, либо гидросульфид Al (гидросоль или кислая соль); Al(OH)S – сульфид гидроксоалюминия, либо сульфид гидроксо Al (гидроксосоль или основная соль (двузамещенная)); [Al(OH)2]2S – сульфид дигидроксоалюминия, либо сульфид дигидроксо Al (гидроксоль или основная соль (однозамещенная)). Примечание: в названиях солей приставка «гидро» пишется слитно с названием аниона (кислотного остатка), в названиях основных солей приставка «гидроксо» пишется слитно с названием катиона и после названия аниона. В названиях солей катион (в нашем случае – Al(Al3+)), может быть записан либо полным названием, либо химическим символом (см. периодическую таблицу). Теперь по п.3 задания I части. Для выполнения данного задания вам рекомендуется прочитать из уже упоминавшегося «Опорного конспекта лекций по химии» раздел: «Строение атома. Периодический закон и периодическая система химических элементов Д.И. Менделеева», стр. 34-58. 2.1.7. Электронная формула атомаЭлектронная формула или электронный паспорт – это формула записи распределения электронов в атомах по энергетическим уровням и подуровням. Количество электронов в атоме равно его порядковому номеру в периодической системе. В нашем случае у Al должно быть 13 электронов, т.к. его номер 13. Электронная формула запишется так: 1s22s22p63s23p1. Запись начинается с низшего (первого) энергетического уровня. Далее следует буквенная запись энергетического подуровня, определяющего форму электрона (электронного облака). Число электронов на подуровне указывается цифрой справа у буквенного обозначения подуровня. Таким образом, из приведенной выше электронной формулы следует, что у атома алюминия на первом энергетическом уровне находится два s-электрона, на втором – восемь электронов, из них два s-электрона и шесть p-электронов, на третьем – три электрона, из них два s-электрона и один p-электрон. Графическая электронная формулы для алюминия будет выглядеть следующим образом: 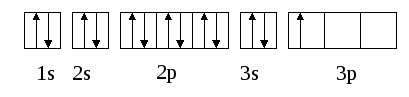 или 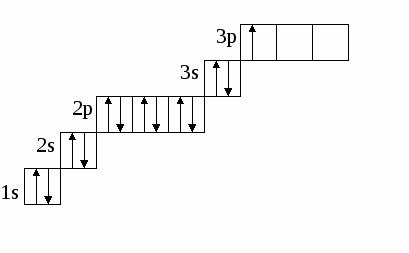 Последняя запись наглядно характеризует энергетическое состояние электронов в атоме (энергетическую диаграмму атома алюминия). 2.1.8. Валентные возможности атомовДля ответа по п.4 задания I части необходимо из рекомендованного вам «Опорного конспекта лекций по химии» (или из других учебников по химии для высшей школы) выучить раздел «Энергетическое состояние электрона в атоме» (стр. 48-50). Особое значение здесь будет играть схема относительного расположения орбиталей для многоэлектронных атомов (рис. 6(б), стр. 48). Для начала необходимо: - написать электронную формулу атома хлора: 1s22s22p63s23p5; - выделить внешние электроны: 3s23p5; - 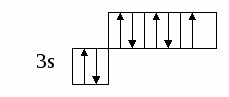 3p построить для них графическую электронную формулу (2-й вариант): Для дальнейшего ответа необходимо знать основные представления по химической связи («Опорный конспект по химии», стр. 59-63), в том числе: - основное и возбужденное состояние электронов в атоме (стр. 49); - обменный механизм образования ковалентной химической связи (стр. 62); - донорно-акцепторный механизм образования ковалентной химической связи (стр. 62). Примечание. При рассмотрении валентных возможностей атомов следует учитывать указанные возможности по образованию прежде всего ковалентного типа связи (неполярной и полярной). К тому же следует понимать, что валентные возможности и конкретная валентность (ковалентность) - разные понятия. Валентные возможности – это теоретическая «максимальная» валентность, которая, как правило, всегда меньше валентности конкретных атомов элементов в реально существующих соединениях. При этом, численная величина валентных возможностей, как и численная величина валентности, знака не имеет. При определении валентных возможностей необходимо найти максимально возможные значения валентных возможностей того или иного атома, а также их количество по обменному и донорно-акцепторному механизмам образования ковалетной химической связи. Определение валентных возможностей корректно проводить для атомов неметаллов или полуметаллов, которые могут образовывать химические соединения с ковалентным типом (характером) химической связи. Для определения валентных возможностей атома хлора в нормальном состоянии необходимо: - сосчитать количество свободных внешних электронов и количество электронных пар или количество свободных атомных ячеек на последнем задействованном энергетическом подуровне. (Задействованным подуровнем считается такой, на котором в нормальном (невозбужденном) состоянии имеется хотя бы один электрон). В нашем случае количество неспаренных электронов у атома хлора в нормальном состоянии равно 1. - сосчитать количество электронных пар на внешних подуровнях. В нашем случае их 3 – одна на подуровне 3s и две на подуровне 3p. Таким образом, валентные возможности (В.в.) атома хлора в нормальном состоянии равны 4: В.в. (Cl) = 1обм + 3дд.а., в том числе одна по обменному механизму (обм), три – по донорно-акцепторному (д.а.), где атом хлора выступает в качестве донора (д.), т.е. атома, предоставляющего при образовании ковалентной химической связи электронную пару. Формальная схема реализации таких возможностей представлена ниже: 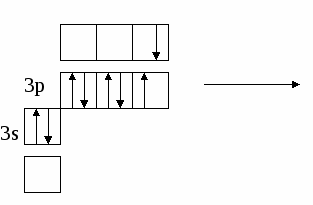 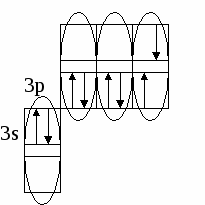 Для определения валентных возможностей атома хлора в возбужденном состоянии необходимо: - построить для атома хлора графическую электронную формулу (2-й вариант) с учетом ближайшего незаполненного энергетического подуровня. В нашем случае – это 3d-подуровень (рис. 6, стр. 48. «Опорный конспект лекций по химии»). Г 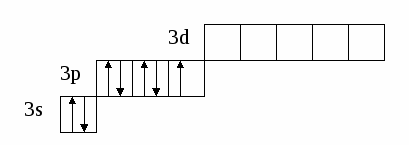 рафическая электронная формула будет выглядеть следующим образом: рафическая электронная формула будет выглядеть следующим образом:Отметим, что при возбуждении электронов, т.е. переводе их на более высокий энергетический подуровень того же энергетического уровня, определяемого значением главного квантового числа n (в нашем случае n=3), энергетические затраты (Ев) не столь значительные и могут быть скомпенсированы при образовании химической связи (Ехс). При переходе электрона с энергетического подуровня одного электронного слоя на энергетический подуровень другого электронного слоя, энергетические затраты (Е1в) оказываются больше, чем выигрыш энергии при образовании химической связи, т.е. такая валентная возможность не может быть даже формально реализована ни в каких химических соединениях. Поэтому такие валентные возможности не учитываются. Вышесказанное поясняют схемы, приведенные ниже. 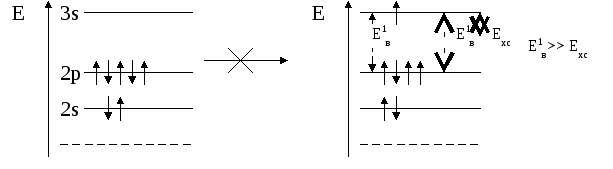 О 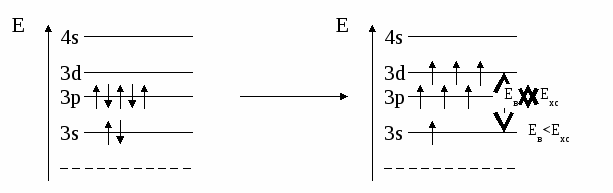 бразование химической связи энергетически невыгодно. бразование химической связи энергетически невыгодно.Образование химической связи энергетически возможно. Таким образом, в нашем случае распределение электронов для атома хлора в возбужденном состоянии будет выглядеть следующим образом: 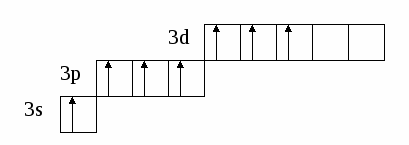 Исходя из данной графической формулы, валентные возможности атома хлора в возбужденном состоянии (Cl*) равны 9: В.в. (Cl*) = 7обм + 2ад.а., в том числе семь по обменному механизму (обм), две – по донорно-акцепторному в качестве акцептора (а), т.е. атома предоставляющего свободные атомные ячейки на задействованном энергетическом уровне. Формальная схема гипотетической реализации таких возможностей представлена ниже: 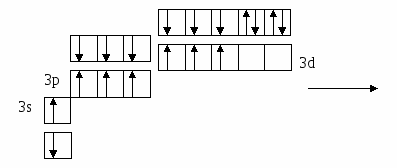 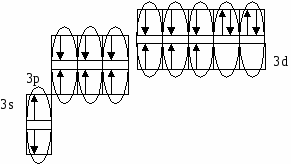 Еще раз подчеркнем, что такие максимальные валентные возможности, как правило, не могут быть реализованы в реальных химических соединениях, в частности из-за геометрических размеров атомов. 2.2. II часть контрольного заданияПусть ваше задание по II части сформулировано следующим образом: «Написать (последовательно) химические процессы, происходящие при контакте алюминия с раствором сульфида лития. Обосновать возможность их протекания». а) Сначала рассмотрим металл. В нашем случае это алюминий. Какой это металл по активности? Из школьного курса вы знаете, что Al, также как щелочные и щелочноземельные металлы, относятся к активным металлам. А это значит, что он на воздухе обязательно будет реагировать с кислородом воздуха, т.е. будет покрыт оксидной пленкой Al2O3. Таким образом, при рассмотрении процессов, происходящих в нашей системе, необходимо учитывать наличие не только самого металла, но и его оксидной пленки. Следовательно, прежде чем рассматривать реакции с участием алюминия, необходимо рассмотреть реакции с участием его оксида. Для этого следует определить его свойства. Из «Опорного конспекта лекций по химии», стр. 23, вы узнаете, что оксид алюминия обладает амфотерными свойствами. В результате по рассматриваемому заданию у нас есть следующая информация:
б) Далее рассмотрим раствор соли. В нашем случае это сульфид лития и вода: Li2S + H2О. Что это за соль? Данная соль, образована сильным основанием (LiOH) и слабой кислотой (H2S). А такие соли в воде подвергаются гидролизу («Опорный конспект лекций по химии», стр. 131-134):  Li2S + H2О LiHS + LiOH Li2S + H2О LiHS + LiOHВ случае таких солей, также как и в случае солей, образованных слабым основанием и сильной кислотой, гидролиз практические идет только по первой ступени. Кроме того, не будем забывать, что гидролиз во многих случаях, и в нашем тоже, является обратимым процессом. Об этом свидетельствуют противоположно направленные стрелки. Давайте запишем процесс гидролиза в ионном виде. В отличие от записи реакции в молекулярной форме (см. ранее), такая запись реакции дает нам возможность более наглядно определить характер среды, образующейся в результате гидролиза (иногда говорят «определить реакцию среды»). В нашем случае запись реакции в ионном виде (ионной форме) запишется так:  Li+ + S2- + H2O Li+ + HS- + Li+ + OH- , рН > 7 Li+ + S2- + H2O Li+ + HS- + Li+ + OH- , рН > 7в  сокращенном ионном виде: сокращенном ионном виде:S2- + H2O HS- + OH- Примечание. Для правильной записи реакции в ионном виде следует вспомнить, что малодиссоциирующие соединения (в нашем случае H2O), а также слабые кислоты, слабые основания и их остатки (в нашем случае HS-) на ионы не раскладываются. Из записи реакции в ионном виде наглядно видно, что в результате гидролиза соли Li2S в продуктах реакции наблюдается появление гидроксид–ионов OH-, т.е. среда становится щелочной. Используя водородный показатель можно записать, что в нашем случае pH>7. в) Далее нам следует рассмотреть: как будет вести себя оксидированный с поверхности алюминий, когда он будет находиться в контакте с частично гидролизованным сульфидом лития в щелочной среде. Зная, что амфотерные оксиды взаимодействуют с сильными основаниями (а LiOH – одно из них) образуя соль и воду, запишем: A  l2O3 + LiOH LiAlO2 + H2O l2O3 + LiOH LiAlO2 + H2OТаким образом, оксидная пленка может раствориться. С чем теперь может взаимодействовать Al? Кислоты нет, по сравнению с Li он менее активен (см. ряд активности, «Опорный конспект лекций по химии», стр. 140), т.е. не может вытеснить литий из его солей. Остается вода. Из школьного курса химии мы знаем, что активные металлы способны вытеснять водород из воды: 2  Al + 6H2O 2Al(OH)3 + 3H2↑ Al + 6H2O 2Al(OH)3 + 3H2↑Давайте докажем, что в нашем случае, т.е. в условиях щелочной среды, такая окислительно-восстановительная реакция действительно будет происходить. (Об окислительно-восстановительных реакциях см. «Опорный конспект лекций по химии», стр. 135-141). Для этого запишем для этой реакции процессы окисления и восстановления: A  2 l – 3ē = Al+3, процесс окисления; 2 3 H+ + 2ē = H2, процесс восстановления. Затем, возьмем численные данные по стандартным окислительно-восстановительным потенциалам (Е0 или φ0), характеризующие указанные процессы. Эти данные есть во многих учебниках или учебных пособиях по химии (см. также «Опорный конспект лекций по химии», стр. 159). Для алюминия это потенциал Ео равен -1,66 (В), для водорода в щелочной среде потенциал Ео равен -0,83 (В). Данное значение Ео для водорода получаем, используя уравнение Нернста («Опорный конспект лекций по химии», стр. 141). Поскольку LiOH – сильное основание (щелочь), то значение рН будет не просто больше 7, а значительно больше, поскольку в результате гидролиза Li2S среда будет сильнощелочной, рН = 10 Реакция способная протекать самопроизвольно, если разность потенциалов ΔЕ, характеризующих процесс восстановления и окисления (ЭДС реакции), будет больше нуля. В нашем случае: Е = -0,83 – (-1,66) = 0,83 (В) Вывод: алюминий в щелочной среде способен вытеснить водород из воды. В результате данной окислительно-восстановительной реакции, наряду с водородом, образуется и гидроксид алюминия Al(OH)3, который, как и оксид алюминия Al2O3, обладает амфотерными свойствами. В дальнейшем, гидроксид алюминия будет взаимодействовать со щелочью, которая есть в нашей системе: A  l(OH)3 + LiOH LiAlO2 + H2O l(OH)3 + LiOH LiAlO2 + H2OПримечание. Гидроксид алюминия является промежуточным соединением. Его не следует указывать в конечных продуктах. Теперь нам остается подвести итоги и написать заключительную реакцию. В левой и правой части оставим только те вещества, которые принимали участие в реакциях и образовались в результате рассмотренных взаимодействий: 2Al + 2Li2S + 4H2O = 2LiHS + 2LiAlO2 + 3H2↑ Примечание. Воду записываем только в левой части реакции (где ее больше). Таким образом в окружающую среду в качестве конечных продуктов поступят: гидросульфид лития, метаалюминат лития и водород. Не забудем также, что среда в этом месте будет щелочной (в данном случае гидролиз – обратимый процесс, при расходовании LiOH новые порции соли Li2S будут гидролизоваться с образованием того же LiOH). Заключение по II части контрольного задания По указанному алгоритму следует рассматривать все контрольные задания II части, которые вы получили. Следует, конечно, понимать, что в каких-то заданиях в результате гидролиза среда может получиться кислой (pH<7), и тогда не только оксид, но и сам металл будет способен растворяться в кислоте. В необходимых случаях реальность такой возможности следует проверить, используя ЭДС реакции. Следует помнить, что если вам в подобном задании дан активный металл (Al, Zn и т.д.) и соль менее активного металла (Cu, Fe и т.д.), то после растворения оксидной пленки активный металл сначала вытеснит менее активный из его соли (см. ряд активности металлов: «Опорный конспект лекций по химии», стр. 140). Будет ли вытесненный неактивный металл далее с чем-то взаимодействовать – зависит от состава кислотной среды. Если среда – раствор азотной кислоты, то будет, если среда – растворы серной, соляной и других сильных кислот, то необходимо предварительно вычислить ЭДС окислительно-восстановительных реакций, как было показано ранее. 2.2.1. Основные положения по II части контрольного задания
Примечание. При подготовке ответов на контрольные задания рекомендуется использовать указанное в тексте основные учебное пособие: «Химия. Опорный конспект лекций для студентов заочной и дистанционной форм обучения». Изд. СПбГТУ, 2001. (См. также список литературы). 3. Порядок сдачи экзамена по курсу «Химия»Для допуска к сдаче экзамена по курсу «Химия» необходимо:
4. Список литературыОсновная литература
Дополнительная литература
5. Приложения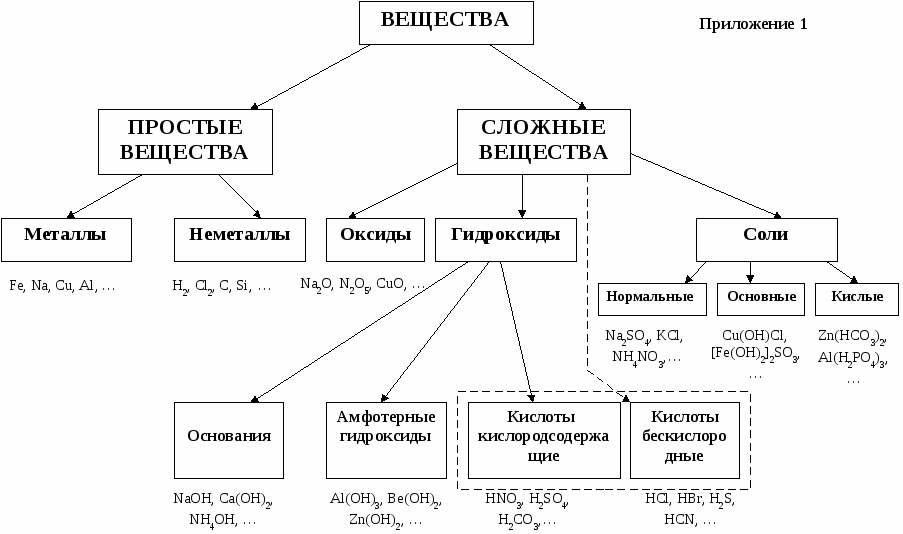 Рис. 1. Общая схема классификации неорганических соединений  Приложение 2 Рис. 2. Схема классификации оксидов Блинов Лев Николаевич ХИМИЯ Контрольные задания и методические указания по их выполнению для студентов заочной и дистанционной форм обучения Компьютерная версия В.В. Климов |
