Пособие-Приготовление-проб-и-растворов. Методическое пособие для изучения мдк. 02. 01 Основы приготовления проб и растворов различной концентрации
 Скачать 80.26 Kb. Скачать 80.26 Kb.
|
N =Р 1000/Э Vгде Р — количество вещества в граммах; Э — эквивалентная масса вещества; V — объем раствора в миллилитрах. ЭNа2со3=53,002, тогда нормальная концентрация данного раствора 2,6501* 1000 / 53,002*200=0,25 5.Перерасчет концентрации из одного вида в другой. В лабораторной практике часто приходится проводить пересчет концентрации имеющихся растворов из одних единиц в другие. При пересчете процентной концентрации в молярную и наоборот необходимо помнить, что процентная концентрация рассчитывается на определенную массу раствора, а молярная и нормальная — на объем, поэтому для пересчета необходимо знать плотность раствора. Плотность раствора приводится в справочниках в соответствующих таблицах или измеряется ареометром. Если мы обозначим: С — процентная концентрация; М — молярная концентрация; N — нормальная концентрация; d — плотность раствора; Э — эквивалентная масса; m — мольная масса, то формулы для пересчета из процентной концентрации в молярную и нормальную будут следующими: 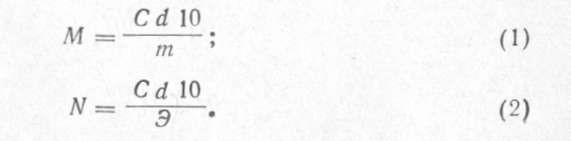 Пример 1. Какова молярная и нормальная концентрация 12% раствора серной кислоты, плотность которого d=l,08 г/см?? Решение. Мольная масса серной кислоты равна 98. Следовательно, Э н2so4 =98:2=49. Подставляя необходимые значения в формулы, получим: молярная концентрация 12% раствора серной кислоты равна М=12*1,08 *10/98=1,32 М; нормальная концентрация 12% раствора серной кислоты равна N =12*1,08*10/49= 2,64 н. Пример 2. Какова процентная концентрация 1 н. раствора соляной кислоты, плотность которого 1,013? Решение. Мольная масса НСI равна 36,5, следовательно, Энс1= 36,5. Из приведенной выше формулы (2) получим: C=N*Э/10d следовательно, процентная концентрация 1 н. раствора соляной кислоты равна 36,5*1/ 1,013*10 =3,6% Иногда в лабораторной практике приходится пересчитывать молярную концентрацию в нормальную и наоборот. Если эквивалентная масса вещества равна мольной массе (например, КОН), то нормальная концентрация равна молярной концентрации. Так, 1 н. раствор соляной кислоты будет одновременно 1 М раствором. Однако для большинства соединений эквивалентная масса не равна мольной и, следовательно, нормальная концентрация растворов этих веществ не равна молярной концентрации. Для пересчета из одной концентрации в другую мы можем пользоваться формулами: М = (NЭ)/m ; N=M(m/Э)Пример 3. Нормальная концентрация 1М раствора серной кислоты Ответ-2М Пример 4, Молярная концентрация 0,5 н. раствора Na2CО3 Ответ-0.25Н При пересчете процентной концентрации в молярную и наоборот, необходимо помнить, что процентная концентрация рассчитывается на определенную массу раствора, а молярная и нормальная - на объем, поэтому для пересчета необходимо знать плотность раствора. Если мы обозначим: с - процентная концентрация; M - молярная концентрация; N - нормальная концентрация; э - эквивалентная масса, r - плотность раствора; m - мольная масса, то формулы для пересчета из процентной концентрации будут следующими: = (c · p · 10) / m = (c · p · 10) / э Этими же формулами можно воспользоваться, если нужно пересчитать нормальную или молярную концентрацию на процентную. Иногда в лабораторной практике приходится пересчитывать молярную концентрацию в нормальную и наоборот. Если эквивалентная масса вещества равна мольной массе (Например, для HCl, KCl, KOH), то нормальная концентрация равна молярной концентрации. Так, 1 н. раствор соляной кислоты будет одновременно 1 M раствором. Однако для большинства соединений эквивалентная масса не равна мольной и, следовательно, нормальная концентрация растворов этих веществ не равна молярной концентрации. Для пересчета из одной концентрации в другую можно использовать формулы: = (N · Э) / m = (M · m) / Э Смешение и разбавление растворов. Если раствор разбавить водой, то его концентрация изменится обратно пропорционально изменению объема. Если от разбавления объем раствора увеличится в два раза, то и его концентрация уменьшится в два раза. При смешении нескольких растворов уменьшаются концентрации всех смешиваемых растворов. При смешении двух растворов одного и того же вещества, но разных концентраций, получается раствор новой концентрации. Если смешать а% и б% растворы, то получим раствор с% концентрации, причем если а>б, то а>с>б. Новая концентрация ближе к концентрации того раствора, которого при смешении было взято большее количество. Закон смешения растворов Количества смешиваемых растворов обратно пропорциональны абсолютным разностям между их концентрациями и концентрацией получившегося раствора. Закон смешения можно выразить математической формулой: mA/mB =С-b/а-с, где mA,mB –количества растворов А и В, взятые для смешения; a, b, c-соответственно концентрации растворов А и В и раствора, полученного в результате смешения . Если концентрация выражена в %, то количества смешиваемых растворов нужно брать в весовых единицах; если концентрации взяты в молях или нормалях, то количества смешиваемых растворов нужно выражать только в литрах. Для облегчения использования правила смешивания применяют правило креста: 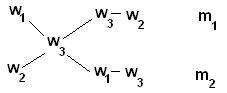 m1 / m2 = (w3 – w2) / (w1 – w3) Для этого по диагонали из большего значения концентрации вычитают меньшую, получают (w1 – w3), w1 > w3 и (w3 – w2), w3 > w2. Затем составляют отношение масс исходных растворов m1 / m2 и вычисляют. Пример Определите массы исходных растворов с массовыми долями гидроксида натрия 5% и 40%, если при их смешивании образовался раствор массой 210 г с массовой долей гидроксида натрия 10%. 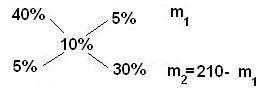 5 / 30 = m1 / (210 - m1) 1/6 = m1 / (210 – m1) 210 – m1 = 6m1 7m1 = 210 m1 =30 г; m2 = 210 – m1 = 210 – 30 = 180 г ТЕХНИКА ПРИГОТОВЛЕНИЯ РАСТВОРОВ. Если растворителем служит вода, то нужно применять только дистиллированную или диминерализованнную воду. Предварительно приготавливают соответствующий емкости посуды, в которой будут готовить и хранить получаемый раствор. Посуда должна быть чистой. Если есть опасения, что водный раствор может взаимодействовать с материалом посуды, то посуду внутри следует покрыть парафином или другими химически стойкими веществами. Перед приготовлением растворов нужно подготовить по возможности 2 одинаковых сосуда: один - для растворения, а другой - для хранения раствора. Вымытый сосуд предварительно проградуировать. Для растворения следует применять чистые вещества. Готовые растворы обязательно проверяют на содержание нужного вещества и, если это будет необходимо, поправляют раствор. Нужно применять меры для защиты приготовленных растворов от попадания в них пыли или газов, с которыми могут реагировать некоторые растворы. Во время приготовления и во время хранения растворов, бутыли или другая посуда обязательно должны быть закрыты пробками. При особо точных анализов следует принимать во внимание возможность выщелачивания стекла и применять, если это допустимо, кварцевую посуду. При этом растворы лучше оставлять в фарфоровой посуде, а не в стеклянной. 1. Техника приготовления растворов солей. Приблизительные растворы. Готовый раствор или отфильтровывают, или дают ему отстоятся от нерастворимых в воде примесей, после чего при помощи сифона отделяют прозрачный раствор. Полезно проверит концентрацию каждого приготовленного раствора. Это легче всего сделать, измерив ареометром плотность и сравнить полученную величину с табличными данными. Если раствор имеет концентрацию меньше заданной, к нему добавляют нужное количество растворяемого твердого вещества . Если же раствор имеет концентрацию больше заданной – добавляют в воду и доводят концентрацию до требуемой. Точные растворы. Точные растворы солей чаще всего готовят для аналитических целей, причем обычно нормальной концентрации. Некоторые из точных растворов недостаточно стойки при хранении и могут изменяться под действием света или кислорода, или других органических примесей, содержащихся в воздухе. Такие точные растворы периодически проверяют. В точном растворе серноватистокислого натрия при стоянии часто наблюдается выпадение хлопьев серы. Это является результатом жизнедеятельности особо вида бактерий. Растворы марганцевокислого калия изменяются при действии на них света, пыли и примесей органического происхождения. Растворы азотнокислого серебра разрушаются при действии света. Поэтому большие запасы точных растворов солей, нестойки к хранению, иметь не следует. Растворы таких солей хранят с соблюдением известных мер предосторожности. От действия света изменяются растворы : AgNO3, KSCN, NH4SCN, KI, I2, K2Cr2O7. Техника приготовления растворов кислот. В большинстве случаев в лаборатории пользуются растворами соляной, серной и азотной кислот. В лаборатории поступают концентрированные кислоты ; процентное содержание кислот определяют по плотности. Для приготовления раствора колбу объемом 1 литр заливают дистиллированную воду ( на половину), добавляют нужное количество вещества с определенной плотностью, размешивают , а после объем добавляют до литра. При разбавлении происходит сильное разогревание колб. Точные растворы готовят точно также, используя химически чистые препараты. Растворы готовят более высокой концентрации, которую далее разбавляют водой. Растворы точной концентрации проверяют титрованием углекислым натрием (Na2CO3) или кислым углекислым калием(KHCO3) и «поправляют». Техника приготовления растворов щелочей. Наиболее употребительным является раствор едкого натра (NaOH).Первоначально из твердого вещества готовят концентрированный раствор (примерно 30-40%).При растворении происходит сильное разогревание раствора. Как правило, щелочь растворяют в фарфоровой посуде. Следующим этапом является отстаивание раствора. Затем прозрачную часть сливают в другую емкость. Такую емкость снабжают хлоркальцевой трубкой для поглощения углекислого газа .Для приготовления раствора приблизительной концентрации определяют плотность с помощью ареометра. Хранение концентрированных растворов в стеклянной посуде разрешается, если поверхность стекла покрыта парафином, т.к в ином случае происходит выщелачивание стекла. Для приготовления точных растворов используют химически чистую щелочь. Приготовленный раствор проверяют титрованием щавелевой кислотой, поправляют. Приготовление рабочего раствора из фиксанала. Фиксаналы— это точно отвешенные количества твердых химически чистых веществ или точно отмеренные объемы их растворов, помещенные в запаянные стеклянные ампулы. Фиксаналы приготовляют на химических заводах или в специальных лабораториях. Чаще всего ампула содержит 0,1 пли 0,01 г-экв вещества. Большинство фиксаналов хорошо сохраняется, однако некоторые из них с течением времени изменяются. Так, растворы едких щелочей по истечении 2—3 месяцев мутнеют вследствие взаимодействия щѐлочи со стеклом ампулы. Чтобы приготовить раствор из фиксанала, содержимое ампулы количественно переносят в мерную колбу, раствор разбавляют дистиллированной водой, доводя его объем до метки. Делают это следующим образом: находящиеся в коробке с фиксаналом бойки обмывают сначала водопроводной, а потом дистиллированной водой. Один боек вставляют в чистую химическую воронку 3 таким образом, чтобы длинный конец бойка вошел в трубку воронки, а короткий(острый) конец его был направлен кверху; крестовидное утолщение бойка упирается в нижнюю часть корпуса воронки. Воронку вместе с бойком вставляют в чистую мерную колбу. Ампулу обмывают сначала теплой, а затем холодной дистиллированной водой, чтобы смыть этикетку и загрязнения. Дно хорошо вымытой ампулы ударяют (там где углубление) о боек в воронке и разбивают дно ампулы. Не изменяя положения ампулы над воронкой, вторым бойком пробивают верхнее углубление на ней. Содержимое ампулы выливается (или высыпается) в мерную колбу. Не изменяя положения ампулы, в образовавшееся верхнее отверстие вставляют оттянутый в капилляр конец трубки промывалки и сильной струей промывают ампулу изнутри. Затем струей воды из промывалки хорошо промывают наружную поверхность ампулы и воронку с бойком. Удалив ампулу из воронки, доводят уровень жидкости в колбе до метки. Колбу плотно закрывают пробкой и тщательно перемешивают раствор. ТЕХНИКА ОПРЕДЕЛЕНИЯ КОНЦЕНТРАЦИИ РАСТВОРОВ. Концентрацию вещества в растворе определяют денсиметрией и титриметрическими методами. 1.Денсиметрией измеряют величину плотности раствора, зная которую по таблицам определяют весовую % концентрацию. 2.Титриметрический анализ-метод количественного анализа, в котором измеряют количество реактива, затраченного в ходе химической реакции. 1. Определение концентрации денсиметрией. Понятие плотности Плотность — физическая величина, определяемая для однородного вещества массой его единичного объѐма. Для неоднородного вещества плотность в определѐнной точке вычисляется как предел отношения массы тела (m) к его объѐму (V), когда объѐм стягивается к этой точке. Средняя плотность неоднородного вещества есть отношение m/V. Плотность вещества зависит от массы атомов, из которых оно состоит, и от плотности упаковки атомов и молекул в веществе. Чем больше масса атомов, тем больше плотность. Виды плотности и единицы измерения Плотность измеряется в кг/м³ в системе СИ и в г/см³ в системе СГС, остальные (г/мл, кг/л, 1 т/M3) – производные. Для сыпучих и пористых тел различают: - истинную плотность, определяемую без учѐта пустот -кажущуюся плотность, рассчитываемую как отношение массы вещества ко всему занимаемому им объѐму. Зависимость плотности от температуры Как правило, при уменьшении температуры плотность увеличивается, хотя встречаются вещества, чья плотность ведет себя иначе, например, вода, бронза и чугун. Так, плотность воды имеет максимальное значение при 4 °C и уменьшается как с повышением, так и с понижением температуры. 2. Определение концентрации титриметрическим анализом В титриметрическом анализе заставляют реагировать два раствора и как можно точнее определяют момент окончания реакции. Зная концентрацию одного раствора, можно установить и точную концентрацию другого. В каждом методе используются свои рабочие растворы, индикаторы, решаются соответствующие типовые задачи. В зависимости от типа реакции, которая происходит во время титрования, различают несколько методов объемного анализа. Из них наиболее часто применяют: 1.Метод нейтрализации. Основной реакцией служит реакция нейтрализация: взаимодействие кислоты с основанием. 2.Метом оксидиметрии, включающий методы перманганатометрии и йодометрии. В основе лежат реакции окисления-восстановления. 3.Метод осаждения. В основе лежат реакции образования малорастворимых соединений. 4.Метод комплексонометрии- на образование малодиссоциирующих комплексных ионов и молекул. Основные понятия и термины титриметрического анализа. Титрант - раствор реагента известной концентрации (стандартный раствор). Стандартный раствор – по способу приготовления различают первичные вторичные стандартные растворы. Первичный готовят растворением точного количества чистого химического вещества в определенном количестве растворителя. Вторичный готовят приблизительной концентрации и определяют его концентрацию по первичному стандарту. Точка эквивалентности – момент, когда в добавленном объеме рабочего раствора содержится количество вещества эквивалентное количеству определяемого вещества. Цель титрования - точное измерение объемов двух растворов, в которых содержится эквивалентное количество вещества Прямое титрование – это титрование определенного вещества «А» непосредственно титрантом «Б». Его применяют в том случае, если реакция между «А» и «Б» протекает быстро. Схема титриметрического определения. Для проведения титриметрического определения необходимы стандартные (рабочие) растворы, то есть растворы с точной нормальностью или титром. Такие растворы готовят по точной навеске или приблизительной, но тогда точную концентрацию устанавливают титрованием, используя растворы установочных веществ. Для кислот установочными растворами являются: тетраборат натрия (бура), оксалат натрия, оксалат аммония. Для щелочей: щавелевая кислота, янтарная кислота Приготовление раствора включает три этапа: Расчет навески Взятие навески Растворение навески Если концентрацию устанавливают по точной навеске, еѐ взвешивают на аналитических весах. Если концентрация не может быть установлена по точной навеске, то еѐ берут на технохимических весах, а в случае жидких веществ отмеривают рассчитанный объем. Для определения точной концентрации проводят титрование, которое заключается в том, что два раствора реагируют между собой и с помощью индикатора фиксируется точка эквивалентности. Концентрация одного из растворов (рабочего) точно известна. Как правило, он помещается в бюретку. Второй раствор с неизвестной концентрацией отбирают в конические колбы пипеткой в строго определенных объемах (метод пипетирования), либо растворяют точную навеску в произвольном количестве растворителя (метод отдельных навесок). В каждую колбу добавляют индикатор. Проводят титрование не менее 3 раз, до сходящихся результатов, разница между результатами не должна превышать 0,1 мл. Заканчивается определение расчетом результатов анализа. Важнейшим моментом является фиксирование точки эквивалентности. Шесть правил титрования. 1.Титрование проводят в конических стеклянных колбах; 2.Содержимое колбы перемешивают вращательными движениями, не убирая колбу из-под бюретки. 3. Оттянутый конец бюретки должен быть на 1 см ниже верхнего края колбы. Уровень жидкости в бюретке устанавливают на нулевой отметке перед каждым титрованием. 4.Титруют малыми порциям – по каплям. 5.Титрование повторяют не менее 3 раз, до получения сходящихся результатов с отличием не более чем 0,1 мл. 6.После окончания титрования отсчет делений проводят через 20-30 секунд, чтобы дать возможность стечь жидкости, оставшейся на стенках бюретки. Условия титриметрического определения концентрации вещества. В объемном анализе основной операцией является измерение объема двух взаимодействующих растворов, один из которых содержит анализируемое вещество, а концентрация второго заранее известна. Неизвестную концентрацию анализируемого раствора определяют, зная соотношение объемов реагирующих растворов и концентрацию одного из них. Для успешного проведения объемного анализа необходимо соблюдение следующих условий: Реакция между реагирующими веществами должна идти до конца и протекать быстро и количественно. Так как при титровании нужно точно установить момент эквивалентности или фиксировать точку эквивалентности, конец реакции между растворами должен быть хорошо заметен по изменению окраски раствора или по появлению окрашенного осадка. Для установления точки эквивалентности при объемном анализе часто применяют индикаторы Концентрация раствора одного из растворов (рабочего раствора) должна быть точно известна. Другие вещества, находящиеся в растворе, не должны мешать основной реакции. Приготовление стандартных растворов. 1. Приготовление титрованного раствора по точной навеске исходного вещества Основным раствором в объемном анализе является титрованный, или стандартный - раствор исходного реактива, при титровании которым определяют содержание вещества в анализируемом растворе. Самым простым способом приготовления раствора точно известной концентрации, т.е. характеризующегося определенным титром, является растворение точной навески исходного химически чистого вещества в воде или в другом растворителе и разбавление полученного раствора до требуемого объема. Зная массу (а) растворенного в воде химически чистого соединения и объем (V) полученного раствора, легко вычислить титр (Т) приготовленного реактива: T = a/V (г/мл) Этим способом готовят титрованные растворы таких веществ, которые можно легко получить в чистом виде и состав которых отвечает точно определенной формуле и не изменяется в процессе хранения. Прямой метод приготовления титрованных растворов применяют лишь в отдельных случаях. Таким путем нельзя приготовить титрованные растворы веществ, которые отличаются большой гигроскопичностью, легко теряют кристаллизационную воду, подвергаются действию диоксида углерода воздуха и т.д. 2. Установка титра раствора при помощи установочного вещества Этот способ установки титров основан на приготовлении раствора реактива приблизительно требуемой нормальности и последующем точном определении концентрации полученного. Титр или нормальность приготовленного раствора определяют, титруя им растворы так называемых установочных веществ. Установочным веществом называют химически - чистое соединение точно известного состава, применяемое для установки титра раствора другого вещества. На основании данных титрования установочного вещества вычисляют точный титр или нормальность приготовленного раствора. Раствор химически чистого установочного вещества готовят растворением в воде вычисленного его количества (взвешенного на аналитических весах) и последующим доведением объема раствора до определенной величины в мерной колбе. Отдельные (аликвотные) части приготовленного таким образом раствора отбирают из мерной колбы пипеткой в конические колбы и титруют их раствором, титр которого устанавливают. Титрование проводят несколько раз и берут средний результат. ВЫЧИСЛЕНИЯ В ОБЪЕМНОМ АНАЛИЗЕ. Вычисление нормальности анализируемого раствора по нормальности рабочего раствора При взаимодействии двух веществ грамм-эквивалент одного вещества реагирует с грамм-эквивалентом другого. Растворы различных веществ одной и той же нормальности содержат в равных объемах одинаковое число грамм-эквивалентов растворенного вещества. Следовательно, одинаковые объемы таких растворов содержат эквивалентные количества вещества. Поэтому, например, для нейтрализации 10 мл 1н. HCI требуется затратить ровно 10 мл 1н. раствора NaOH. Растворы одинаковой нормальности вступают в реакцию в равных объемах. Зная нормальность одного из двух реагирующих растворов и их объемы, расходуемые на титрование друг друга, легко определить неизвестную нормальность второго раствора. Обозначим нормальность первого раствора через N2 и его объем через V2. Тогда на основании сказанного можно составить равенство V1N1=V2N2 Вычисление титра по рабочему веществу. Это выраженная в граммах масса растворѐнного вещества, содержащаяся в одном миллилитре раствора. Вычисляют титр как отношение массы растворенного вещества к объему раствора (г/мл). Т= m/ V где: m -- масса растворѐнного вещества, г; V -- общий объѐм раствора, мл; Т=Э*N/1000.(г /мл) Иногда для обозначения точной концентрации титрованных растворов пользуются так называемым поправочным коэффициентом или поправкой К. К= фактически взятая навеска/ рассчитанная навеска. Поправка показывает, на какое число нужно умножить объем данного раствора, чтобы привести ее к объему раствора определенной нормальности. Очевидно, что если поправка для данного раствора больше единицы, то действительная нормальность его больше нормальности, принимаемой за эталон; если же поправка меньше единицы, то фактическая нормальность раствора меньше эталонной нормальности. Пример: Из 1,3400 г х. ч. NaCl приготовлено 200 мл раствора. Вычислите поправку для приведения концентрации приготовленного раствора к точно О,1 н. Решение. В 200 мл О,1н. раствора NaCl должно содержаться 58,44*0,1*200/1000 =1,1688г Отсюда: К=1,3400/1,1688=1,146 Можно вычислить поправку как отношение титра приготовленного раствора к титру раствора определенной нормальности: К= Титр приготовленного раствора/титр раствора определенной нормальности В нашем примере титр приготовленного раствора равен 1,340/200= 0,00670 г/мл Титр 0,1 Н раствора NaCl равен 0,005844г/мл Отсюда К= 0,00670/0,005844=1,146 Вывод: Если поправка для данного раствора больше единицы то действительная нормальность его больше нормальности, принимаемой за эталон; Если поправка меньше единицы, то действительная нормальность его меньше эталонной. 3. Вычисление количества определяемого вещества по титру рабочего раствора, выраженному в граммах определяемого вещества. Титр рабочего раствора в граммах определяемого вещества равен числу граммов определяемого вещества, которое эквивалентно количеству вещества, содержащегося в 1 мл рабочего раствора. Зная титр рабочего раствора по определяемому веществу T и объем рабочего раствора, израсходованного на титрование, можно вычислить число граммов (массу) определяемого вещества. Пример. Вычислить процентное содержание Na2CO3 в образце, если для титрования навески 0, 100 гр. израсходовано 15,00 мл 0,1н. HCI. Решение. М (Na2CO3) =106,00 гр. Э(Na2CO3) =53,00 гр. Т(HCI/ Na2CO3)= Э(Na2CO3)* N HCI./1000 г/мл m(Na2CO3) = Т(HCI/ Na2CO3) VHCI=0,0053*15,00=0,0795 г. Процентное содержание Na2CO3 равно 79,5% 4. Вычисление числа миллиграмм-эквивалентов исследуемого вещества. Помножив нормальность рабочего раствора на объем его, израсходованный на титрование исследуемого вещества, получим число миллиграммэквивалентов растворенного вещества в оттитрованной части исследуемого вещества. Список использованной литературыАлексеев В. Н. «Количественный анализ» Золотов Ю. А. «Основы аналитической химии» Крешков А. П., Ярославцев А. А. «Курс аналитической химии. Количественный анализ» Пискарева С. К., Барашков К. М. «Аналитическая химия» Шапиро С. А., Гурвич Я.А. «Аналитическая химия» |
