аналитическая химия. аналитическая химия контрольная работа.. Контрольная работа по дисциплине Аналитическая химия
 Скачать 49.01 Kb. Скачать 49.01 Kb.
|
|
МИНИСТЕРСТВО НАУКИ И ВЫСШЕГО ОБРАЗОВАНИЯ РФ Федеральное государственное бюджетное образовательное учреждение высшего образования «МУРМАНСКИЙ ГОСУДАРСТВЕННЫЙ ТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ» Институт арктических технологий. Кафедра химии. Контрольная работа. по дисциплине «Аналитическая химия» Контрольная работа. Выполнил: студент 3 курса группы ТБб17з заочной формы обучения направление подготовки 20.03.01 «Техносферная безопастность.» Лысенко Е.В. «30» апреля 2020 г. Ном.зач.книж.ТБб17з-112 Проверил: г. Мурманск 2020 Оглавление: Что такое вторичный стандарт? Особенности приготовления вторичных растворов. Для определения титра и молярной концентрации эквивалентов раствора H2SO4 взято 20 см3 раствора Na2B4O7*10H2O приготовленного из фиксанала. С(1/2 Na2B4O7*10H2O) = 0,1 моль/л. На титрование расходуется 19,20 см раствора H2SO4. Определите Т(H2SO4) и С(1/2 H2SO4). Что такое первичный стандарт? Требования, предъявляемые к первичным стандартам. Что такое фиксанал? На титрование раствора, содержащего 5,55 г технического КОН, израсходовали 25,00 мл раствора HCl (T(HCl/NaOH) = 0,05743). Вычислите массовую долю КОН (%) в образце. Какую массу KMnO4 надо взять для приготовления 250 мл раствора с Т(KMnO4/CaO) = 0,005246? Какие методы окислительно-восстановительного титрования применяются в химическом анализе? Назовите титранты. Вычислить: а) Т(HCl/K2O), если Т(HCl) = 0,03798; б) Т(KOH/H2SO4), если Т(KOH) = 0,005727. Вычислять молярную концентрацию раствора NaOH, T(NaOH) и T(NaOH/HCl), если на титрование 20 мл этого раствора израсходовали 19,20 мл 0,1000 М HCl, приготовленной из фиксанала. Коллоквиум № 2 Титриметрический метод анализа Вариант № 6 1. Что такое вторичный стандарт? Особенности приготовления вторичных растворов. Ответ: Вторичным стандартом называют стандартный раствор, характеристики которого установлены по первичному стандарту. Вторичные стандарты –готовят раствор примерно известной концентрации, точную концентрацию устанавливают по первичному стандарту (стандартизация). Под стандартизацией раствора титранта понимают установление его точной концентрации с относительной погрешностью, не превышающей ±0,1%. Для приготовления стандартных растворов также используют фиксаналы. 2. Для определения титра и молярной концентрации эквивалентов раствора H2SO4 взято 20 см3 раствора Na2B4O7*10H2O приготовленного из фиксанала. С(1/2 Na2B4O7*10H2O) = 0,1 моль/л. На титрование расходуется 19,20 см раствора H2SO4. Определите Т(H2SO4) и С(1/2 H2SO4). Решение: По закону эквивалентов: n(1/2Na2B4O7*10H2O) = n(1/2H2SO4). Нормальность раствора серной кислоты: С(1/2H2SO4) = С(1/2Na2B4O7*10H2O)*V(Na2B4O7*10H2O)/ V(H2SO4) = = 0,1*20/19,20 = 0,1042 моль/л Титр раствора серной кислоты: Т(H2SO4) = С(1/2H2SO4)*М(1/2H2SO4)/1000 = 0,1042*49/1000 = 0,0051 г/мл Ответ: 0,0051 г/мл; 0,1042 н 3. Что такое первичный стандарт? Требования, предъявляемые к первичным стандартам. Что такое фиксанал? Ответ: Первичные стандарты – это вещества, из которых по точной навеске можно приготовить раствор с точно известной концентрацией. Первичный стандарт должен отвечать следующим требованиям: 1) состав должен соответствовать химической формуле; 2) должен быть устойчивым, не должен изменять титр при хранении; 3) должен обладать большой молярной массой эквивалента. Для быстрого приготовления точных растворов различных веществ (кислот, щелочей и солей) удобно применять фиксаналы. Это — заранее приготовленные и запаянные в стеклянных ампулах точно отвешенные количества реактива, необходимые для приготовления 1 л 0,1 н. или 0,01 н. раствора. 4. На титрование раствора, содержащего 5,55 г технического КОН, израсходовали 25,00 мл раствора HCl (T(HCl/NaOH) = 0,05743). Вычислите массовую долю КОН (%) в образце. Решение: KOH + HCl = KCl + H2O Определим титр кислоты по гидроксиду калия: T(HCl/KOH) = T(HCl/NaOH)*Mэ(KOH)/Мэ(NaOH) = 0,05743*56/40 = 0,0804 г/мл Вычислим массу КОН: m(KOH) = T(HCl/KOH)*V(HCl) = 0,0804*25,00 = 2,01 г Массовая доля гидроксида калия: ω(КОН) = m(KOH)*100% /m(р-ра) = 2,01*100/5,55 = 36,22 %. Ответ: 36,22 % 5. Какую массу KMnO4 надо взять для приготовления 250 мл раствора с Т(KMnO4/CaO) = 0,005246? Решение: Для расчета примем что титрование проводится в кислой среде, фактор эквивалентности перманганата равен 1/5, тогда: 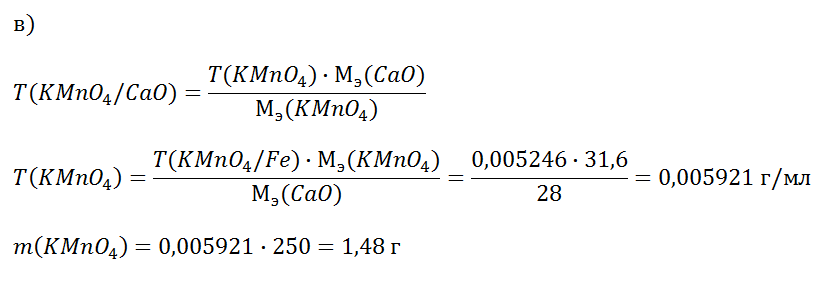 Ответ: 1,48 г 6. Какие методы окислительно-восстановительного титрования применяются в химическом анализе? Назовите титранты. Ответ: Различают прямое, обратное и заместительное титрование. Анализ прямым способом проводят при значении ОВ потенциала ≥ 0,4 В, обратным – при низкой скорости реакции. При использовании заместительного способа – титруют эквивалентное количество продукта, образующегося при реакции реагента с анализируемым компонентом. Классификация методов окислительно-восстановительного титрования проводится по названиям используемых титрантов. Перманганатометрия. Основа метода – процесс окисления перманганатом калия (KMnO4), образующего ярко окрашенные растворы, являющиеся индикатором титрования. Находит применение для анализа неорганических и органических веществ. Дихроматометрия. Основа метода – процесс окисления дихроматом калия. Для нахождения КТТ необходимы дополнительные индикаторы (дифениламин или др). Применяется для определения неорганических и ряда органических веществ, химического потребления кислорода (ХПК) в воде. Йодометрия. Основа метода – процесс окисления йодом (I2) или восстановления йодид-ионами. Недостатки - низкая растворимость I2 в воде. Броматометрия. Основа метода – процесс окисления броматом калия (KBrO3). Преимущества - возможность определения ненасыщенных, ароматических и гетероциклических соединений, устойчивость растворов KBrO3. Недостатки – побочные продукты, некоторые реакции проходят нестрого в стехиометрических соотношениях. Цериметрия. Основа метода – процесс окисления сульфатом церия (IV). Преимущества - устойчивость реагентов, отсутствие побочных продуктов, возможность применения в присутствии соляной кислоты. 7. Вычислить: а) Т(HCl/K2O), если Т(HCl) = 0,03798; б) Т(KOH/H2SO4), если Т(KOH) = 0,005727. Решение: а) Т (HCl/K2O) = T(HCl)*M(1/2K2O)/M(HCl) = 0,03798*47/36,5 = 0,04891 г/мл б) Т(KOH/H2SO4) = Т(KOH)*М(1/2H2SO4)/М(KOH) = 0,005727*49/56 = 0,005011 г/мл Ответ: а) 0,04891 г/мл; б) 0,005011 г/мл. 8. Вычислять молярную концентрацию раствора NaOH, T(NaOH) и T(NaOH/HCl), если на титрование 20 мл этого раствора израсходовали 19,20 мл 0,1000 М HCl, приготовленной из фиксанала. Решение: По закону эквивалентов: n(NaOH) = n(HCl) Фактор эквивалентности гидроксида равен 1, тогда молярная концентрация: C(NaOH) = C(HCl)*V(HCl)/V(NaOH) = 0,1000*19,20/20 = 0,096 мл Определим титр раствора: T(NaOH) = С(NaOH)*М(NaOH)/1000 = 0,096*40/1000 = 0,00384 г/мл Титр по соляной кислоте: T(NaOH/HCl) = C(NaOH)*М(HCl)/1000 = 0,096*36,5/1000 = 0,003504 г/мл Ответ: 0,096 М; 0,00384 г/мл; 0,003504 г/мл. Список литературы. 1. Александрова, Э. А. Аналитическая химия. В 2 книгах. Книга 2. Физико-химические методы анализа. Учебник и практикум / Э.А. Александрова, Н.Г. Гайдукова.-М.:Юрайт,2014. 2. Аналитическая химия и физико-химические методы анализа. В 2 томах. Том 2/Под редакцией А.А. Ищенко. - М.: Академия, 2015. 3. Аналитическая химия и физико-химические методы анализа. Учебник. В 2 томах.Том1.-Москва: Мир, 2016. 4. Аналитическая химия. В 3 томах. Том 2. Методы разделения веществ и гибридные методы анализа / Под редакцией Л.Н. Москвина. - М.: Academia, 2014. 5. Васильев, В. П. Аналитическая химия. В 2 книгах. Книга 2. Физико-химические методы анализа / В.П. Васильев. - М.: Дрофа, 2016. 6. Васильев, В. П. Аналитическая химия. Лабораторный практикум / В.П. Васильев, Р.П. Морозова, Л.А. Кочергина. - М.: Дрофа, 2015. 7. Основы аналитической химии. В 2 книгах. Книга 1. Общие вопросы. Методы- М.: Высшая школа, 2015. 8. Основы аналитической химии. В 2 книгах. Книга 2. Методы химического анализа. - М.: Высшая школа, 2015. |
