5fan_ru_Функциональный анализ органических лекарственных веществ. Функциональный анализ органических лекарственных веществ
 Скачать 1.02 Mb. Скачать 1.02 Mb.
|
|
Функциональный анализ органических лекарственных веществ Подавляющую часть применяемых в медицинской практике лекарственных веществ составляют соединения органической природы. В отличие от анализа неорганических веществ, в котором используются свойства образующих их ионов, основу анализа органических лекарственных веществ составляют свойства функциональных групп. Функциональные группы - это связанные с углеводородным радикалом отдельные атомы или группы атомов, которые вследствие своих характерных свойств могут быть использованы для целей идентификации и количественного определения лекарственных веществ. Наличие нескольких функциональных групп оказывает влияние на эффекты некоторых общих реакций и на свойства продуктов, образующихся в результате их протекания. Классификация функциональных групп 1. Кислородсодержащие функциональные группы: —ОН - гидроксильная (спиртовая или фенольная); —С=О; —С=О - карбонильная (кетонная или альдегидная); | \ Н —СООН - карбоксильная; —C—О— - сложноэфирная группа; || O —CH—(CH2)n—C=O – лактонная группа. |____ O _____| 2. Азотсодержащие функциональные группы: —NH2 - первичная аминогруппа алифатическая или ароматическая; —NO2 - ароматическая нитрогруппа; —NH— - вторичная аминогруппа; —N— - третичный атом азота; | —C—NH— - амидная группа; || O —CH—(CH2)n—C=O – лактамная группа; |____ NH ____| —С—NH—C— - имидная группа; || || O O —SO2—NH— - сульфамидная группа; —СН = N— - азометиновая группа; 3. Прочие функциональные группы: 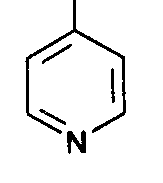  - пиридиновый цикл; - пиридиновый цикл;R―Gal - ковалентно-связанный галоген (Cl, Br, I, F); R―S― - ковалентно-связанная сера. Спиртовый гидроксил: Alk — ОН Спиртовый гидроксил - это гидроксил, связанный с алифатическим углеводородным радикалом. Его содержат спирты, карбоновые кислоты и их соли, терпены, производные фенилалкиламинов, соединения стероидного строения, антибиотики ароматического ряда и некоторых другие лекарственные вещества. Идентификация 1. Реакция этерификации с кислотами или их ангидридами в присутствии водоотнимающих средств. Основана на свойстве спиртов образовывать сложные эфиры. В случае низкомолекулярных соединений эфиры обнаруживают по запаху, а при анализе высокомолекулярных веществ - по температуре плавления. С2Н5ОН + СН3СООН + Н2SО4 к. → СН3-С = О + Н2О \ ОС2Н5 спирт этиловый этилацетат (фруктовый запах)   2. Реакция окисления. Основана на свойстве спиртов окисляться до альдегидов, которые обнаруживают по запаху. В качестве реагентов используют различные окислители: калия перманганат, калия бихромат, калия гексацианоферрат (III) и др. Наибольшую аналитическую ценность имеет калия перманганат, который, восстанавливаясь, меняет степень окисления от 3 +7 до +2 и обесцвечивается, т.е. делает реакцию наиболее эффектной. С2Н5ОН + [О] → СН3-С=О + Н2О \ Н спирт этиловый ацетальдегид (запах яблок) Окислению могут сопутствовать побочные химические реакции. Например, в случае эфедрина - гидраминное разложение, в случае молочной кислоты – декарбоксилирование. 3. Реакция комплексообразования, основанная на свойстве многоатомных спиртов образовывать комплексные соединения с сульфатом меди (II) в щелочной среде. CuSO4 + 2 NaOH → Cu(OH)2 + Na2SO4 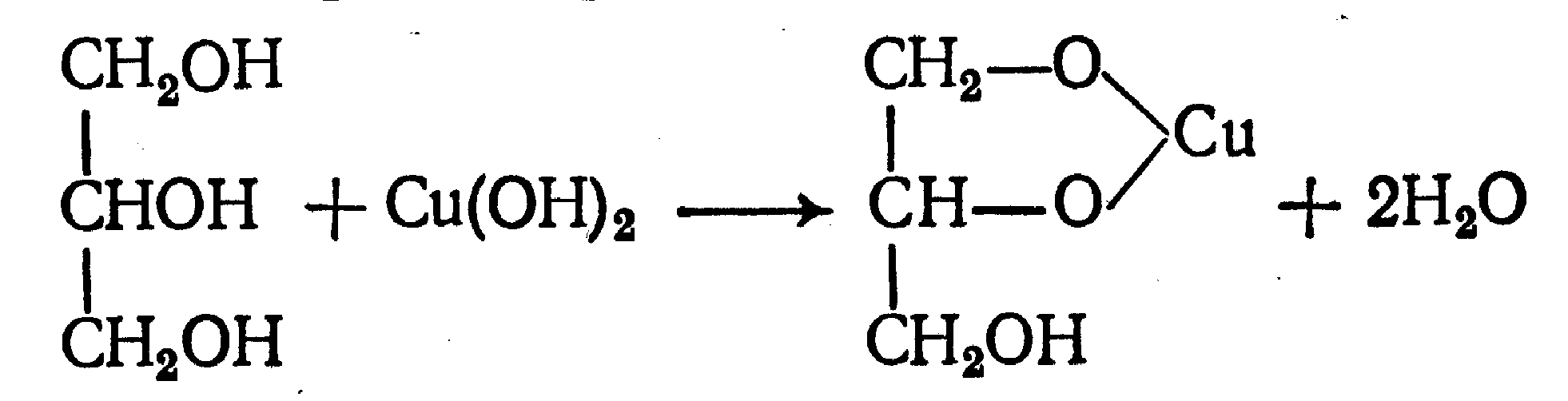 глицерин синего цвета комплекс Аналогичную цветную реакцию дают аминоспитры (эфедрин, мезатон и др.). В комплексообразовании принимают участие спиртовый гидроксил и вторичная аминогруппа. Полученные окрашенные комплексы имеют структуру: 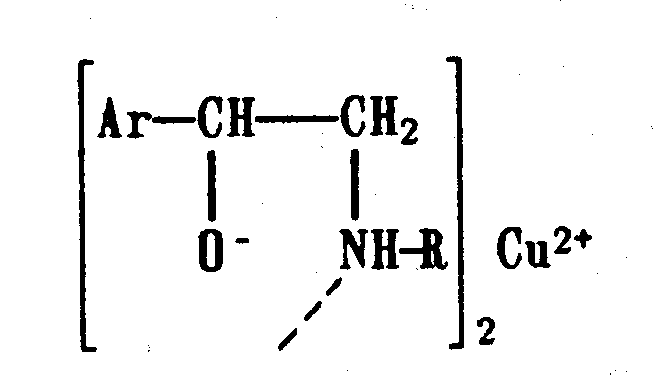 В случае эфедрина образующийся комплекс при извлечении в эфир окрашивает его в фиолетово-красный цвет, а водный слой сохраняет синее окрашивание. Количественное определение 1. Метод ацетилирования: алкалиметрия, вариант нейтрализации, способ косвенного титрования. Основан на свойстве спиртов образовывать нерастворимые сложные эфиры. Ацетилирование проводят избытком уксусного ангидрида при нагревании в присутствии пиридина. В процессе титрования выделяется эквивалентное количество уксусной кислоты, которую оттитровывают натрия гидроксидом с индикатором фенолфталеин. СН2—ОН СН2—О—COCH3 | | СН —ОH + 3 (СH3CO)2O → СН —О—COCH3 + 3 CH3COOH | | СН2—ОН СН2—О—COCH3 4 Одновременно будет титроваться также кислота, образованная при гидролизе избытка уксусного ангидрида, взятого для ацетилирования, поэтому необходим контрольный опыт. (СH3CO)2O + H2O → 2 СH3COOH избыток СH3COOH + NaOH → СH3COONa + H2O Э=М/3 2. Бихроматометрия. Метод основан на окислении спиртов избытком бихромата калия в кислой среде. При этом спирт этиловый окисляется до уксусной кислоты, глицерин – до углекислоты и воды. Окислении проходит во времени и поэтому используют способ обратного титрования. 3 C2H5OH + 2 K2Cr2O7 + 16 HNO3 → 3 CH3COОН + 4 Cr(NO3)3 + 4 KNO3 + 11 H2O Избыток бихромата калия определяют йодометрически с индикатором – крахмал: K2Cr2O7 + 6 KJ + 14 HNO3 → 3 J2 + 2 Cr(NO3)3 + 8 KNO3 + 7 H2O J2 + 2 Na2S2O3 → 2 NaJ + Na2S4O6 Э=М/4 3. Куприметрия. Метод основан на свойстве спиртов образовывать устойчивые комплексные соединения с сульфатом меди в щелочной среде. Прямое титрование. Титрант – сульфат меди. Индикатор – мурексид. Метод используется во внутриаптечном контроле качества лекарственных форм с левомицетином. Фенольный гидроксил: Аr - ОН Это гидроксил, связанный с ароматическим радикалом. Его содержат лекарственные вещества группы фенолов, фенолокислот и их производных, производные фенантренизохинолина, синэстрол, адреналин и др. Идентификация 1. Реакция комплексообразования фенольного гидроксила с ионами железа (III). Основана на свойствах фенольного гидроксила образовывать растворимые комплексные соединения, окрашенные чаще в синий цвет (фенол) или фиолетовый (резорцин, кислота салициловая), реже в красный (ПАС-натрий) и зеленый цвета (хинозол). Состав комплексов, а, следовательно, и их окраска обусловлены количеством фенольных гидроксилов: синий (фенол) или фиолетовый (резорцин), влиянием других функциональных групп (кислотата салициловая, ПАС-натрий, хинозол), реакцией среды (резорцин). 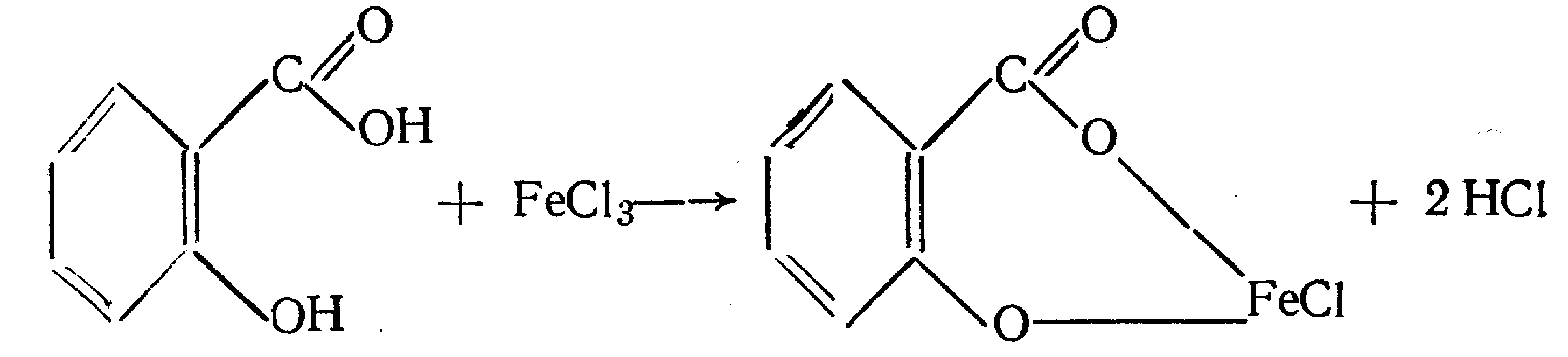  кислота салициловая 5 2. Реакция бромирования ароматического кольца. Основана на электрофильном замещении водорода в о- и п-положениях на бром с образованием нерастворимого бромпроизводного белого цвета. При избытке бромной воды образуется продукт окисления и галогенирования (тетрабромциклогексадиен-2,5-он) в виде осадка желтого цвета. Основные правила бромирования 1) Бром замещает водород в о- и п-положениях по отношению к фенольному гидроксилу: 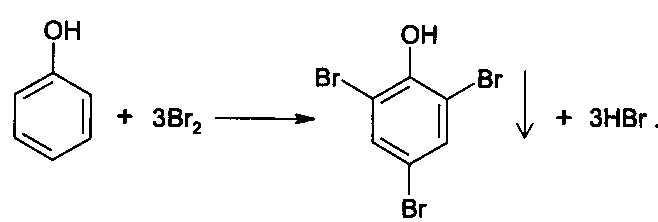 фенол трибромфенол белый аморфный осадок (Т пл.) 2) При наличии в о- или п-положениях ароматического кольца заместителей в реакцию вступает меньше атомов брома: 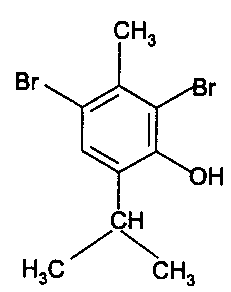 дибромтимол 3) Если в о- или п-положениях находится карбоксильная группа, то при наличии избытка брома происходит декарбоксилирование и образование трибромпроизводного: 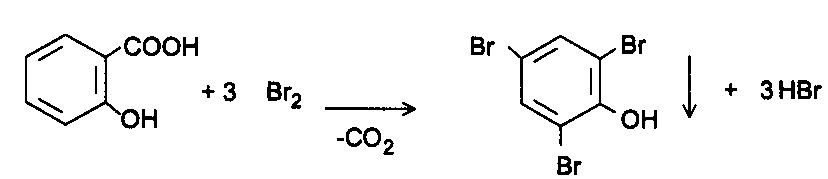 кислота салициловая трибромфенол При йодировании избытком раствора йода декарбоксилирования салициловой кислоты не происходит. 4) Если заместитель находится в м-положении, то он не препятствует образованию трибромпроизводного: 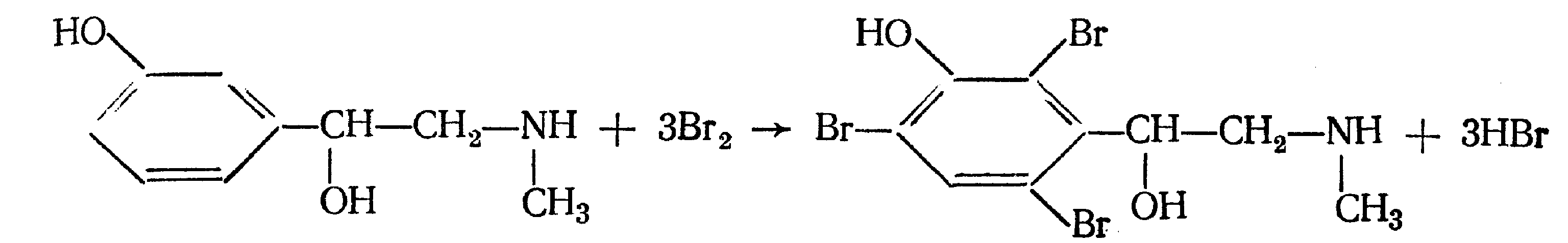  мезатон триброммезатон Если в соединении содержится два фенольных гидроксила в м-положении, то в результате их согласованной ориентации образуется трибромпроизводное: 6 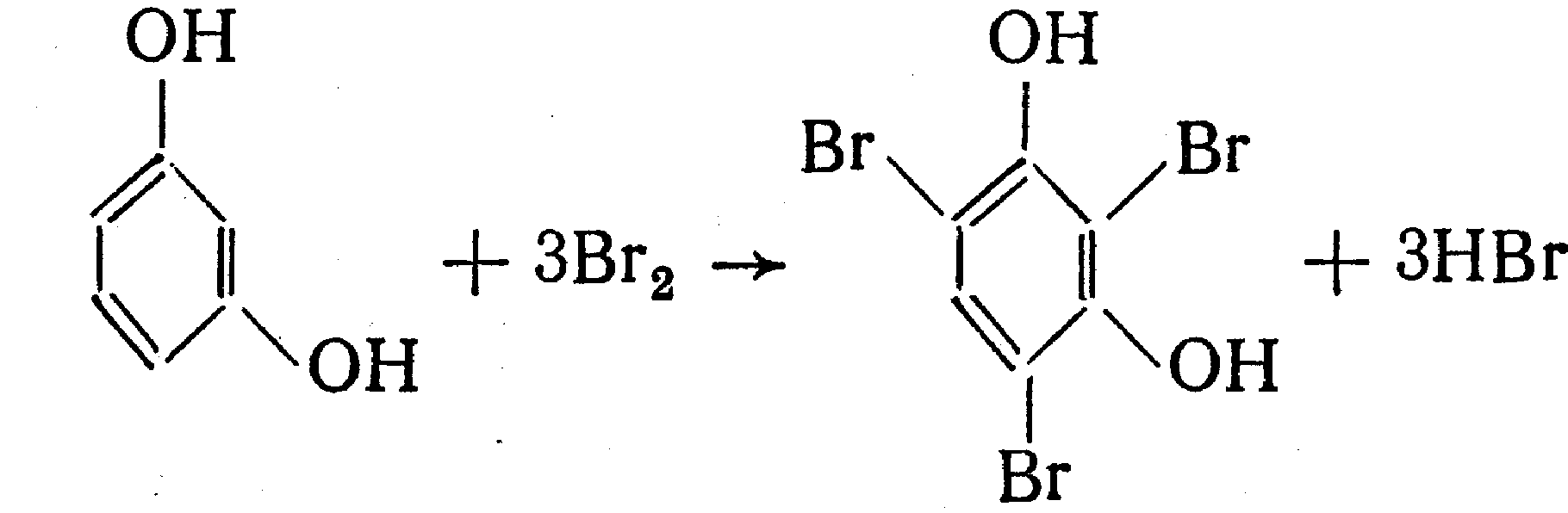  резорцин трибромрезорцин 6) Если две гидроксильные группы расположены о- и п-положениях друг к другу, то они действуют несогласованно и бромирование не проходит: 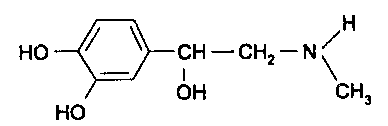 адреналин 3. Реакция азосочетания фенолов с диазореактивом (диазотированная сульфаниловая кислота) в щелочной среде с образованием азокрасителя, окрашенного от оранжево-красного до вишнево-красного цвета: 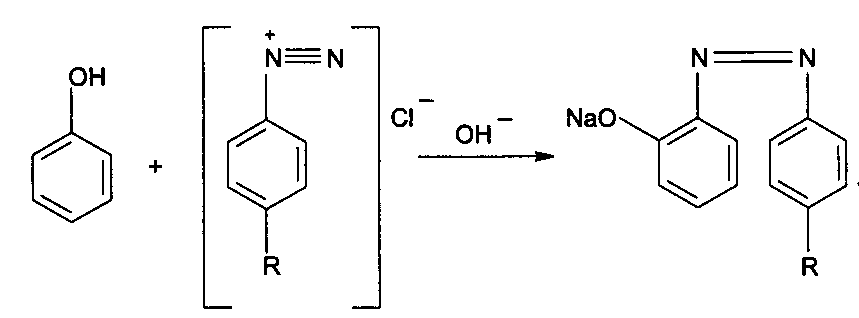 4. Реакция окисления. Фенолы могут окисляться до различных соединений, но чаще всего до хинонов, окрашенных в розовый или, реже, в желтый цвет: 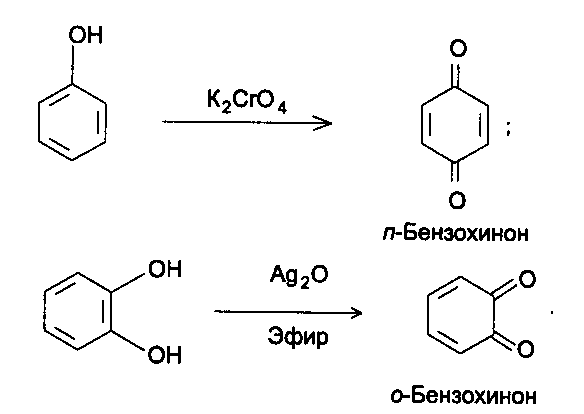 5. Реакция образования индофенолового красителя. Основана на окислении фенолов до хинонов, которые при конденсации с аммиаком или аминопроизводным и избытком фенола образует индофеноловый краситель: 7 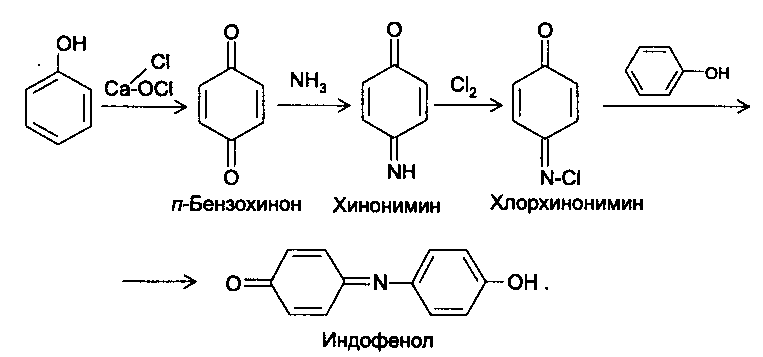  Фенол образует индофеноловый краситель сине-зеленого цвета, тимол – слабо-розового, резорцин – буровато-желтого. 6. Реакция конденсации с альдегидами или ангидридами кислот: 1) С формальдегидом в присутствии концентрированной серной кислоты салициловая кислота образует ауриновый краситель красного цвета: 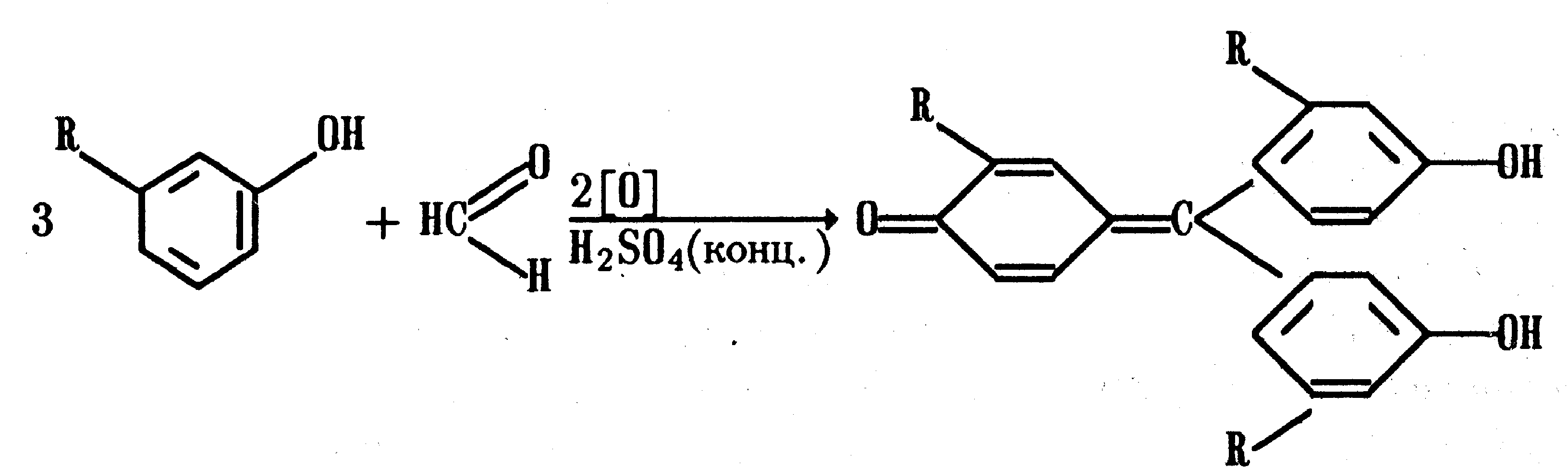 Концентрированная серная кислота на первой стадии реакции играет роль водоотнимающего средства, а на второй является окислителем. 2) Сплавление резорцина с избытком фталевого ангидрида и последующее растворение плава желто-красного цвета в растворе щелочи. Появляется интенсивно-зеленая флюоресценция. 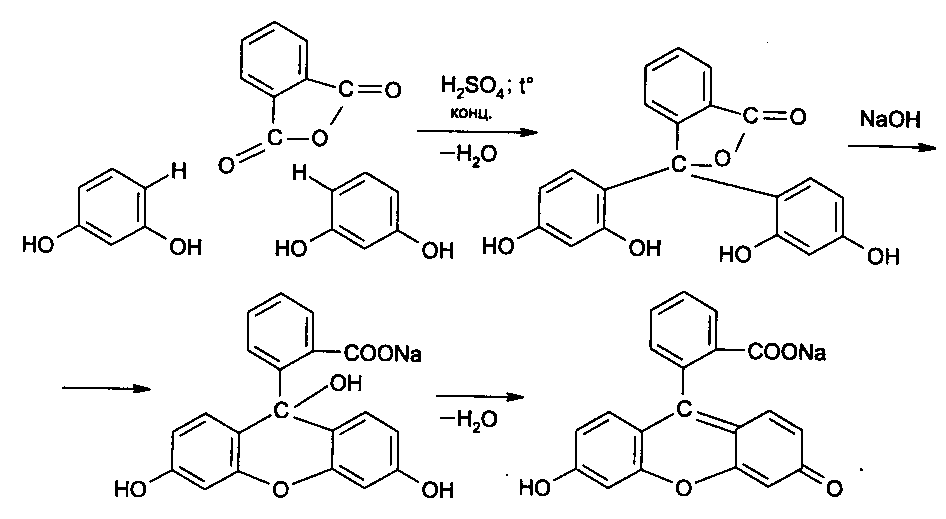  С фенолом образуется фенолфталеин, имеющий в щелочной среде малиновую окраску. С тимолом – тимолфталеин, окрашенный в щелочной среде в синий цвет. 8 Количественное определение 1. Броматометрия. Метод основан на электрофильном замещении атомов водорода ароматического кольца на бром, выделенный в реакции бромата калия с бромидом калия в кислой среде: KBrO3 + 5 KBr + 6 HCl → 3 Br2 + 6 KCl + 3 H2O  Э=М/6 Э=М/6Используют способы прямого (тимол) и обратного титрования (фенол, резорцин). При прямом способе титруют калия броматом в присутствии бромида с индикатором метилоранжем или метиловым красным до обесцвечивания. При обратном – добавляют избыток калия бромата, калия бромид, кислоту и выдерживают нужное для бромирования время, а затем избыток брома определяют йодометрически: Br2 + 2 KI → I2 + 2 KBr I2 + 2 Na2S2O3 → 2 NaI + Na2S4O6 Индикатор – крахмал. Эквивалент зависит от количества присоединенного брома. 2. Йодометрия. Основана на электрофильном замещении атомов водорода ароматического кольца на йод: 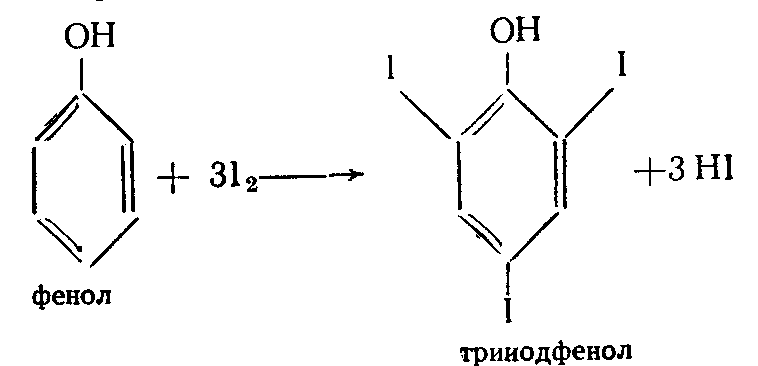  Э=М/6 Э=М/6Для связывания йодоводородной кислоты, смещающей равновесие в обратную сторону, добавляют ацетат или гидрокарбонат натрия: HI + NaHCO3 → NaI + CO2↑ + H2O HI + CH3COONa → NaI + CH3COOH Используют способы прямого и обратного титрования. В последнем - избыток йода оттитровывают тиосульфатом натрия. Параллельно ставится контрольный опыт. 3. Йодхлорметрия. Метод основан на электрофильном замещении атомов водорода в о- и п-положениях ароматического кольца на йод, входящий в состав йодмонохлорида. Используют способ обратного титрования - избыток йодмонохлорида определяют йодометрически. 9   ICl + KI → I2 + KCl I2 + 2 Na2S2O3 → 2 NaI + Na2S4O6 Э=М/6 4. Метод ацетилирования. Используют для количественной оценки синэстрола. 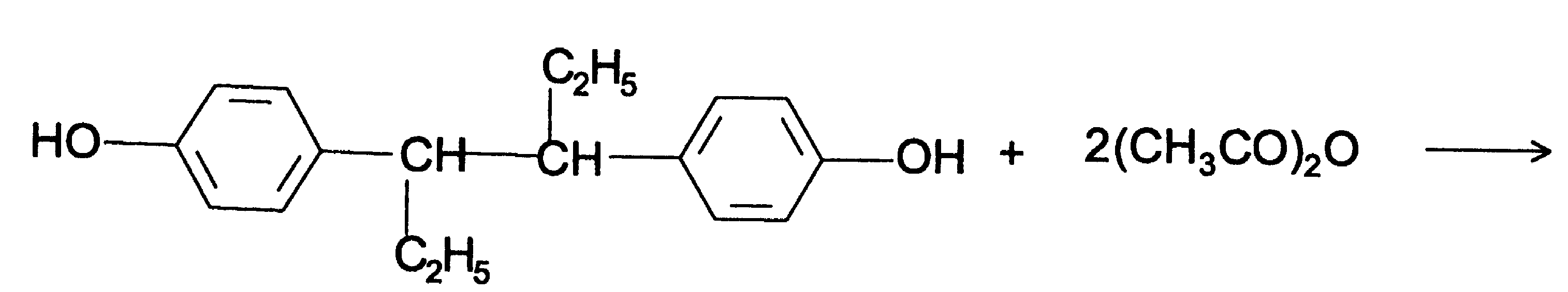 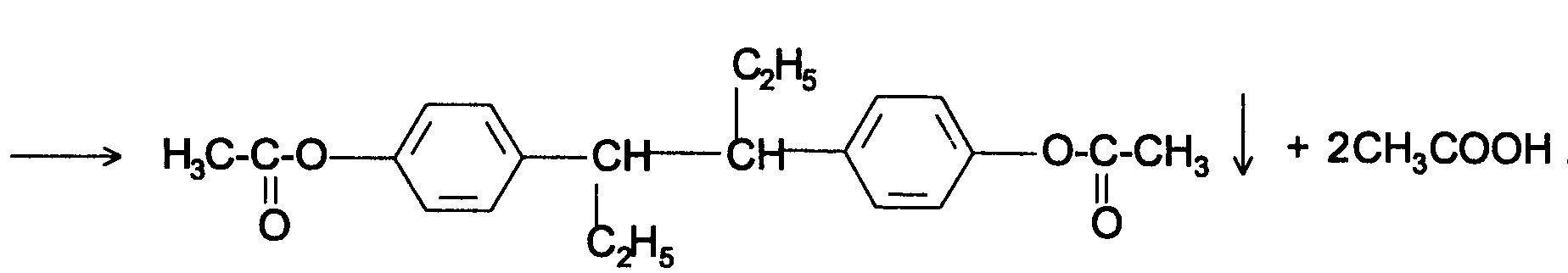 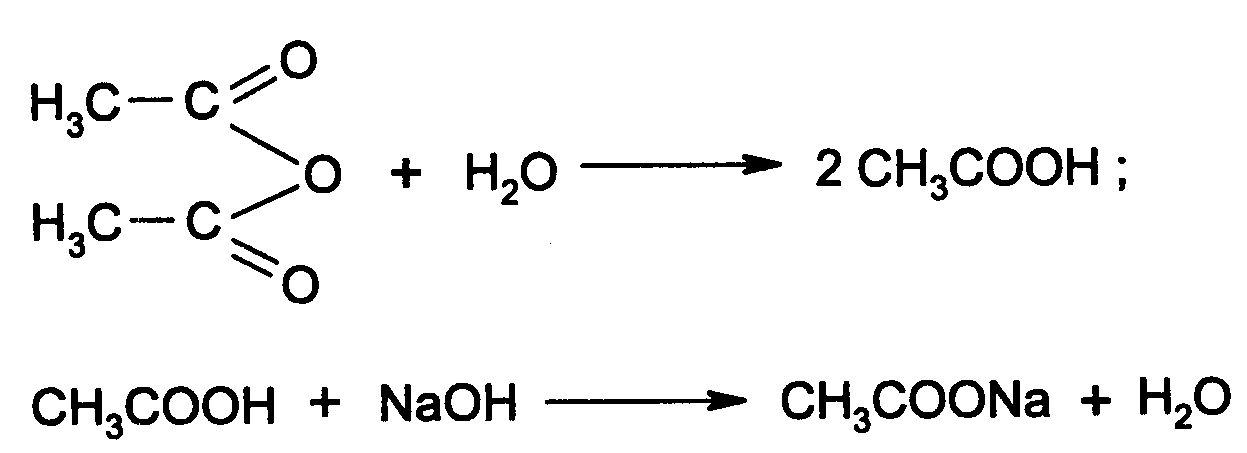 Э=М/2 Э=М/25. Алкалиметрия. Метод нейтрализации в среде протофильного растворителя диметилформамида (ДМФА). Фенолы проявляют очень слабые кислотные свойства, их определение алкалиметрическим методом нейтрализации в водных или смешанных средах невозможно, поэтому используют титрование в среде неводных растворителей, в частности, ДМФА. Метод основан на солеобразовании определяемой слабой кислоты (фенола) с титрантом – метилатом натрия в среде протофильного растворителя, усиливающего кислотные свойства: 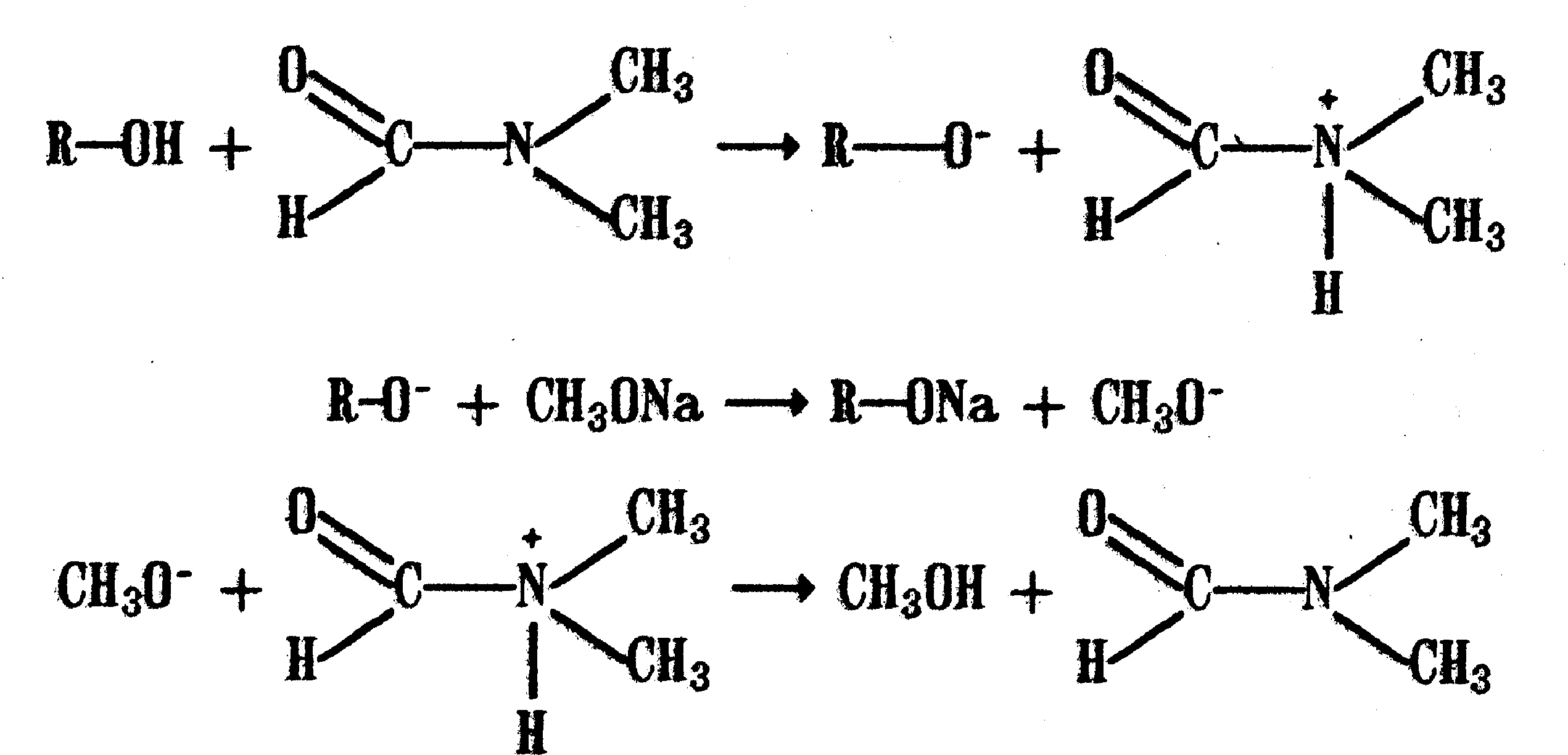 В качестве индикатора применяют тимоловый синий. Э=М 10 6. Фотоколориметрия (ФЭК) и спектрофотометория (СПФ). Методы основаны на свойстве окрашенных растворов поглощать немонохроматический (ФЭК) или монохроматический (СПФ) свет в видимой области спектра. В случае фенолов получают окрашенные соединения на основе реакций комплексообразования, азосочетания и образования индофенолового красителя. |
