5fan_ru_Функциональный анализ органических лекарственных веществ. Функциональный анализ органических лекарственных веществ
 Скачать 1.02 Mb. Скачать 1.02 Mb.
|
|
Идентификация 1. Реакция диазотирования с последующим азосочетанием. В основе реакции лежит взаимодействие соединений, содержащих Ar—NH2 с нитритом натрия в кислой среде. В результате образуются бесцветные или слабо-желтого цвета соли диазония. Исключение составляет этакридина лактат, в результате диазотирования которого образуется диазосоединение, имеющее вишнево-красную окраску. Получение диазосоединения сочетают с фенолами (β-нафтолом, фенолом, резорцином) в щелочной среде или ароматическими аминами в кислой среде. При этом образуются азокрасители.   2. Реакции окисления. Ароматические амины легко окисляются даже кислородом воздуха с образованием окрашенных продуктов. 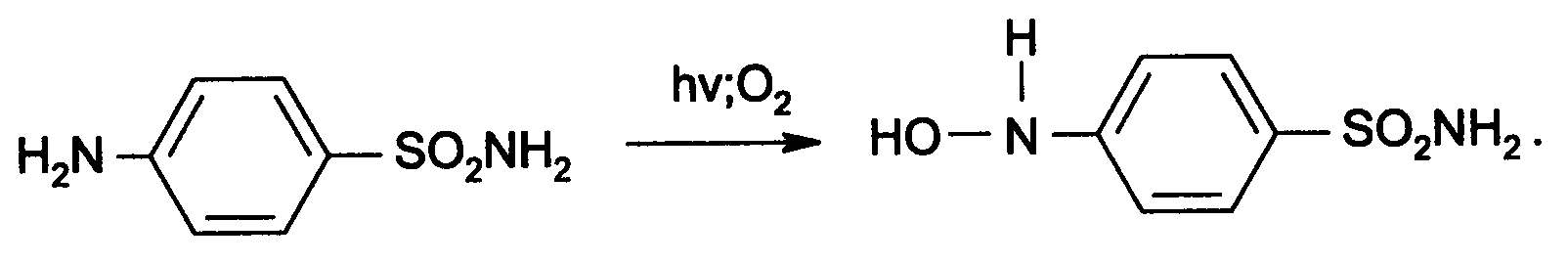  Появление окраски может быть обусловлено не только продуктами окисления, но и веществами, образующимися в результате последующей конденсации с избытком ароматического амина. В качестве окислителей можно применять хлорамин, калия дихромат в кислой среде, хлорную известь и др. Эта реакция рекомендуется для парацетомола после гидролиза и образования п-аминофенола, который окисляется калия дихроматом в хинонимин, последний взаимодействует с непрореагировавшим п-аминофенолом и образует индаминовый краситель фиолетового цвета (родственный индофенолу): 20 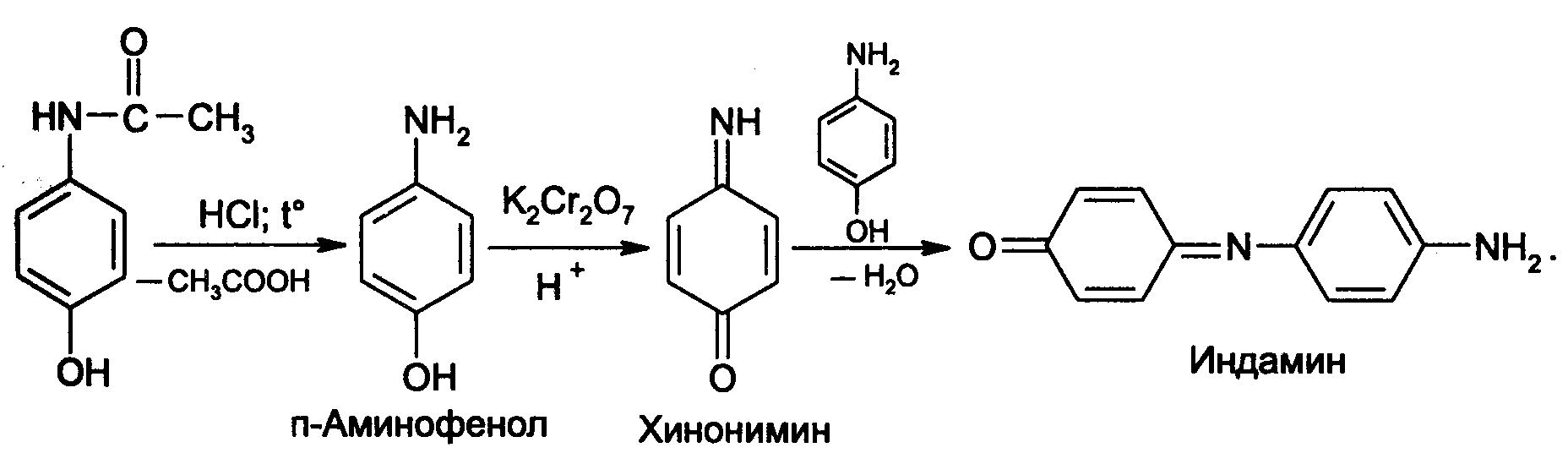 Индофеноловые красители образуются также при окислении сульфаниламидов хлорамином в щелочной среде. В этом случае образуются красители о-хиноидной структуры. Реакции окисления рекомендуются так же при идентификации анестезина (извлекающийся в эфирный слой продукт окисления хлорамином имеет желтый цвет), новокаина (обесцвечивание калия перманганата), уросульфана (рубиново-красное окрашивание при нагревании с натрия нитритом), норсульфазола (желто-розовое окрашивание при окислении перекисью водорода и хлоридом железа). 3. Реакция конденсации с альдегидами. При взаимодействии в кислой среде с ароматическими альдегидами первичные ароматические амины образуют окрашенные в желтый цвет основания Шиффа. 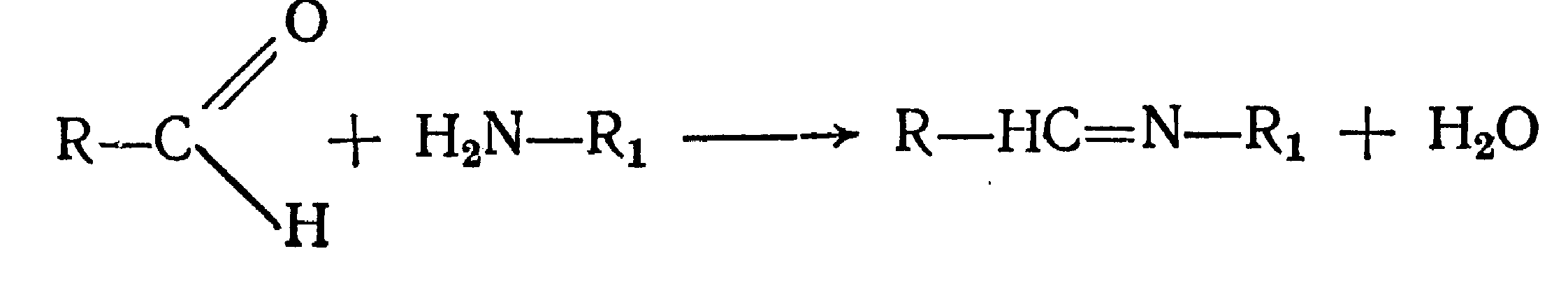  Разновидностью этой реакции является лигниновая проба. На лигнинсодержащий материал (бумагу, древесину) наносят разведенную хлористоводородную кислоту и вещество с первичной ароматической аминогруппой, появляется желто-оранжевое пятно. 4. Реакция галогенирования, в частности, бромирование, основана на электрофильном замещении атомов водорода бензольного кольца в о- и п-положениях на галоген. Образуются аморфные осадки белого или желтоватого цвета, определяют их температуру плавления. Правила бронирования те же, что и у фенолов. 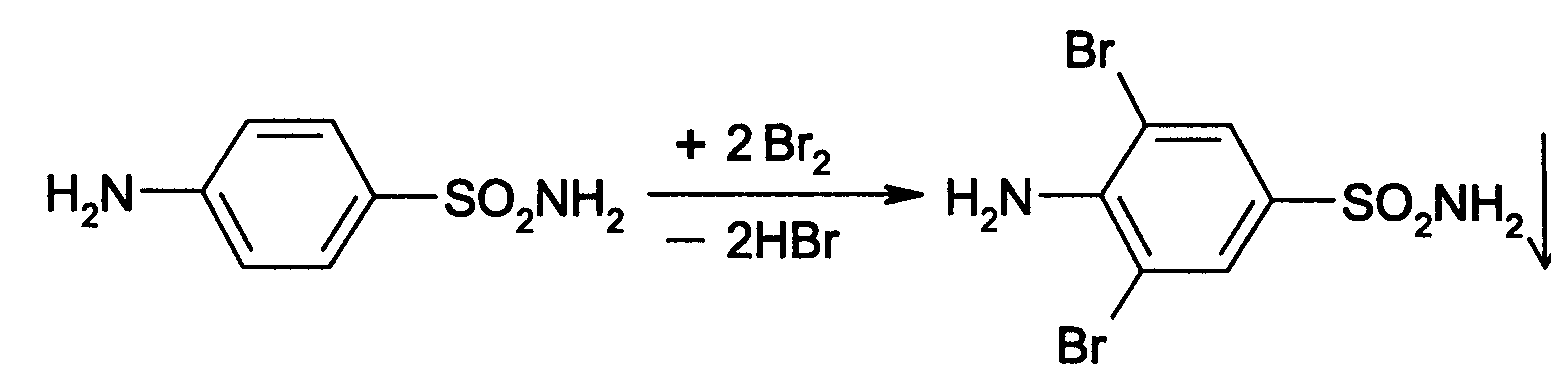 Количественное определение 1. Нитритометрия. Метод основан на свойстве веществ, содержащих Ar—NH2 диазотироваться натрия нитритом в кислой среде. Титруют в присутствии калия бромида (катализатора) при пониженной температуре и медленном добавлении титранта: 21 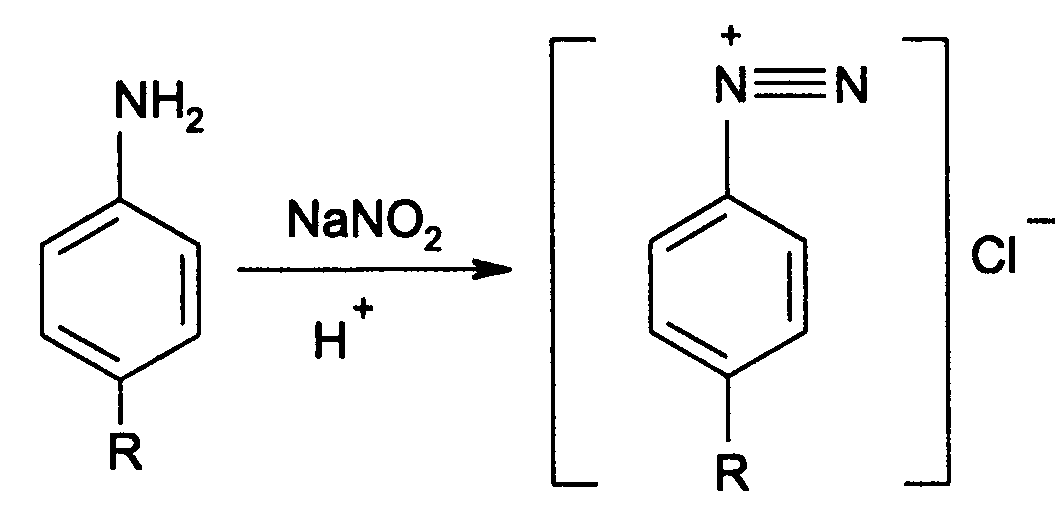 Э=М Э=МИндикация точки эквивалентности: - с помощью внутренних индикаторов: тропеолина 00, смешанного индикатора (тропеолин 00 с метиленовым синим), нейтрального красного. Избыток титранта окисляет индикатор и его окраска изменяется; - с использованием внешнего индикатора – йодкрахмальной бумаги. Это фильтровальная бумага, пропитанная растворами крахмала и калия йодида. В точке эквивалентности при вынесении капли титруемого раствора на бумагу появляется синее пятно от выделившегося йода: 2 NaNO2 + 2 KI + 4 HCl → I2 + 2 NO↑ + 2 KCl + 2 NaCl + 2 H2O - потенциометрически. 2. Броматометрия. Метод основан на электрофильном замещении атомов водорода ароматического кольца атомами брома. Обоснование приведено в разделе "Фенолы". Прямое титрование применяют в анализе анестезина, новокаина, стрептоцида. Метод применяется ограниченно, так как ароматические амины окисляются избытком брома. 3. Йодхлорметрия. Метод основан на электрофильном замещении атомов водорода ароматического кольца атомами йода. Обоснование приведено в разделе "Фенолы". Способ обратного титрования применяют в анализе производных п-аминобензойной кислоты, ПАС-натрия, сульфаниламидов. 4. Фотоколориметрия (ФЭК) и спектрофотометория (СПФ). На основе реакций образования азокрасителя или оснований Шиффа. Ароматическая нитрогруппа: Ar—NО2 Ароматическая нитрогруппа - это группа -NО2 ,связанная с ароматическим радикалом. Ее содержат производные нитрофенилалкиламина, 4-аминохинолина, 8-оксихинолина, 5-нитрофурана, бензодиазепина. Идентификация 1. Реакция восстановления до ароматической аминогруппы. Ароматические нитросоединения обычно окрашены в бледно-желтый цвет (нитрогруппа – это хромофор). При наличии других заместителей интенсивность и глубина окраски часто усиливается. Все нитросоединения в кислой среде восстанавливаются до соответствующих аминосоединений, при этом желтая окраска препаратов исчезает. 22 Реакция протекает по следующей схеме: [H] Ar—NO2 → Ar—NH2 В качестве восстановителя используют металлический цинк в кислой среде. Образовавшиеся соединения с Ar—NH2 доказывают по реакции диазотирования с последующим азосочетанием или реакции конденсации с ароматическими альдегидами. Следует отметить особенность производных 5-нитрофурана. После их восстановления окраска исчезает, а образующиеся соединения с первичной аминогруппой быстро разлагаются с раскрытием фуранового цикла. По этой причине получение азокрасителя на основе вышеназванных соединений не удается. 2. Образование аци-солей. Ароматические нитросоединения, содержащие в о- или п-положениях группу с подвижным атомом водорода, при действии щелочей окрашиваются в желтый или оранжевый цвет вследствие образования солей аци-формы. 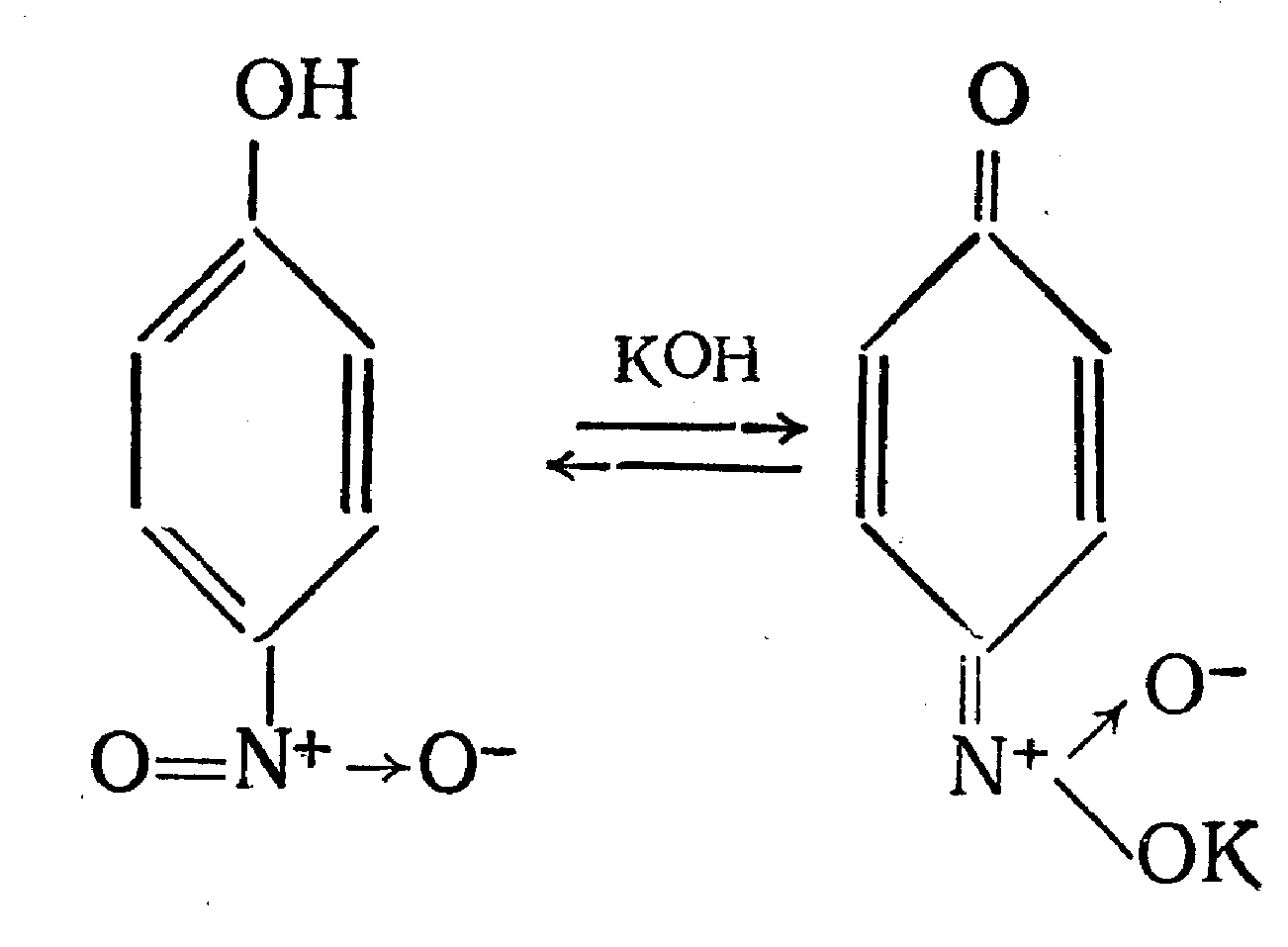 Аналогично ведут себя производные 5-нитрофурана. Как кислоты эти вещества реагируют со щелочью, образуя окрашенные аци-соли. При действии разбавленного раствора щелочи происходит перераспределение электронной плотности, депротонирование гидразидной группы и увеличение цепи сопряжения. В результате чего происходит изменение окраски и увеличение ее интенсивности. При действии концентрированных растворов щелочей и при нагревании реакция идет с раскрытием фуранового цикла. 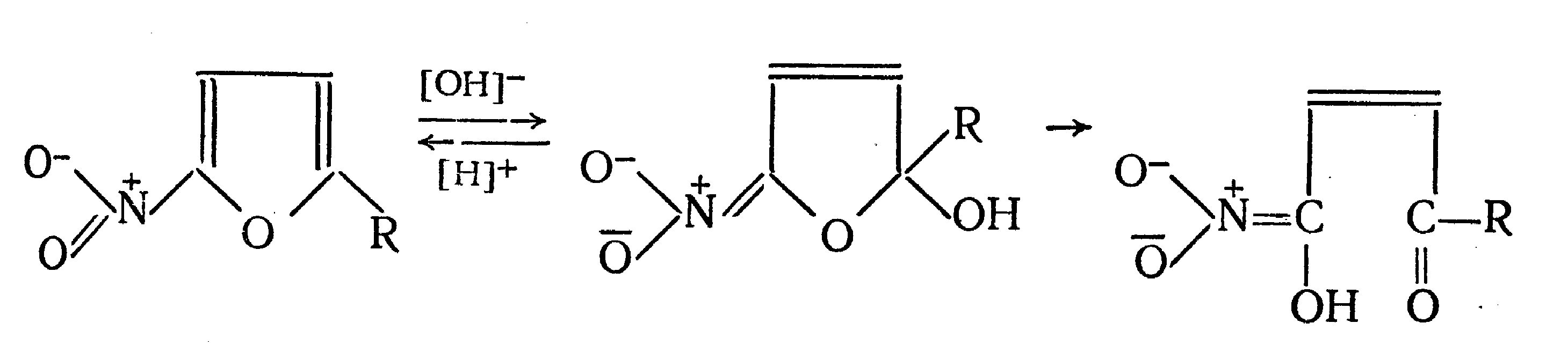 При действии растворов щелочей в неводной среде нитропроизводные образуют аци-соли иной окраски, чем в водной. Например, фурацилин в водной среде образует аци-соль оранжево-красной окраски, а в среде ДМФ – фиолетовой. Количественное определение 1. Нитритометрия после восстановления нитрогруппы до аминогруппы. 2. Фотоколориметрия (ФЭК) и спектрофотометория (СПФ). На основе реакции с раствором натрия гидроксида. 23 Вторичная аминогруппа: R—NH—R1 Эта функциональная группа входит в структуру вторичных аминов. Её можно рассматривать как производное аммиака, у которого два атома водорода замещены на углеводородные радикалы. Вторичная аминогруппа может быть представлена с ароматическим циклом (Ar-NH-R) в виде вторичного гетероатома азота, входящего в состав гетероцикла лекарственного соединения. Примерами лекарственных веществ, содержащих вторичную аминогруппу, являются эфедрина гидрохлорид, адреналина гидрохлорид, дикаин. Вторичный гетероатом азота содержат дибазол, теофиллин. Ar-NH-R Идентификация Образование нитрозосоединений. Под действием натрия нитрита в кислой среде дикаин образует N-нитрозосоединение желтого цвета: 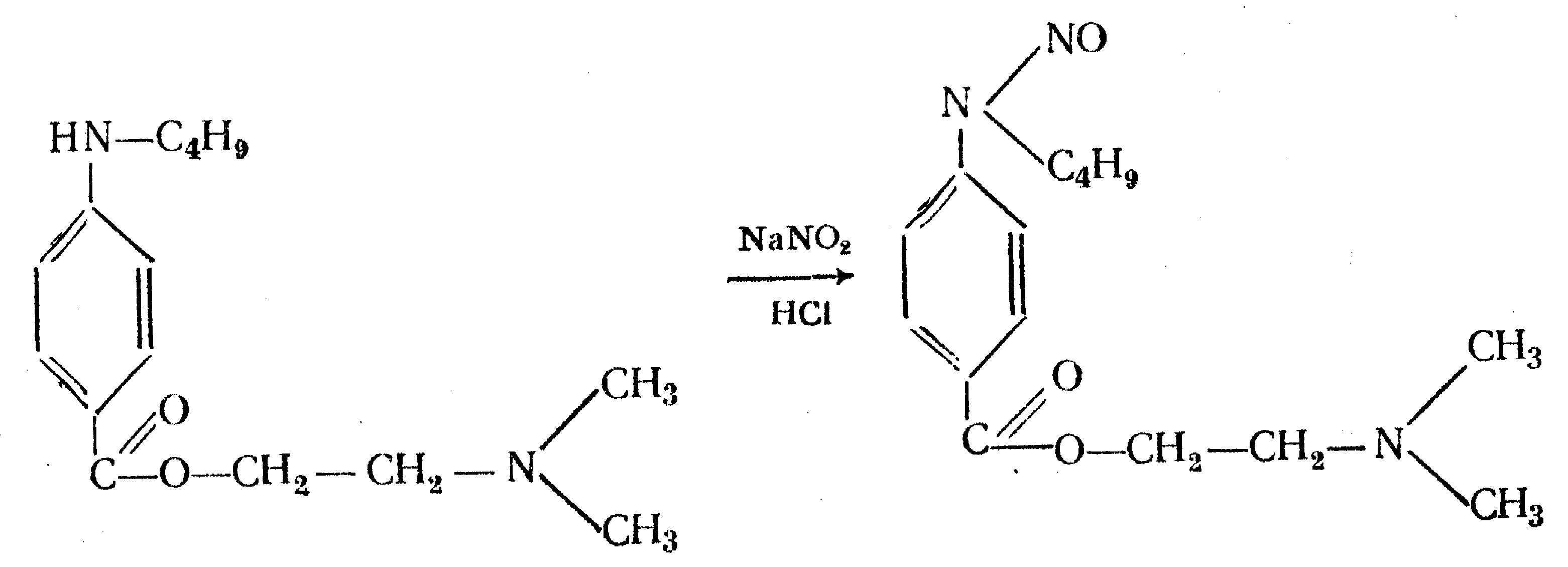 Количественное определение Нитритометрия. Прямое титрование дикаина. Метод основан на свойстве веществ, содержащих вторичную аминогруппу, образовывать нитрозосоединения под действием натрия нитрита в кислой среде. Индикатор – нейтральный красный или тропеолин 00. Э=М. -NH- в гетероцикле Идентификация Реакция с солями тяжелых металлов. В имидазольном цикле атом водорода при вторичном гетероатоме азота придает соединениям слабые кислотные свойства. Это обуславливает возможность проведения реакций комплексообразования. В качестве реактива могут быть использованы соли меди (II), кобальта (II), серебра. В случае теофиллина используют раствор хлорида кобальта. Предварительно препарат переводят в натриевое производное, так как комплексообразование проходит в нейтральной или в слабощелочной среде. В результате реакции образуется комплекс виде белого с розоватым оттенком осадка: 24  Количественное определение 1. Косвенная алкалиметрия. Вариант нейтрализации. Способ заместительного титрования. Метод основа на реакции взаимодействия определяемого соединения с серебра нитратом и выделением эквивалентного количества азотной кислоты. Титрант – раствор натрия гидроксида, индикатор – феноловый красный. В случае анализа теобромина Э=М. 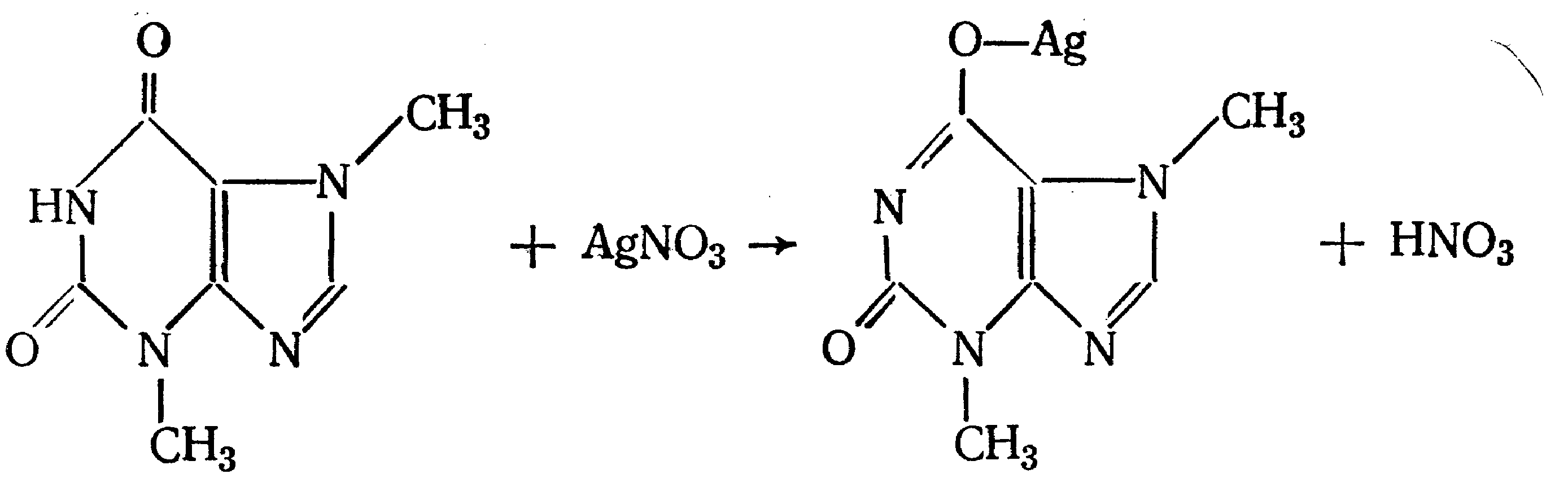 HNO3 + NaOH → NaNO3 + H2O 2. Фотоколориметрия (ФЭК) на основе реакций комплексообразования с растворами солей тяжелых металлов и реакций с красителями (эозин, тимоловый синий, тропеолин 00). Продукты реакций экстрагируют органическим растворителем и измеряют оптическую плотность полученного раствора (экстракционная фотометрия). Третичный атом азота: R3—N Эта функциональная группа входит в структуру третичных аминов. Её можно рассматривать как производное аммиака, у которого три атома водорода замещены на углеводородные радикалы. Обладая слабыми основными свойствами третичные амины образуют соли с сильными минеральными кислотами R3N . HCl. Третичный атом азота может быть представлен и в виде гетероатома азота, входящего в состав гетероцикла лекарственного соединения. Примерами лекарственных веществ, содержащих третичный атом азота, являются новокаин, ксикаин, тримекаин, аминазин. Третичный атом азота в гетероцикле содержат кодеин, морфина гидрохлорид, промедол, атропина гидрохлорид, хинозол, папаверин. Идентификация 25 1. Реакции с общеалкалоидными осадителными реактивами. Третичный атом азота придает соединениям слабовыраженные основные свойства. Поэтому они при взаимодействии с кислотами, солями тяжелых металлов и комплексными йодидами образуют окрашенные осадки. Общеалкалоидные реактивы при этом делят на две группы: - образующие простые соли (хлорная, пикриновая и марганцевая кислоты, танин); R3N . HCl + KMnO4 → R3N . HMnO4↓ + KCl фиолетовые кристаллы - реактивы, дающие комплексные соли (реактивы Люголя, Драгендорфа, Майера). R3N . HCl + nI2 + KI → R3N . nI2 . HI↓ + KCl бурый R3N . HCl + KBiI4 → R3N . HBiI4↓ + KCl оранжевый или красный R3N . HCl + K2HgI4 → R3N . H2HgI4↓ + KCl белый или желтоватый Специфичность реакций можно повысить, если определить температуру плавления пикратов лекарственных соединений или рассмотреть форму кристаллов перманганата кокаина, перйодида морфина. 2. Реакция выделения оснований (для солей). Третичные амины образуют легко гидролизующиеся соли слабого основания и сильной кислоты. Эти соли при действии щелочей образуют азотистые основания чаще в виде осадков (определяют температуру плавления) или маслянистой жидкости (новокаин). Исключение составляет эфедрин – его основание представляет собой жидкость. R3N . HCl + NaOH → R3N↓ + NaCl + H2O Количественное определение 1. Кислотно-основное титрование в неводных средах. Метод основан на солеобразовании слабого основания с титрантом в среде протогенного растворителя, усиливающего основные свойства анализируемого вещества. Титрант – раствор хлорной кислоты, среда - безводная уксусная кислота, индикатор – кристаллический фиолетовый. Навеску анализируемого вещества растворяют в безводной уксусной кислоте: R3N + CH3COOH → R3N+− H + CH3COO- При приготовлении титранта образуются перхлорат-ион и ион ацетония: HClO4 + CH3COOH → ClO4- + CH3COOH2+ При титровании: CH3COO- + CH3COOH2+ → 2 CH3COOH, а R3N+− H + ClO4- → [ R3N+− H ] ClO4- Э=М 26 Соли галогенводородных кислот аминов определяют в присутствии уксусного ангидрида или ацетата ртути (II) для связывании галогенид-ионов в труднодиссоциируемое соединение, в связи с тем, что галогенид-ионы который могут выделяться при титровании могут вступать вновь в реакцию солеобразования с анализируемым соединением и ионизировать даже в неводной среде. 2 R3N . HCl + 2 HClO4 + Hg(CH3COO)2 → 2 [ R3N+− H ] ClO4- + Hg Cl2↓ + 2 CH3COOH 2. Алкалиметрия в смешанной среде (для солей). Метод вытеснения. Основан на вытеснении слабого основания из его соли. Титрант – раствор натрия гидроксида, индикатор - фенолфталеин. Титруют в присутствии органического растворителя, который добавляют для извлечения выделяющегося основания. R3N . HCl + NaOH + спиртохлороформная смесь (1:2) → R3N↓ + NaCl + H2O Э=М 3. Йодометрия. Вариант комплексообразования, способ обратного титрования. Метод основан на образовании перйодидов аминов с раствором йода в кислой среде. R3N . HCl + nI2 + KI → R3N . nI2 . HI↓ + KCl I2 + 2 Na2S2O3 → Na2S4O6 + 2 NaI Э=М/2n, где n – количество молекул йода, которое идет на реакцию комплексообразования. Этим методом определяют кофеин в составе кофеин-бензоата натрия. |
