5fan_ru_Функциональный анализ органических лекарственных веществ. Функциональный анализ органических лекарственных веществ
 Скачать 1.02 Mb. Скачать 1.02 Mb.
|
|
Амидная группа: R—C—NH—R1 || O Амидная группа включает остаток кислоты и амина (ароматического или алифатического). Ее содержат производные салициловой кислоты, п-аминофенола, ксикаин, тримекаин, производные никотиновой кислоты, новокаинамид, левомицетин, антибиотики-β-лактамиды. Идентификация 1. Гидролитическое разложение (гидролиз) в присутствии кислоты и щелочи. Кислоту и амин, образующиеся при гидролизе, идентифицируют известными реакциями. Например, гидролиз парацетомола при нагревании в присутствии кислоты: 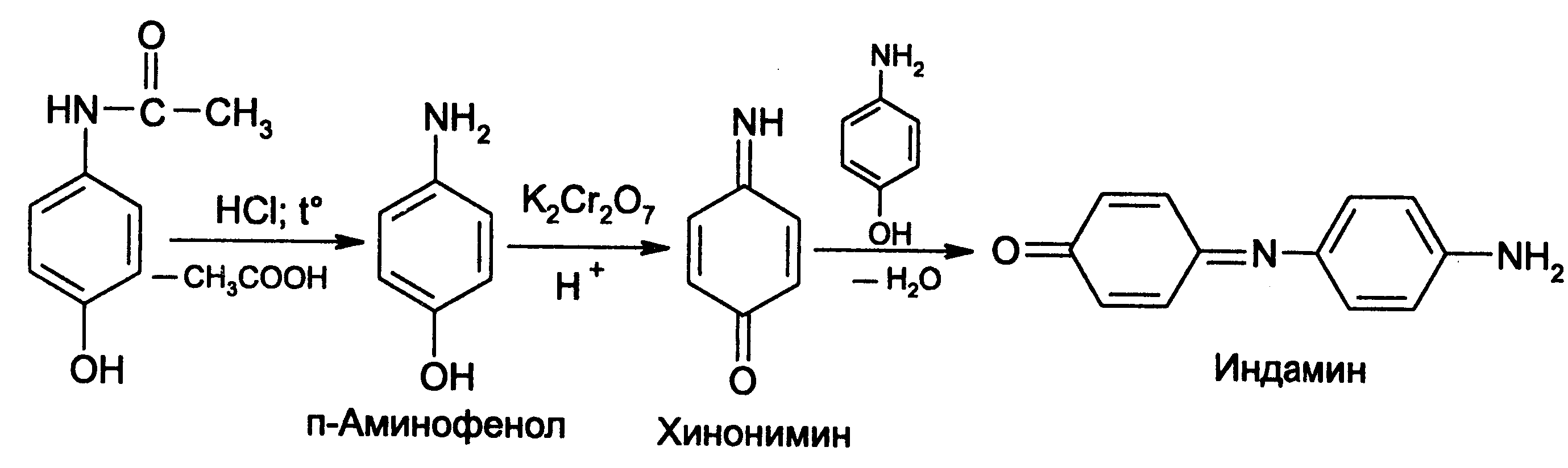 п-аминофенол открывают по образованию индамина фиолетового цвета – аналога индофенола. 27 Если образовавшийся амин летуч, то его определяют по запаху или по посинению красной лакмусовой бумаги. Например, гидролиз салициламида при нагревении в присутствии щелочи: O ║   С—NH2 COONa С—NH2 COONaOH + NaOH → OH + NH3 ↑ 2. Гидроксамовая реакция основана на взаимодействии амидов с гидроксиламином в щелочной среде с образованием гидроксамовых кислот. Гидроксамовые кислоты с ионами железа и меди в кислой среде образуют окрашенные комплексные соли - гидроксаматы. См. сложно-эфирную группу. Количественное определение 1. Метод Кьельдаля. Этот метод подробно описан в ОФС ГФ. Основан на минерализации амидов концентрированной серной кислотой. Образующийся сульфат аммония разлагают щелочью до аммиака, который перегоняют с водяным паром и улавливают борной кислотой. R—C—NH—R1 + H2SO4к. + CuSO4 + K2SO4 → (NH4)2SO4 + CO2↑+ H2O || катализаторы O (NH4)2SO4 + 2 NaOH → NH3↑ + Na2SO4 + 2 H2O → NH4BO2 + H2O NH3 + H3BO3 —| → (NH4)2B2O7 Полученные аммонийные соли борной кислоты оттитровывают хлористоводородной кислотой: NH4BO2 + HCl (NH4)2B2O7 + HCl } → H3BO3 + NH4Cl Э=М 2. Видоизмененный метод Кьельдаля. Это метод, основанный на гидролитическом разложении амидов в присутствии натрия гидроксида и дальнейшем определение образовавшегося аммиака по методу Къельдаля. 3. Фотоколориметрия (ФЭК) и спектрофотометория (СПФ) на основе гидроксамовой реакции. Лактамная группа: R—CH—(CH2)n—C=O |____ NH ____| Образуется из аминокислот и является внутримолекулярным (циклическим) амидом. Её содержат пенициллины и цефалоспорины. Идентификация 28 Лактамы более реакционноспособны, чем амиды, поэтому реакции гидролиза и гидроксамовая протекают легче и даже при комнатной температуре. 1. Гидроксамовая реакция является фармакопейной для антибиотиков бета-лактамной группы - гидроксамовую кислоту доказывают по образованию гидроксамата меди или железа. 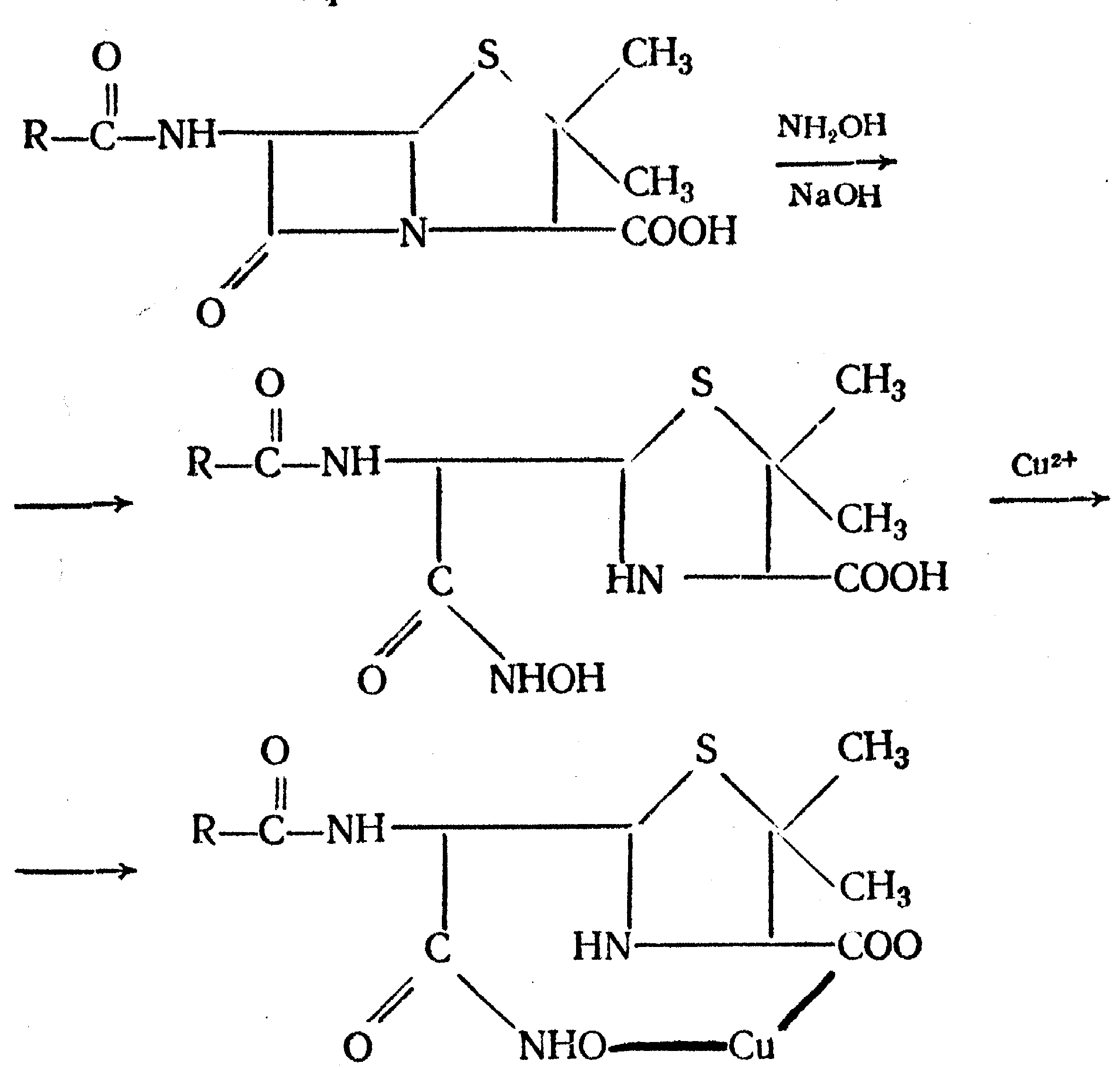 2. Гидролитическое разложение для идентификации лактамной группы не применяется, но находит применение в количественном анализе. Количественное определение 1. Алкалиметрия. Вариант гидролиза, способ обратного титрования. Метод основан на гидролитическом разложении лактамов в присутствии избытка титрованного раствора щелочи, который далее оттитровывают кислотой. Индикатор – фенолфталеин. 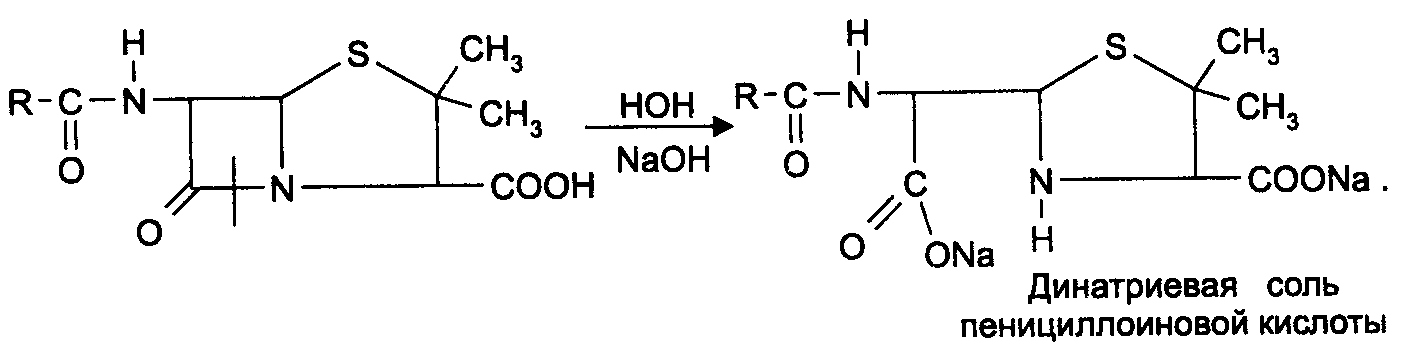 NaOH + HCl → NaCl + H2O Э=М 2. Фотоколориметрия (ФЭК) и спектрофотометория (СПФ) на основе гидроксамовой реакции. Имидная группа: —С—NH—C— || || O O Входит в структуру барбитуратов, производных урацила, ксантина, 5-нитрофурана. 29 Идентификация Имидная группа обуславливает слабые кислотные свойства лекарственных веществ, т.к. электронная плотность с атома азота смещена к атомам кислорода карбонильных групп, вследствие чего атом водорода приобретает подвижность. Для этих соединений также характерна имидо-имидольная таутомерия: 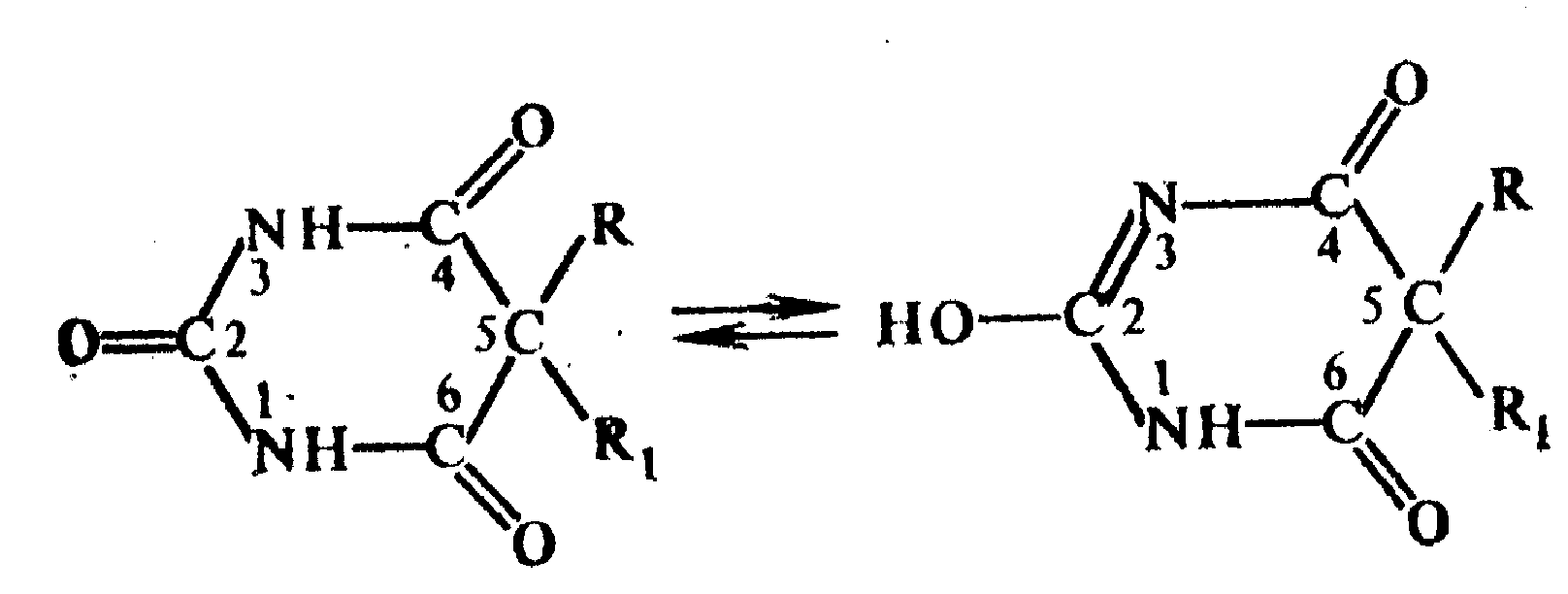 Идентификация В анализе используются реакции, в основе которых лежат кислотные свойства препаратов. 1. Реакции с ионами тяжелых металлов (меди, кобальта, серебра), в результате которых образуются трудно растворимые комплексные соли. При выполнении реакции кислотные формы предварительно растворяют в растворе щелочи или натрия карбоната, избегая избытка, а затем прибавляют раствор соответствующего реактива, а солевые формы растворяют в воде. Реакцию проводят в нейтральной среде и в присутствии кальция хлорида, чтобы избежать образования осадков гидроксидов металлов. Все барбитураты образуют с хлоридом кобальта комплексы сине-фиолетового цвета. а) Различная окраска медных солей позволяет дифференцировать барбитураты по окраске осадка. Например, барбитал образует с сульфатом меди синее окрашивание, затем осадок красно-сиреневого цвета, фенобарбитал - осадок бледно-сиреневого цвета, не изменяющийся при стоянии, бензонал - серо-голубой осадок и т.д. б) С солями серебра в присутствии натрия карбоната барбитураты образуют осадок белого цвета. Реакция проходит в две стадии: образование монозамещенной серебряной соли, растворимой в избытке натрия карбоната и нерастворимой двузамещенной соли при добавлении избытка реактива: 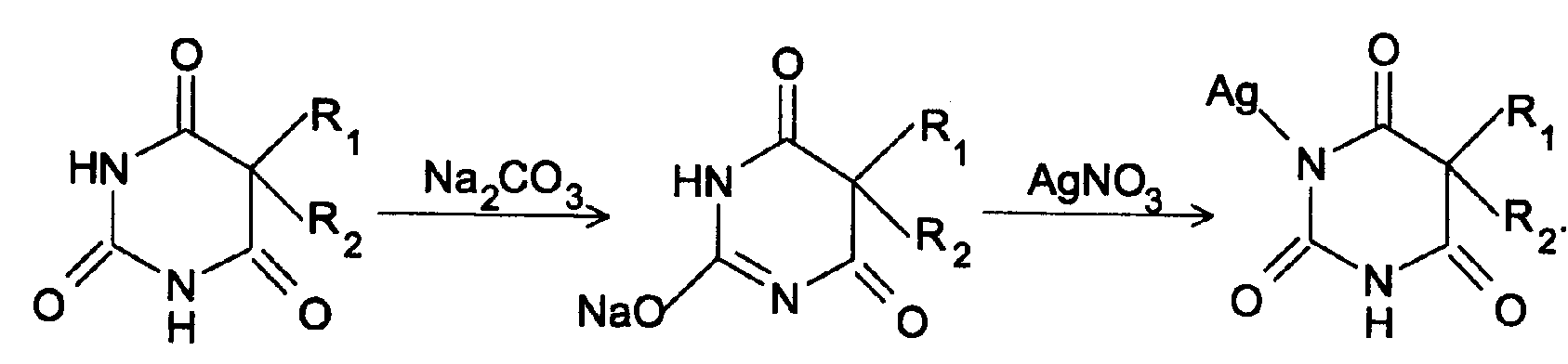 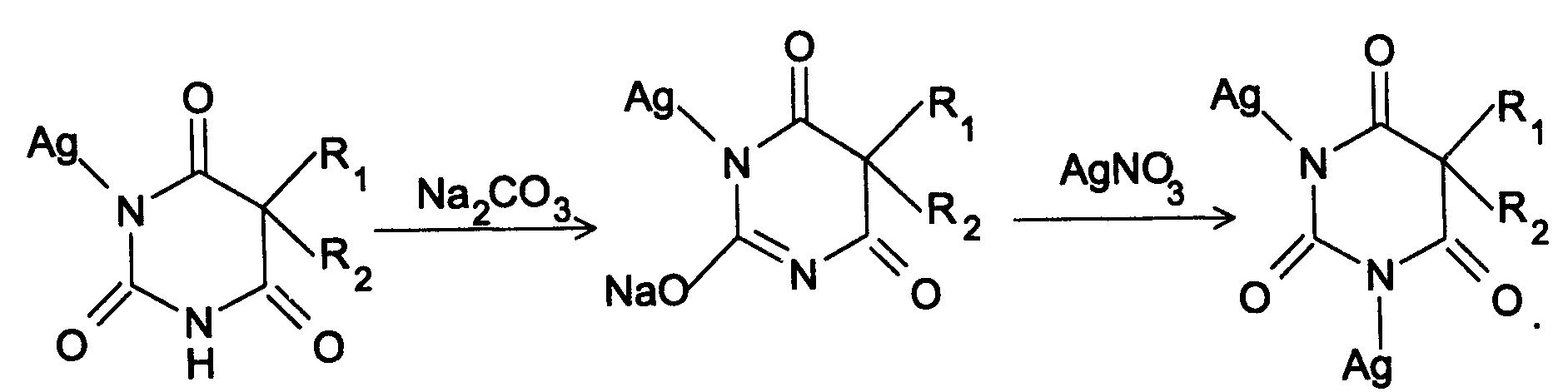 30 2. Реакция вытеснения кислотной формы. Основана на вытеснении слабой органической кислоты из ее соли. Используется в фармакопейном анализе для идентификации натриевых солей барбитуратов. Образующиеся в виде осадка органические кислоты отделяют, высушивают и определяют температуру плавления. 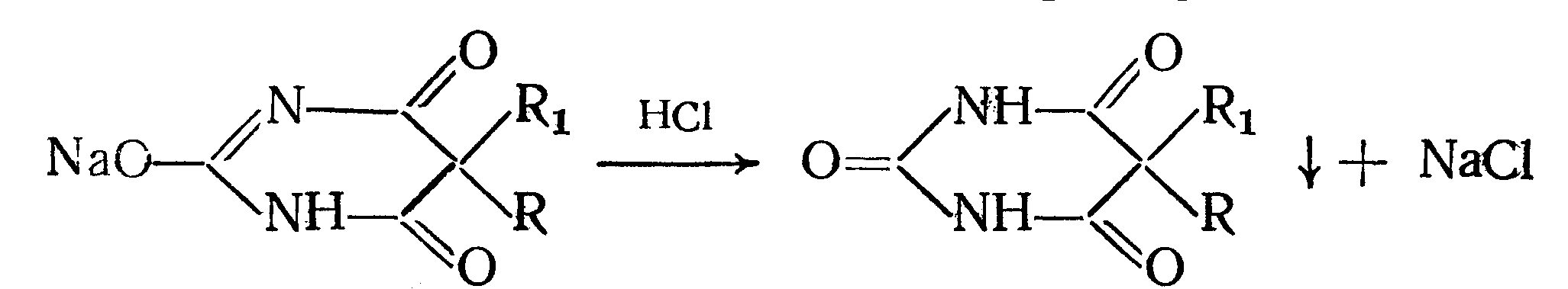 3. При сплавлении с едкими щелочами препараты разрушаются с выделением аммиака:  Количественное определение 1. Кислотно-основное титрование в неводных средах. Метод основан на слабовыраженных кислотных свойствах, обусловленных наличием имидной группы. Среда – протофильный растворитель ДМФ, титрант – метилат натрия, индикатор – тимоловый синий. 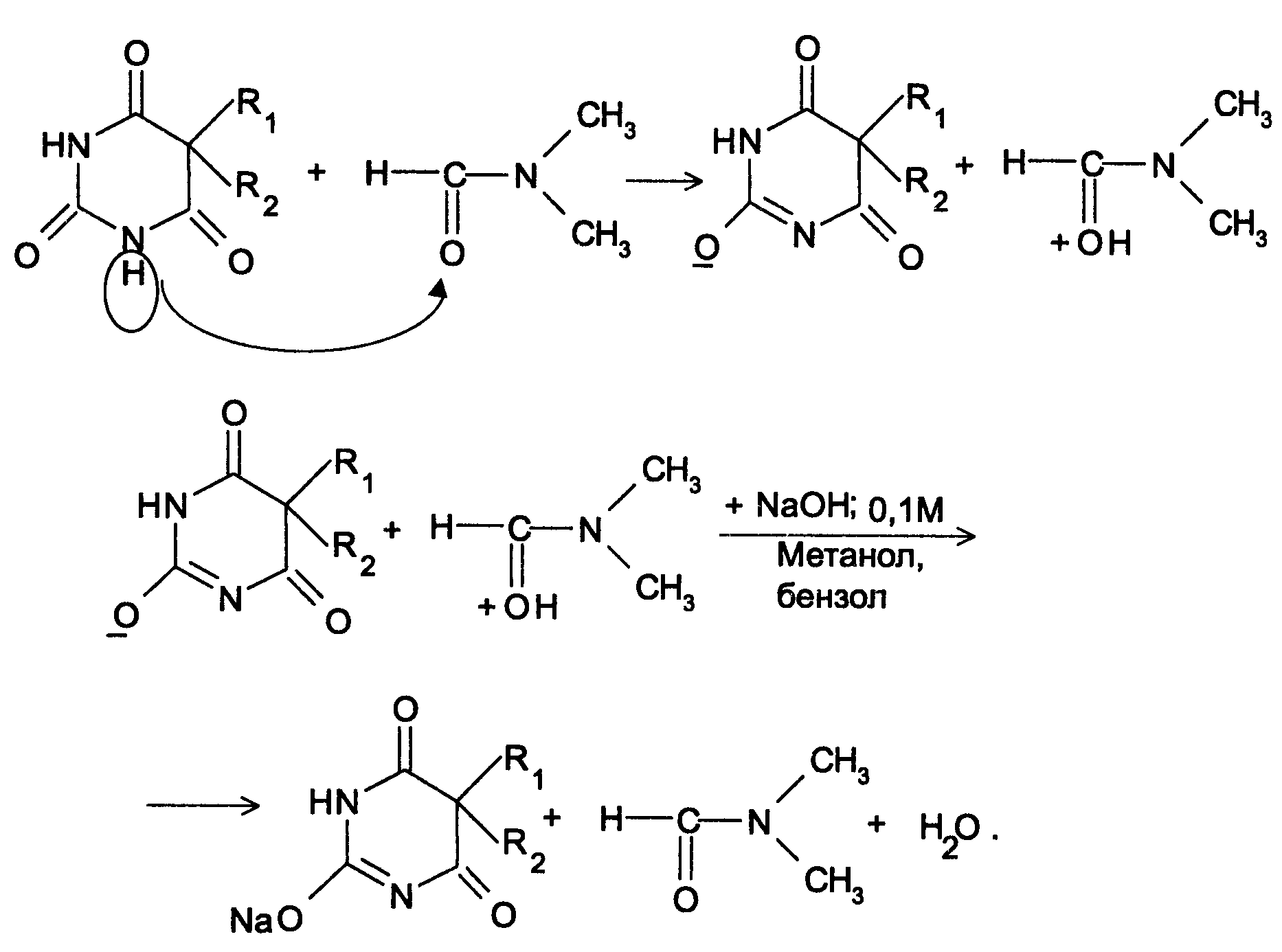 Э=М Э=М2. Алкалиметрия (для кислотных форм). Вариант нейтрализации. Прямое титрование. Метод основан на кислотных свойствах веществ, содержащих имидную группу. Определение проводят в водно-спиртовом или водно-ацетоновом растворе. Индикатор – тимолфталеин. 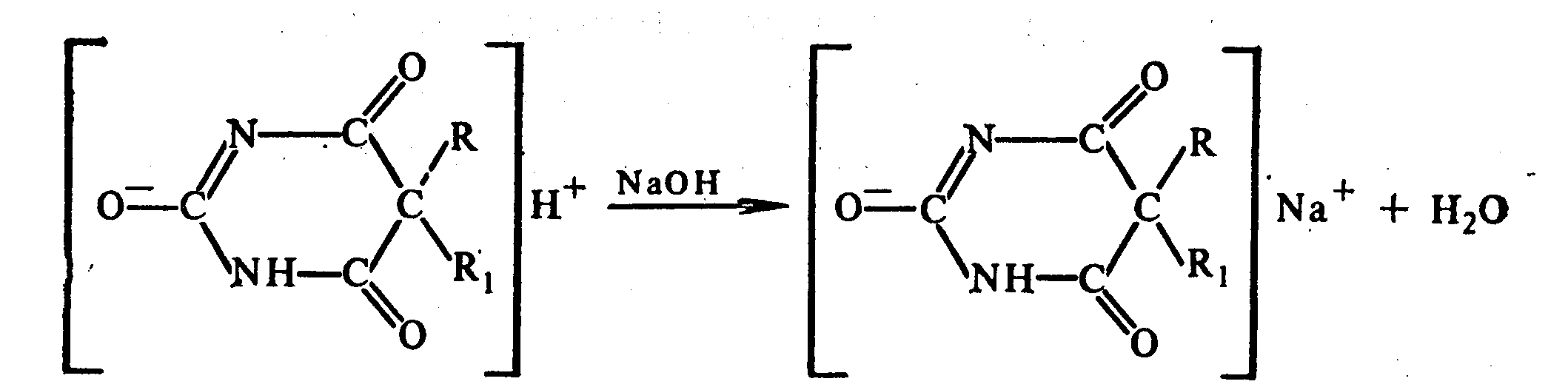 Э=М Э=М31 3. Ацидиметрия (для солевых форм). Вариант вытеснения, способ прямого титрования. Метод основан на вытеснении слабых органических кислот из их солей сильной минеральной кислотой. Титруют в присутствии эфира для извлечения образующейся кислотной формы препарата. Индикатор – метилоранж или смешанный (метилоранж с метиленовым синим). Химизм см. выше. Э=М. 4. Аргентометрия. Метод основан на количественном взаимодействии имидной группы препаратов с серебра нитратом в присутствии натрия карбоната, с образованием однозамещенных серебряных солей. а) Титруют без индикатора до устойчивой мути, которую образует в точке эквивалентности двузамещенная серебряная соль. Э=М. б) При определении в присутствии индикатора калия хромата в слабощелочной среде (создается натрия тетраборатом) сначала осаждается двузамещенная соль серебра, а в точке эквивалентности избыточная капля титранта реагирует с индикатором, образуя кирпично-красный осадок. Э=М/2 5. Косвенная алкалиметрия. Вариант нейтрализации, способ косвенного определения. Метод основан на свойстве имидной группы образовывать трудно растворимые соли серебра, что сопровождается выделением эквивалентного количества азотной кислоты, которую определяют алкалиметрически. Индикатор – феноловый красный. 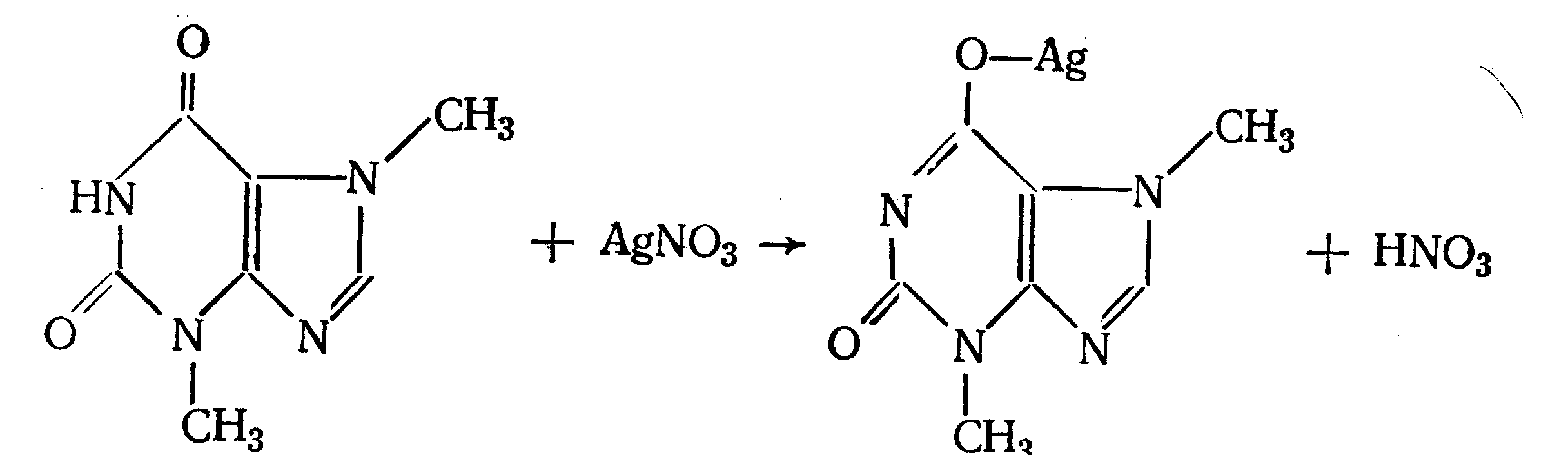 HNO3 + NaOH → NaNO3 + H2O Э=М 6. Фотоколориметрия (ФЭК) и спектрофотометория (СПФ) на основе реакций комплексообразования, определение проводят в присутствии органического растворителя для извлечения образующихся комплексов. Сульфамидная группа: —SO2—NH— Сульфамидная группа входит в структуру сульфаниламидов, производных амида хлорбензолсульфоновой кислоты, замещенных сульфонилмочевины. Лекарственные вещества, содержащие сульфамидную группу, также являются слабыми кислотами, что обусловлено электроноакцепторными свойствами сульфогруппы и связанным с ними перераспределением электронной плотности. В соответствии с этим сульфаниламиды могут находится в двух таутомерных формах: амидной и аци-форме. 32 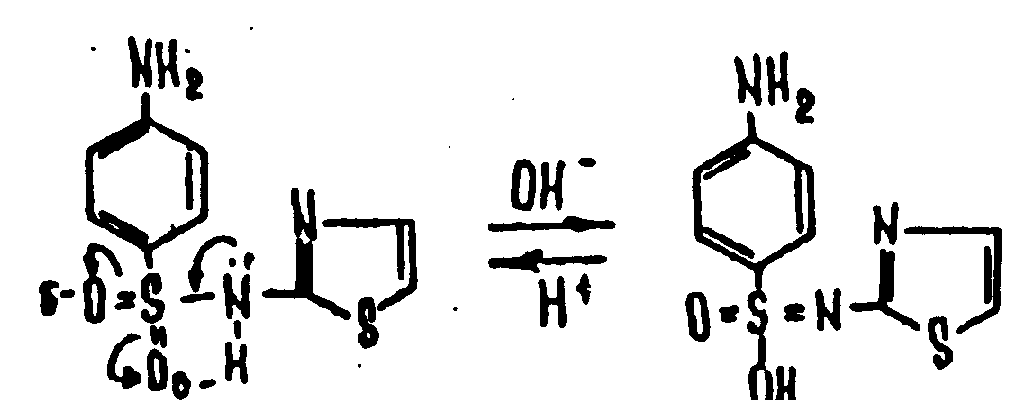 амидная аци-форма Идентификация В анализе используются реакции, в основе которых лежат кислотные свойства препаратов. Реакции с ионами тяжелых металлов, в результате которых образуются трудно растворимые комплексные соли. При выполнении реакции кислотные формы предварительно растворяют в растворе щелочи, избегая ее избытка, а затем прибавляют раствор соответствующего реактива, а солевые формы растворяют в воде. а) Различная окраска медных солей позволяет дифференцировать сульфаниламиды по окраске осадка. Например, сульфацил-натрия образует с меди сульфатом осадок голубовато-зеленого цвета, норсульфазол – грязно-фиолетового цвета, сульфадимезин – желтовато-зеленого цвета, переходящий в коричневый и т.д.  б) С солями серебра сульфаниламиды образуют осадок белого цвета. 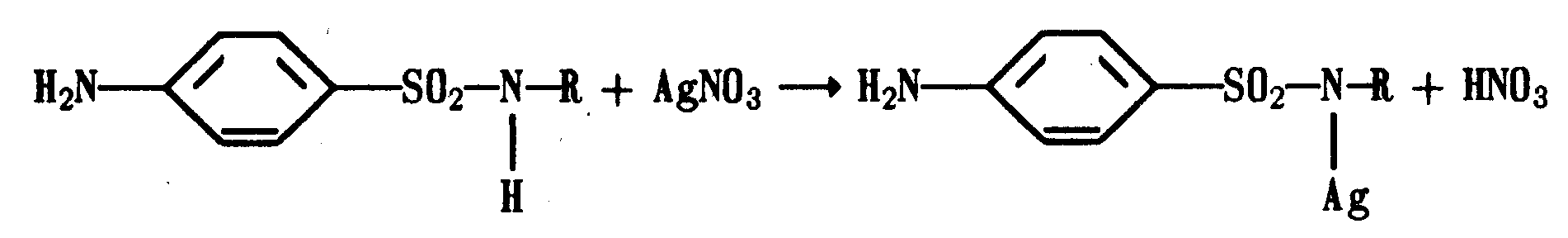 Количественное определение 1. Кислотно-основное титрование в неводных средах. Метод основан на слабовыраженных кислотных свойствах, обусловленных наличием сульфамидной группы. Среда – протофильный растворитель ДМФ, который предварительно нейтрализуют. Титрант – натрия гидроксид в смеси метанола и бензола, индикатор – тимоловый синий. Стрептоцид не титруют в ДМФ, используют н-бутиламин. 2. Алкалиметрия (для кислотных форм). Вариант нейтрализации. Прямое титрование. Метод основан на кислотных свойствах веществ, содержащих сульфамидную группу. Определение проводят в спирте или водно-ацетоновом растворе. Индикатор – тимолфталеин. 33 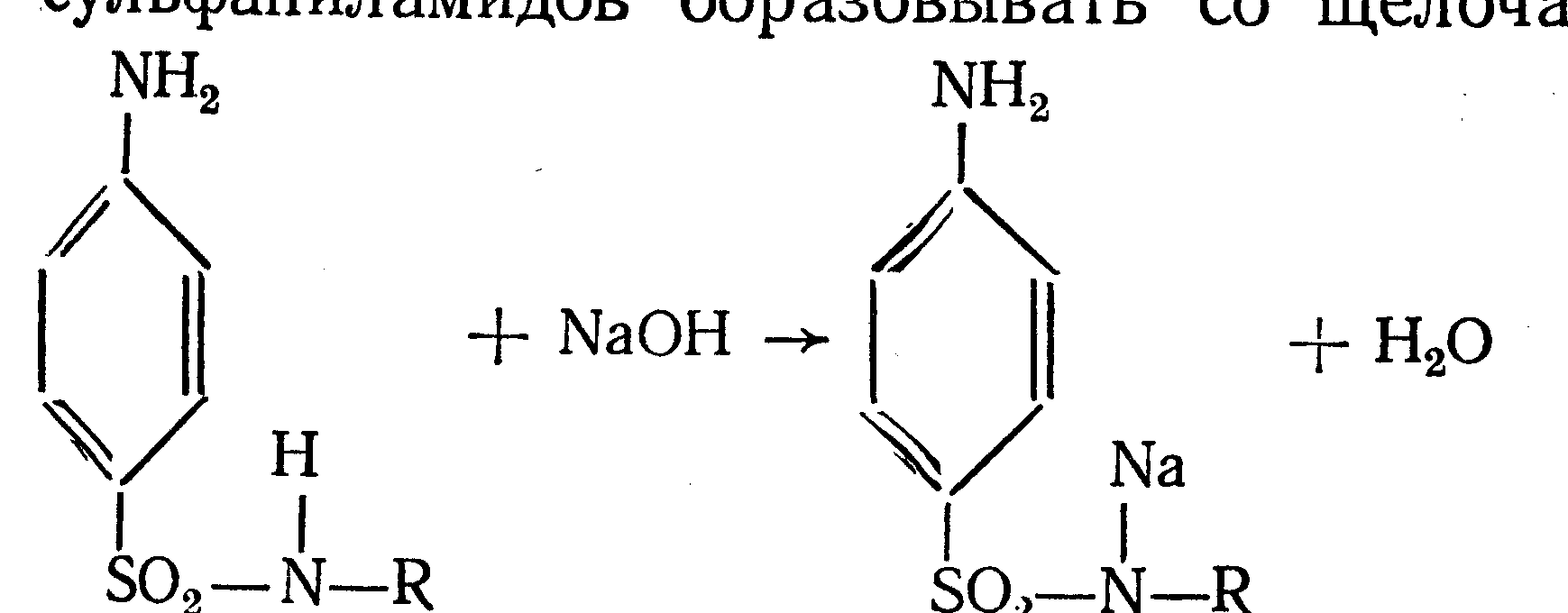 Э=М Э=М3. Ацидиметрия (для солевых форм). Вариант вытеснения, способ прямого титрования. Метод основан на вытеснении слабых органических кислот из их солей сильной минеральной кислотой. Титруют в спирто-ацетоновой среде. Индикатор – метилоранж. 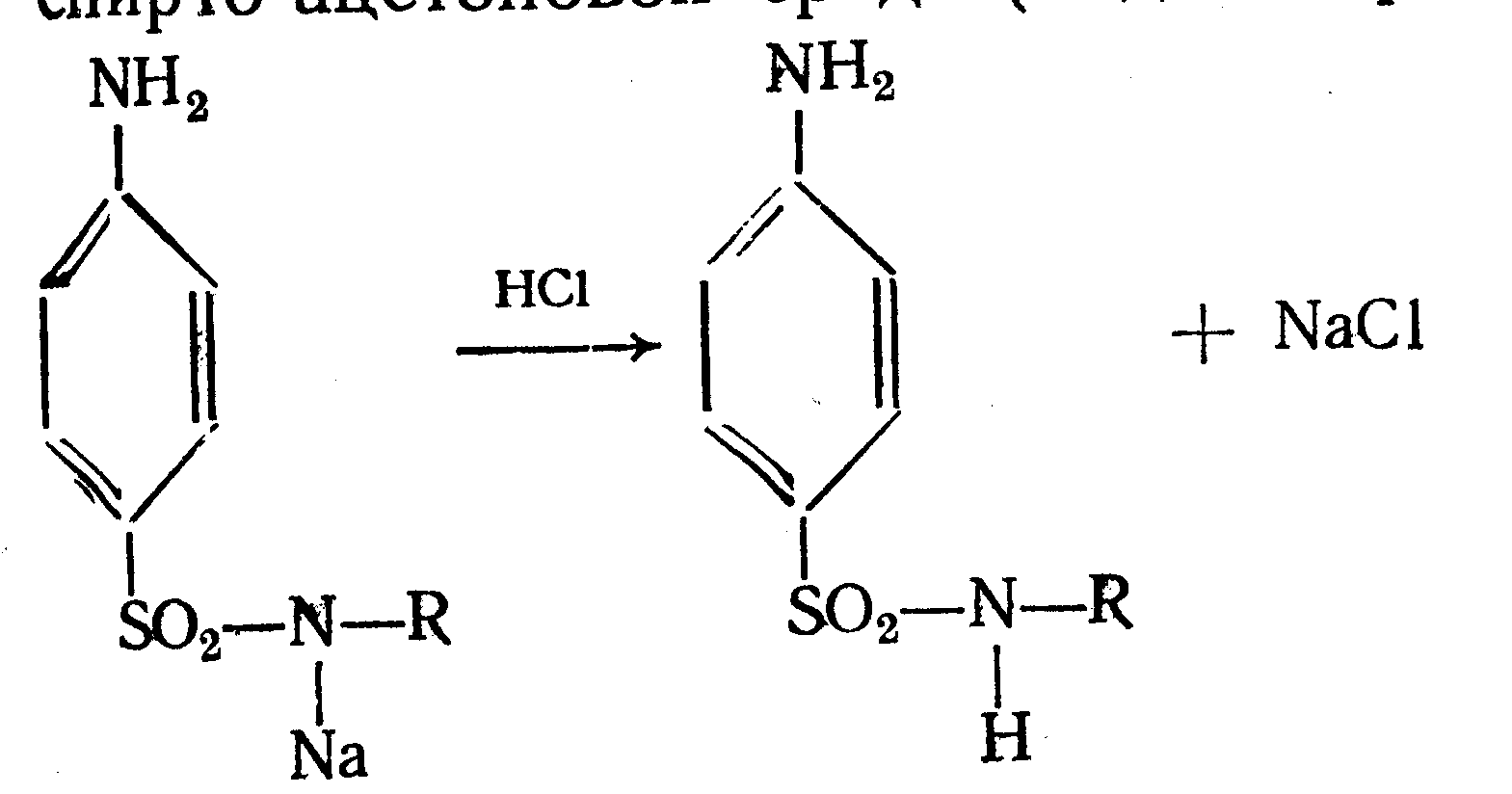 Э=М Э=М4. Аргентометрия. Метод основан на количественном взаимодействии сульфамидной группы препаратов с серебра нитратом. Титруют в присутствии индикатора калия хромата в слабощелочной среде. Для снижения концентрации ионов водорода, растворяющих осадок, добавляют буру: 2 HNO3 + Na2B4O7 + 5 H2O → 4 H3BO3 + 2 NaNO3 5. Косвенная алкалиметрия. Вариант нейтрализации, способ косвенного определения. Метод основан на свойстве сульфамидной группы образовывать трудно растворимые соли серебра, что сопровождается выделением эквивалентного количества азотной кислоты, которую определяют алкалиметрически: HNO3 + NaOH → NaNO3 + H2O Э=М Индикатор – феноловый красный. 6. Фотоколориметрия (ФЭК) и спектрофотометория (СПФ) на основе реакций комплексообразования, определение проводят в присутствии органического растворителя для извлечения образующихся комплексов. Азометиновая группа: —СН = N— Азометиновая группа образуется на одной из стадий синтеза в результате взаимодействия промежуточных продуктов, содержащих альдегидную (или кетонную) и первичную ароматическую (или алифатическую) аминогруппы. Ее содержат производные 5-нитрофурана, бензодиазепина, гидразоны никотиновой кислоты. Идентификация 34 Гидролитическое разложение по двойной связи азот-углерод с образованием исходных продуктов: аминопроизводного и альдегида (или кетона), которые доказывают известными реакциями. Например при гидролизе фтивазида образуется ванилин, который обнаруживают по запаху или по реакции на альдегидную группу: 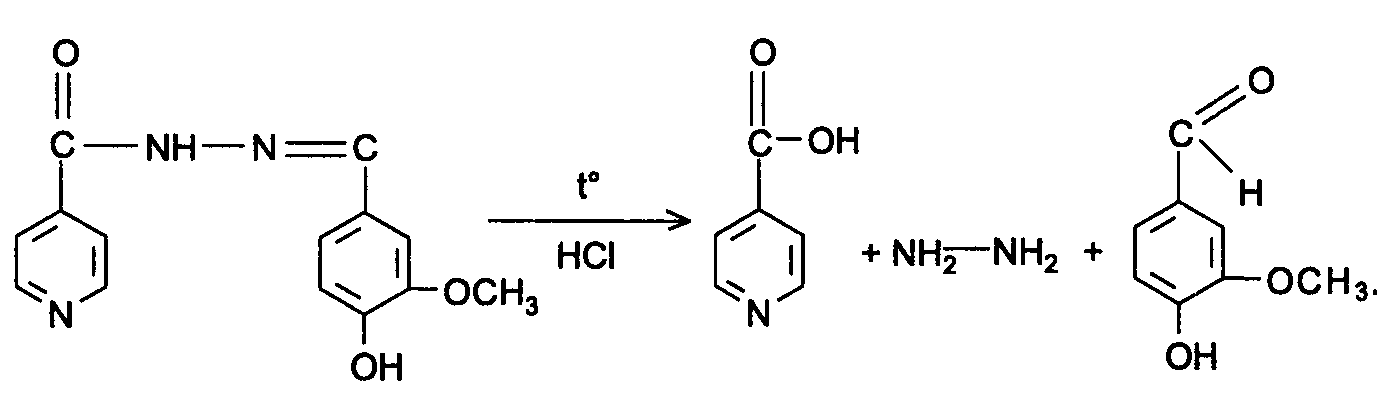 Количественное определение Реакция гидролиза по азометиновой связи выступает как промежуточная стадия. Образующиеся соединения определяют затем подходящим титриметрическим или физико-химическим методами. Например, йодатометрическое определение фтивазида. Препарат подвергают кислотному гидролизу, затем добавляют хлороформ и титруют свободный гидразин раствором калия йодата до обесцвечивания хлороформного слоя: 5 NH2-NH2 + 4 KIO3 + 4 HCl → 5 N2 + 2 I2 + 4 KCl + 12 H2O KIO3 + 2 I2 + 6 HCl → 5 ICl + KCl + 3 H2O |
