Океанология. Часть I. Физические явления и процессы в океане - Безруков Ю.Ф.. Океанология. Часть I. Физические явления и процессы в океане - Б. Министерство науки и образования Украины Таврический национальный университет им. В. И. Вернадского
 Скачать 14.3 Mb. Скачать 14.3 Mb.
|
5. Строение и химический состав морской воды5.1. Молекулярное строение воды и ее аномалии"Начало всего есть вода", - справедливо отмечал Фалес из Милета в VI веке до н.э. Действительно вода - одно из самых уникальных веществ на Земле. Внешне вода кажется достаточно простой, в связи с чем долгое время считалась неделимым элементом. В XVII веке Х.Гюйгенс (Голландия) предложил принять температуру кипения воды и таяния льда за опорные точки шкалы температур. В 1766 году Г. Кавендиш (Англия) и затем в 1783 году А. Лавуазье (Франция) показали, что вода не простой химический элемент, а соединение водорода и кислорода в определенной пропорции. А.Лавуазье вывел её формулу – Н2О. После этого открытия химический элемент, обозначаемый как Н, получил название "водород" (hydrogen - от греч. hydro genes), которое можно истолковать как "порождающий воду". Вода - исключительное природное соединение. Необыкновенность воды заключается в наличии у ней многих аномальных свойств. Почти все физико-химические свойства воды - исключение в природе, и только благодаря этим аномалиям воды возможна жизнь на нашей планете, по крайней мере в той форме, в которой она существует. Многие физико-химические свойства воды обусловлены строением молекулы, которое создает вокруг нее специфическое электромагнитное поле, ориентирует молекулы воды относительно друг друга и связывает их. В молекуле воды H2O два атома водорода Н тесно связаны с одним атомом кислорода О. Молекулярная масса воды 18, из них 16 единиц дает кислород, а 2 - водород. Размер молекулы определяется средним расстоянием между ядрами О и Н и составляет примерно 0,1 ммк (10-10 м). Атомы кислорода и атомы водорода ведут себя не как отдельные объекты. Каждый из них стремится соединиться с другими атомами. О и Н состоят из ядер, содержащих плотно упакованные нейтроны и протоны, и обращающихся вокруг них электронов. Именно расположение электронов на внешнихоболочках (орбиталях) атома определяет, как этот атом взаимодействует с другими атомами. Атом кислорода содержит 8 электронов, атом водорода только 1. Представить себе, как соединяются в пространстве атомы кислорода и водорода, можно следующим образом. Центральное место занимает тяжелое ядро атома кислорода: два его электрона образуют тесно связанную пару на внутренней оболочке, а остальные шесть электронов занимают внешнюю оболочку (рис. 3). В соответствии с правилами заполнения электронных оболочек она более устойчива, когда заполнена восемью электронами; поэтому атому кислорода не хватает двух электронов для того, чтобы находиться в наиболее предпочтительномдля себя состоянии. Каждый атом водорода также нуждается в одном электроне, который мог бы составитъ пару его единственному электрону. Соединяясь, два атома водорода и один атом кислорода передают друг другу свои электроны, образуя весьма устойчивую молекулу; иными словами, образующаяся молекула с общими электронами идеально удовлетворяет правилу заполнения электронных оболочек. Такая молекула основана на наличии водородных связей. Эти связи не химической природы. Они легко разрушаются и быстро восстанавливаются, что делает структуру воды исключительно изменчивой. Х 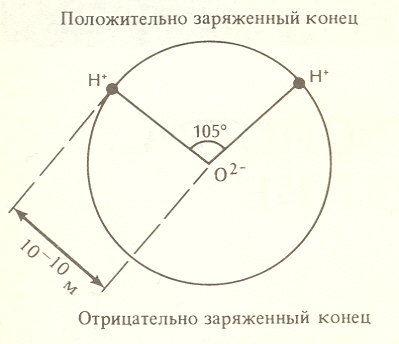 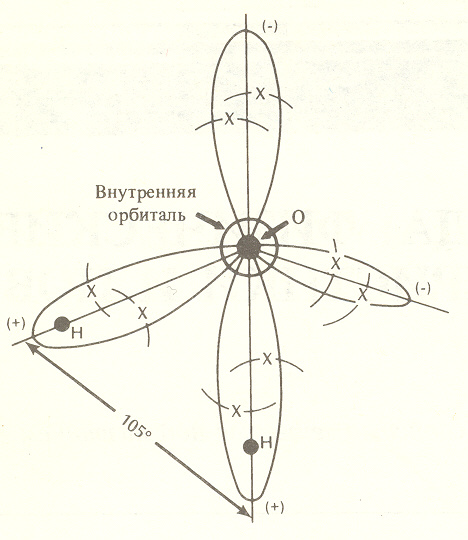 отя передача электронов дает физически устойчивую молекулу, электрическое поле вокруг нее оказывается неоднородным. Если, находясь в атоме водорода, его электрон нейтрализует положительно заряженный протон в ядре, то в молекуле воды он часть своего времени находится в оболочке атома кислорода. В результате вблизи ядер атомов водорода возникают положительные заряды. отя передача электронов дает физически устойчивую молекулу, электрическое поле вокруг нее оказывается неоднородным. Если, находясь в атоме водорода, его электрон нейтрализует положительно заряженный протон в ядре, то в молекуле воды он часть своего времени находится в оболочке атома кислорода. В результате вблизи ядер атомов водорода возникают положительные заряды. Рис.3. Молекула воды: ● ядро атома кислорода О или водорода Н, х - электрон, общий для атомов кислорода и водорода, (+) и (-) области результирующего электрического заряда в молекуле Аналогичным образом у кислородного конца молекулы должен существовать отрицательный заряд. Расположенные по разные стороны заряды образуют так называемый электрический диполь. С ним связаны многие уникальные свойства воды. Например, если поместить воду во внешнее электрическое поле, молекулы воды выстроятся так, что их дипольные моменты будут ориентированы вдоль поля; этим объясняется то, что вода обладает большой диэлектрической проницаемостью - 80 единицам (например, диэлектрическая проницаемость воздуха равна всего 1). Следовательно, в воде два любых заряда притягиваются друг к другу в 80 раз слабее, чем в воздухе. Благодаря этому вода является исключительно сильным растворителем. До 30-x годов прошлого века считалось, что все вещества, в том числе кислород и водород, представляют собой простые химические элементы или их соединения. Однако простые химические элементы на самом деле представляют смесь нескольких элементов - изотопов, обладающих близкими атомными весами, т. е. массами ядер. Различие ядер по массам, а, следовательно, и по физическим свойствам объясняется тем, что при одном и том же числе протонов ядра имеют разное число нейтронов. В настоящее время установлено пять изотопов водорода. Из них наиболее существенное значение имеют первые два: изотоп Н1 с массовым числом 1, равным числу протонов, который называют легким водородом, и изотоп Н2 = D с массовым числом 2, равным сумме протона и нейтрона, названный дейтерием. Кислород также имеет несколько изотопов, основными из которых являются О16 с массовым числом 16, равным сумме 8 протонов и 8 нейтронов, О17 с массовым числом 17 (8 протонов + 9 нейтронов) и О18 с массовым числом 18 (8 протонов + 10 нейтронов). Таким образом, в природе кислород представляет смесь различных атомов в соотношении О16: О17: О18 = 3150 : 5: 1. В воде встречаются различные комбинации изотопов кислорода и водорода. Основная масса воды состоит из молекул чистой воды H Таким образом, за химической формулой Н2О скрывается вещество, обладающее уникальной структурой и многими аномальными свойствами. Наиболее важные из аномалий воды следующие: 1. Аномалия плотности. Плотность большинства веществ - жидкостей, кристаллов и газов - при нагревании уменьшается, а при охлаждении увеличивается, вплоть до процесса кристаллизации или конденсации. Плотность воды при охлаждении от 100 до 4оС возрастает, однако, достигнув максимального значения при температуре 4оС, плотность при дальнейшем охлаждении воды начинает уменьшаться. Другими словами, максимальная плотность воды (1.00 г·см-3) наблюдается при температуре 4оС, а не при температуре замерзания 0оС. 2. Аномалия изменения объема при замерзании. Замерзание воды сопровождается скачкообразным уменьшением плотности почти на 10% и плотность пресного льда равна 0,9 г·см-3. Плотность большинства других тел, кроме висмута и галлия, увеличивается при переходе из жидкого состояния в твердое. При замерзании вода увеличивает свой объемпочти на 10%. В связи с этим лед занимает больший объем, чем жидкая вода, и держится на ее поверхности. 3. Аномалия удельной теплоемкости. Теплоемкость воды аномально высока. Она в 3100 раз больше, чем у воздуха, в 4 раза больше, чем у горных пород. Чтобы нагреть определенное количество воды на один градус, необходимо затратить больше энергии, чем при нагреве других жидкостей, - по крайней мере вдвое по отношению к простым веществам. Из этого вытекает уникальная способность воды сохранять тепло. Подавляющее большинство других веществ таким свойством не обладают. Кроме того при плавлении льда (0°С) отмечается увеличение удельной теплоемкости с 0,49 в твердой фазе до 1,009 кал/(г·град)в жидкой. Затем теплоемкость воды до температуры около 37°С уменьшается и только после этого начинает увеличиваться. Вода единственное вещество на Земле (кроме ртути), для которого зависимость удельной теплоемкости от температуры имеет минимум. Из-за того, что удельная теплоемкость воды имеет этот минимум около 37оС, нормальная температура человеческого тела, состоящего на две трети из воды, находится в диапазоне температур 36-38оС. 4. Аномалия теплоты плавления. Вода обладает высокой удельной теплотой плавления. Теплота плавления льда равна 79,7 кал·г-1, т. е. вода и лед при 0°С отличаются по содержанию скрытой энергии почти на 80 калорий. Воду очень трудно заморозить, а лед - растопить. Благодаря этому климат на Земле в целом достаточно стабилен и мягок. 5. Аномалия скрытой теплоты парообразования. Скрытая теплота парообразования очень велика - 539 кал·г-1 при температуре 100°С. Для испарения единичного объема воды, нагретого до 100°С требуется в 5,5 раз больше тепла, чем для нагрева её от 0° до 100°С. Из-за того, что огромное количество тепла принадлежит воде в парообразной фазе, перенос пара в атмосфере играет определяющую роль в переносе в полярные районы избытка тепла, образующегося при поглощении солнечного тепла в тропиках. 6. Аномалия диэлектрической постоянной. Диэлектрическая постоянная воды при 20°С равна 81 единице, а у большинства других веществ она находится в пределах от 2 до 3 единиц. Прямым следствием такой большой диэлектрической постоянной, с химической точки зрения, является сильное ионизирующее свойство воды (расщепление растворенных веществ на ионы) и параллельная ей большая способность к растворению различных веществ. 7. Аномалия коэффициенат преломления света. Коэффициент преломления света в воде 1.34. По волновой теории света он должен быть равным 9. 5.2. Химический состав морской водыВода как растворитель обладает свойством растворять различные вещества. Растворяющая способность воды определяется ее диэлектрической проницаемостью. Как уже указывалось, при комнатной температуре диэлектрическая проницаемость воды равна 81. Это значит, что два противоположных электрических заряда взаимно притягиваются в воде, с силой, равной 1/81 силы их взаимодействия в воздухе. Таким образом, отделение ионов от кристалла какой-либо соли в воде в 81 раз легче, чем в воздухе. Если воде дать достаточно времени, она может растворить практически любое твердое вещество. Из-за уникальной растворяющей способности воды до сих пор не удалось получить химически чистую воду - она всегда содержит растворенный материал сосуда. Поэтому в природе не встречается химически чистая вода. Морская вода отличается от вод суши более богатым качественным составом растворенных в ней веществ, и поэтому все ее свойства оказываются отличными от свойств пресной воды. Особенностью морской воды как раствора является то, что она представляет слабый и поэтому полностью ионизированный раствор, содержащий большое количество частиц. Размеры растворенных в морской воде частиц весьма разнообразны. Поэтому морская вода может в отдельных случаях вести себя как молекулярный или кристаллоидный раствор, когда размеры растворенных частиц меньше 10-7 см. При увеличении размеров растворенных неорганических и органических веществ она приближается к коллоидным, а вблизи побережий к мутным растворам. В таких растворах происходит постепенное соединение растворенных веществ и осаждение вследствие увеличения их веса. По массе в воде содержится 11,19 % водорода и 88,81 % кислорода. Однако в морской воде растворены почти все химические элементы таблицы Менделеева. Концентрация некоторых из них столь мала, что их присутствие обнаруживается только в морских организмах, аккумулирующих эти элементы из морской воды. Кроме них в морской воде растворены некоторые газы: кислород, азот, аргон, углекислота, сероводород и некоторое количество органического вещества океанического и материкового происхождения. Весь химический состав морской воды можно подразделить на 5 групп: 1) главные ионы (11 ионов - хлор, натрий, сульфат, магний, кальций, калий, бикарбонат, бром, барит, стронций, фтор), которые составляют 99.98% массы всех растворенных веществ; 2) растворенные газы (O2, N2, CO2, H2S, Ar и другие инертные газы), при этом соотношение в воде O2: N2= 1 : 2 (что было установлено еще А.Лавуазье в 1783 г.), а не 1 : 4, как в воздухе; 3) биогенные элементы (С, Н, N, P, Si, Fe, Mn) и их соединения, из которых состоят морские организмы; 4) группа микроэлементов с концентрацией меньше 1 × 10-6; 5) органические вещества. Среднее количество растворенных в водах Мирового океана твердых веществ составляет около 3.5% по весу и лишь в отдельных морях и заливах, соединенных с океаном, может достигать 4.1% (Красное море, Персидский залив). Больше всего в морской воде содержится хлора - 1.94%, т. е. более 55% всех растворенных в воде твердых веществ. Затем следуют натрий - l.08%, магний - 0.13%, кальций - 0.04%, калий - 0.04% (табл. 4). Таблица 4 Состав природных вод (% по массе)
Приведенные данные свидетельствуют о том, что морская вода характеризуется следующим соотношением ионов: Cl– > SO42– > HCO3– и Na+ > Mg2+ > Ca2+. Главнейшие растворенные в воде элементы обычно находятся не в чистом виде, а в виде соединений (солей). Основными из них являются: 1) хлориды (NaCl, MgCl2, KCl). Они обусловливают горько-соленый вкус воды; 2) сульфаты (MgS04, CaS04, K2S04). 3) карбонаты (СаСОз). Таким образом, в морской воде резко преобладают хлориды и, в первую очередь, NaCl (около 78%), MgCl2 (>9%), KCl (около 2%), затем сульфаты - MgSO4 (свыше 6.5%), CaSO4 (около 3.5%), а на гидрокарбонаты падает менее 1%. В речной воде соотношение между растворенными солями обратное. Больше всего в ней содержится карбонатов (60.1%) и меньше всего хлоридов (5.2 %). Общее содержание твердых веществ, растворенных в морской воде, выражают в тысячных долях весовых единиц - промилле и обозначают знаком ‰. Содержание растворенных твердых веществ, выраженное в промилле, численно равно их весу в граммах в одном килограмме морской воды. В Мировом океане непрерывно идут сложные химические, биологические и геологические процессы, изменяющие состав и содержание растворенных в нем веществ. Эти процессы можно разделить на две группы. Процессы 1-й группы (приток пресных вод, осадки, испарение, образование и таяние льда) меняют общую концентрацию раствора, но не меняют соотношений между растворенными веществами. При этих процессах концентрация раствора может меняться от 0 до 4% (от 0 до 40‰). Процессы 2-й группы (фотосинтез растений и дыхание животных, сильно меняющие содержание газов, деятельность бактерий и деятельность морских организмов, расходующих химические вещества на постройку своих скелетов и панцирей, а также растворение донных отложений) меняют соотношение между растворенными в воде веществами. Эти процессы могут сильно - в несколько раз - изменять содержание фосфатов, нитратов, нитритов и других микроэлементов, имеющих большое биологическое значение, так как они в значительной мере определяют условия жизни в океане. Содержание главных элементов эти процессы почти не затрагивают. Присутствие в морской воде таких элементов, как Na, К, Mg, Са, обусловлено выветриванием горных пород и последующим их выносом реками. Содержание Cl, SO4, Вr обусловлено дегазацией мантии и выносом их в океан через атмосферу или по дну океана. Можно предположить, что солевой состав океана менялся в результате выноса береговым стоком продуктов химического выветривания земной коры и поступления летучих веществ (прежде всего HCl), выделяемых мантией. По А. П. Виноградову 50% солевой массы приходится на долю выветривания, а 50% на долю дегазации мантии. В целом Мировой океан - динамическая система, в которой количество поступающих веществ (речной сток, атмосферная пыль, продукты вулканизма) приблизительно равно количеству убывающих из неё (осаждение, вынос в атмосферу). Изучение проблемы солености морской воды затрагивает почти все разделы науки о море. Скорость диффузии солей в воде - важная часть явления перемешивания, изучаемого физиками. Биологи обращаются к циклу солей при исследовании скорости роста растений. Химики занимаются измерением скоростей газообмена между океаном и атмосферой, временем «жизни» солей и проблемой их выпадения в осадок. Геологи анализируют распределение и возраст таких осадков, а геохимики строят общую картину распределения солей в океанах. По этим причинам необходимо подробно рассмотреть, что же такое соленость морской воды. 5.3. Соленость морской водыСоленый вкус морской воды - наиболее известная ее особенность, также как и одна из самых интересных. В морской воде, лишенной растворенных солей и газов, жизнь в том виде, в каком она сейчас наблюдается, просто не могла бы существовать. Вместе с тем изменения солевого состава Мирового океана на протяжении сотен миллионов лет оказались весьма незначительными, что свидетельствует о его стабильности. Исследования морской воды по поручению Международного совета по изучению морей (МСИМ) были выполнены специальной комиссией под руководством датского химика и океанографа М.Х.К.Кнудсена. Были проанализированы пробы воды с соленостью от 2,69 до 40,18‰, собранные в разных районах Мирового океана. Оказалось, что содержание хлора во всех пробах составляло не менее 55,21% и не более 55,34% от веса всех растворенных веществ. Главным результатом этих исследований было установление стабильности соотношения между растворенными в морской воде веществами для различных частей Мирового океана, которая получила название постоянство солевого состава морской воды. Благодаря этому оказалось возможным составить океанографические таблицы для вычисления солености и удельного веса морской воды по содержанию в ней хлора как химического элемента, содержащегося в наибольшем количестве. Соленость - это общий вес в граммах всех твердых веществ, растворенных в 1000 граммах морской воды, при условии, что фтор, бром, иод замещены эквивалентным количеством хлора, все карбонаты превращены в окислы и все органические вещества сожжены (при 4800С). Соотношение между соленостью S и содержанием хлора Сl – хлорный коэффициент - выражается формулой: S= 1.80655 Сl ‰ Соленость может изменяться в весьма значительных пределах, и тем не менее соотношение отдельных компонентов солевого состава морской воды остается практически постоянным. Правда, моря, частично или полностью отчлененные от Мирового океана и благодаря этому сильно распресненные или, наоборот, осолоненные (Аральское, Каспийское, Азовское, Черное, Балтийское), имеют несколько другие соотношения между соленостью и содержанием хлора. Средняя солёность вод Мирового океана близка к 35.0‰. Практически солёность всегда находят косвенным путём - либо по хлорности (аргентометрическим титрованием), либо по относительной электропроводности (солемерами). В качестве международного стандарта принята так называемая нормальная вода, хлорность которой точно определена. Соленость в океанологии является одной из основных характеристик водных масс, распределения морских организмов, элементов морских течений. Особую роль она играет в формировании биологической продуктивности морей и океанов, так как многие организмы очень восприимчивы к ее незначительным изменениям. 5.4. Растворенные газыВода растворяет газы, с которыми она соприкасается. В морской воде они образуются в результате обмена с атмосферой, биологической деятельности, речного стока и других процессов. Поэтому в воде присутствует кислород O2, азот N2, углекислый газ CO2, сероводород H2S и некоторые инертные газы. Количество растворенных в воде газов зависит от парциального давления того или иного газа и от его растворимости. Растворимость газа, в свою очередь, зависит от температуры и солености воды; она увеличивается с понижением температуры и уменьшением солености. Действительное содержание каждого газа в воде определяется, кроме того, интенсивностью связанных с ним химических и биологических процессов и условиями перемешивания. Поэтому содержание газов обычно выражают в процентах от его насыщающего количества и называют относительным содержанием. За насыщающее принимают то количество газа, которое может раствориться в воде данной температуры и солености при нормальной сухой атмосфере и давлении 1013 мб. Растворенный в морской воде кислород O2 является одним из важнейших биогидрохимических показателей состояния среды. Он обеспечивает существование водных организмов и определяет интенсивность окислительных процессов в морях и океанах. В высоких широтах содержание кислорода в поверхностном слое океана около 8 – 9 мл·л-1 и понижается в тропической зоне до 4–5 мл·л-1. Несмотря на большой расход, его содержание в поверхностном слое почти всегда близко к 100%-ному насыщению при данных температуре, солености и давлении. Это связано с тем, что его убыль постоянно восполняется как в результате фотосинтетической деятельности водорослей, главным образом фитопланктона, так из атмосферы. Последний процесс протекает вследствие стремления концентраций кислорода в атмосфере и поверхностном слое воды к динамическому равновесию, при нарушении которого кислород поглощается поверхностным слоем океана. В зоне интенсивного фотосинтеза (в фотическом слое) часто наблюдается значительное пересыщение морской воды кислородом (иногда до 120-125% и выше). С увеличением глубины его концентрация падает вследствие ослабления фотосинтеза и потребления на окисление органических веществ и дыхание водных организмов, а на некоторых глубинах в верхнем слое его образование и расход примерно одинаковы. Поэтому эти глубины называют слоями компенсации, которые перемещаются по вертикали в зависимости от физико-химических, гидробиологических условий и подводной освещенности; например, зимой они лежат ближе к поверхности. В целом с глубиной дефицит кислорода увеличивается. Растворенный кислород проникает в глубинные слои исключительно за счет вертикальной циркуляции и течений. В некоторых случаях, например, при нарушении вертикальной циркуляции или наличии большого количества легко окисляющихся органических веществ, концентрация растворенного кислорода может снизиться до нуля. В таких условиях начинаются восстановительные процессы с образованием сероводорода, как это имеет место в Черном море на глубинах ниже 150 м. В прибрежных водах значительный дефицит кислорода часто связан с их загрязнением органическими веществами - нефтепродуктами, детергентами, пестицидами. В некоторых случаях, когда перемешивание отсутствует (штиль), в районах, где на поверхности моря находится сильно распресненная вода, содержание кислорода падает до нуля даже в верхних слоях. Это явление, сопровождаемое так называемым «замором» рыбы, обычно наблюдается в предустьевых районах и мелководных морях. Содержание растворенного в морской воде азота N2 изменяется сравнительно мало. Избыток азота образуется за счет восстановления нитратов и распада органических веществ. Растворенный азот усваивается азотофиксирующими бактериями и перерабатывается ими в азотистые соединения, которые затем поглощаются растениями. В поверхностных слоях его относительное содержание всегда близко к 100% и обычно уменьшается с глубиной. Сероводород H2S появляется в морской воде в тех случаях, когда передача на глубину кислорода в силу каких-либо причин затруднена, и, прежде всего, в результате слабого вертикального обмена. Присутствие сероводорода отмечено в некоторых глубоких фиордах Норвегии, в Балтийском, Каспийском, Черном и Аравийском морях. В Черном море содержание сероводорода достигает 6,5 мл·л-1. Поскольку воды моря значительно стратифицированы, а ветровое перемешивание развито лишь до глубины 75-100 м, то ниже этой глубины количество кислорода быстро падает. Начиная с горизонта 100-150 м в воде появляется сероводород. В Аравийском море сероводородная область обнаружена в районе материкового склона к востоку от мыса Рас-Хафун. На глубине более 400 м в придонной пробе содержание сероводорода оказалось равным примерно 19 мл·л-1. Образование сероводорода в морской воде объясняется либо деятельностью гнилостных бактерий, разлагающих органический белок, либо деятельностью сероводородных (анаэробных) бактерий. Появление сероводорода также может быть обусловлено его выносом из находящихся на дне сероводородных источников. Но во всех случаях слабое вертикальное перемешивание и, как следствие его, отсутствие кислорода является необходимым условием накопления сероводорода. При наличии кислорода сероводород окисляется. Углекислый газ или двуокись углерода CO2поступает из атмосферы, выделяется при дыхании растений и разложении органических веществ и поставляется при извержении вулканов и поствулканических процессах. Расходуется углекислый газ на фотосинтез растений и на образование морскими организмами скелетов и раковин. Углекислый газ растворяется в воде в значительно больших количествах, чем кислород и азот. Он находится в морской воде частью в растворенном, свободном состоянии, частью в химически связанной форме бикарбонатов Са(НСОз)2 или карбонатов (СаСОз). Растворимость CO2 в морской воде возрастает с понижением температуры. Поэтому холодные воды Арктики и вообще высоких широт содержат больше углекислого газа, чем воды низких широт. Значительное содержание CO2 отмечается в придонных холодных водах на глубинах ниже 4000-5000 м, что сказывается на растворении известковых раковин. Если бы вода была нейтральной, то насыщающее количество углекислого газа вследствие малости парциального давления составляло лишь 0.5 мл·л-1, в то время как насыщающее количество азота достигает 19.0 мл·л-1, а кислорода 10.5 мл·л-1. Однако морская вода имеет слабо щелочную реакцию и углекислый газ ведет себя в ней совершенно иначе, чем кислород и азот. Часть углекислого газа по мере растворения вступает в соединение с основаниями. В раствор переходят новые количества углекислого газа, и в результате общее его содержание может достигать 50 мл·л-1. Углекислый газ, соединяясь с водой, образует угольную кислоту СО2 + Н2О ↔ Н2СО3, которая затем дважды диссоциирует, выделяя сначала бикарбонатный ион HCO3 Н2СО3 а затем карбонатный CO3 HCO3 Между углекислым газом атмосферы и океана устанавливается, таким образом, подвижное равновесие. Щелочной резерв. Активная реакция морской воды. Морская вода обладает свойствами щелочи. Щелочность морской воды определяется щелочным резервом - количеством кислоты, которое надо прибавить к определенному объему воды, чтобы в ней не оставалось карбонатных и бикарбонатных ионов и недиссоциированных молекул угольной кислоты. Первая и вторая диссоциации угольной кислоты приводят к образованию водородных ионов. Их концентрация определяет так называемую активную реакцию морской воды рН. Она характеризует равновесие между угольной кислотой и карбонатами и бикарбонатами. Бикарбонаты и карбонаты делают морскую воду щелочной, угольная кислота, наоборот, делает ее кислой. Поэтому активная реакция (концентрация водородных ионов) определяет степень диссоциации угольной кислоты, соответствующую равновесию с карбонатными и бикарбонатными ионами. Диссоциация угольной кислоты на водородный и бикарбонатный ионы, а последнего на карбонатный и водородный сопровождается увеличением содержания в морской воде водородных ионов. В 1 л нормальной воды содержится 1·10-7 водородных ионов. Эту концентрацию ионов обычно обозначают десятичным логарифмом с обратным знаком, т. е. pH = - lg [Н+]. Если рН=7 вода является нейтральной; если рН >7 вода обладает щелочными свойствами, если рН <7 - кислотными. Наибольших значений (8,0-8,35) рН достигает в поверхностном слое океана благодаря интенсивному потреблению CO2 при фотосинтезе. С увеличением глубины рН уменьшается, что связано с увеличением концентрации CO2 . Биогенные элементы (С, Н, N, P, Si, Fe, Mn) и их соединения имеют особое значение для развития жизни в океане. Соединения фосфора, азота и кремния в океане это то же самое, что и азотные и фосфатные удобрения, необходимые для ростасельскохозяйственных культур на суше. Концентрация биогенных элементов зависит от соотношения интенсивности их потребления и производства. Соединения фосфора (фосфаты) относятся к физиологически важным компонентам химического состава морских вод, определяющим их продуктивность. Существует много форм фосфорных соединений в морской воде: детергенты, пестициды, эфиры фосфорной кислоты, полифосфаты, многочисленные органические производные. Их чрезмерная концентрация в ряде районов океана, главным образом, за счет коммунально-бытовых и сельскохозяйственных стоков, вызывает бурный рост морских растений, разложение остатков которых приводит к повышенному потреблению кислорода. Поэтому в таких случаях соединения фосфора рассматривают как загрязняющие вещества. Растворенные в морской воде соли кремниевой кислоты используются многими водорослями, в частности, диатомовыми для построения клетки. У некоторых планктонных водорослей до трех четвертей общего количества минеральных веществ приходится на кремний. Данные о содержании и распределении кремния в морской воде позволяют судить о границах и перемещениях различных водных масс и особенно вод, обогащенных речным стоком, так как в речных водах концентрация кремния выше, чем в морских. Изменения в содержании кремния позволяют судить об изменениях в режиме вод некоторых районов морей и океанов. Азот в морской воде входит в состав как неорганических соединений (нитриты, нитраты, соли аммония), так и органических (гуминовые вещества, белки, аминокислоты). Эти соединения относятся к числу важнейших биогенных веществ, в значительной степени определяющих биологическую продуктивность морей и океанов. Изменения в составе форм азота указывают на направление основных биохимических и гидробиологических процессов в морской среде. Нитриты образуются в море в результате окисления солей аммония и поэтому находятся в местах значительного скопления органического вещества отмерших организмов. Концентрация их в морской воде невелика и обычно составляет доли или единицы мкг/л и лишь в редких случаях превышает 15-20 мкг/л. В районах интенсивного перемешивания вод они, как правило отсутствуют. Нитраты, как и фосфаты, являются необходимым для морского фитопланктона биогенным соединением. Их отсутствие приводит к угнетению водорослей, снижению интенсивности процесса фотосинтеза. Содержание нитратов в водах Мирового океана колеблется в широких пределах - от нуля до 500-600 мкг/л и выше. Воды, богатые нитратами, например антарктические, отличаются высокой продуктивностью. Аммонийный азот появляется в морской воде и как первичный продукт обмена веществ, и как результат полной минерализации органических остатков. Аммонийный азот потребляется фитопланктоном в процессе фотосинтеза, при этом водоросли затрачивают меньшую энергию по сравнению с ассимиляцией нитратов. Следовательно, знание концентрации аммонийного азота необходимо для оценки биологической продуктивности моря и интенсивности минерализации органических веществ. Содержание аммонийного азота в морской воде может изменяться в очень широких пределах: от нескольких мкг/л в открытом океане до нескольких тысяч мкг/л в прибрежных районах и внутренних морях. Биогенные вещества совершают непрерывный круговорот. Они потребляются водными растениями, в основном фитопланктономпри фотосинтезе в верхнем, освещенном слое океана. Регенерация биогенных веществ происходит либо в процессе прямой регенерации, и в этом случае возврат биогенных веществ происходит непосредственно в поверхностной продуктивной зоне океана, либо в процессе непрямой регенерации (разложение отмерших организмов), и в этом процессе накопление биогенных веществ происходит в глубинных слоях. Вынос их в продуктивную зону осуществляется турбулентным перемешиванием и вертикальной циркуляцией, особенно в областях подъема вод (зонах апвеллинга).Именно благодаря постоянно наблюдающемуся подъему глубинных вод, обогащающему зону фотосинтеза биогенными веществами, формируются известные промысловые районы у северо-западной и юго-западной Африки, в Калифорнийском течении, у побережья Перу. Микроэлементы в водахокеана представлены почти все. Суммарная концентрация микроэлементов меньше 0.01% суммы главных ионов. В наибольших концентрациях находятся серебро 3·10–3 %, литий 1,5·10–5 %, иод 6·10–6 %, цинк 1·10–6 %, железо 1·10–6 %. В наименьших количествах содержится золото 4·10–10 % и кадмий 1·10–8 %. Некоторые организмы способны концентрировать в себе микроэлементы. Например, моллюски, фильтруя водув процессе дыхания и питания, концентрируют ванадий, медь, цинк, кобальт, свинец. Органическое вещество в океане непрерывно появляется в виде первичной продукции - зеленой массы растений (в основном фитопланктона). Одновременно происходит потребление органического вещества, его отмирание и разложение. Остатки отмерших организмов находятся в водеокеана в виде взвеси. Биохимический распад этих остатков организмов, главным образом планктонных, является источником растворенных органических веществ, находящихся в виде молекулярных и коллоидных соединений. В составе растворенных органических веществ содержатся важнейшие соединения - пектиновые, гумусовые, белковые вещества (аминокислоты), углеводы, ферменты, антибиотики и витамины. Интенсивная хозяйственная деятельность человека привела к нарушению природных процессов не только в пресных водоемах, но и во многих прибрежных областях морей и океанов. В результате работы промышленных предприятий и транспорта в природных водах накапливаются загрязнители и, прежде всего, тяжелые металлы. Наиболее опасными признаны ртуть, свинец и кадмий, так как они ядовиты даже в малых количествах (табл. 5). Таблица 5 Наиболее опасные тяжелые металлы
Среди других загрязняющих веществ наиболее опасны нефть и нефтепродукты, попадающие в морскую воду при эксплуатации нефтяных танкеров. Во время разливов нефти особенно страдают птицы. Немалый вред природе наносят органические соединения, содержащиеся в отходах предприятий и в бытовых сточных водах. Попадание этих веществ в морскую воду приводит к уменьшению содержания растворенного кислорода, который расходуется на их окисление. В результате гибнут рыбы и другие обитатели моря. Рост населения, промышленности и сельского хозяйства тесно связаны с водными ресурсам, однако прирост ресурсов рождает новые потребности и новые проблемы, в том числе экологические. Настало время защищать моря и океаны и их обитателей от вмешательства человека. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
