Физика. физика29.06. Министерство образования Тульской области государственное профессиональное образовательное учреждение
 Скачать 237.64 Kb. Скачать 237.64 Kb.
|
|
Министерство образования Тульской области государственное профессиональное образовательное учреждение Тульской области «Тульский сельскохозяйственный колледж имени И.С. Ефанова» ИНДИВИДУАЛЬНЫЙ ПРОЕКТ Модели атома. Опыт Резерфорда.
Тула 2021 г. СодержаниеПаспорт проекта 3 Введение 4 Модели атомов Томпсона и Резерфорда 5 Планетарная модель 6 Резерфорд Эрнест 7 Опыты Резерфорда 8 Выводы из опытов 9 Недостатки модели атома Резерфорда 10 Заключение 11 Список литературы 12 Паспорт проекта
ВведениеК 1904 году японский физик Нагаока Хантаро разработал раннюю, как оказалось впоследствии, ошибочную «планетарную модель» атома («атом типа Сатурна»). Модель была построена на аналогии с расчётами устойчивости колец Сатурна (кольца уравновешены из-за очень большой массы планеты). Модель Нагаоки была неверна, но два следствия из неё оказались пророческими: ядро атома действительно очень массивно; электроны удерживаются на орбите благодаря электростатическим силам (подобно тому, как кольца Сатурна удерживаются гравитационными силами). Новую модель строения атома Резерфорд предложил в 1911 году на основе анализа экспериментов по рассеиванию альфа-частиц в золотой фольге, проведённых в 1909 г. под его руководством. При этом рассеянии большое, неожиданно статистически необъяснимое, количество альфа-частиц рассеивалось на большие углы, что свидетельствовало о том, что центр рассеяния имеет небольшие размеры, в нём сосредоточен значительный электрический заряд и масса атома. Модели атомов Томпсона и РезерфордаРезультат Резерфорда противоречил модели Томпсона, так как положительный заряд не был распределен по всему объему атома. Согласно модели Томпсона, заряд не имеет возможности создавать сильное электрическое поле, которое впоследствии отбросит αα-частицы. Такое поле однородно заряженного шара максимально на его поверхности и убывает до нуля к центру. Если размеры αα-частиц достаточно большие, тогда рассеивание может достичь угла в 180180 градусов. Далее возникла ядерная модель атома: Вещество, входящее в состав атома, предполагало наличие плотности p≈1015 г/см3p≈1015 г/см3, а заряд ядра равнялся суммарному заряду электронов. Было установлено, что при взятии за 1 значение заряда электрона, заряд ядра равнялся числу из таблицы Менделеева. Расчёты Резерфорда показали, что рассеивающий центр, заряженный положительно или отрицательно, должен быть по крайней мере в 3000 раз меньше размера атома, который в то время уже был известен и оценивался как примерно 10−10 м. Поскольку в то время электроны уже были известны, а их масса и заряд определены, то рассеивающий центр, который позже назвали ядром, должен был иметь противоположный электронам заряд. Резерфорд не связал величину заряда с атомным номером. Этот вывод был сделан позже. А сам Резерфорд предположил, что заряд ядра пропорционален атомной массе. Связь электрического заряда ядра с атомным номером химического элемента установил Генри Мозли в экспериментах, выполненных в 1913 г. Недостатком планетарной модели была невозможность объяснения ею устойчивости атомов. Так как электроны движутся вокруг ядра, испытывая при этом центростремительное ускорение как планеты вокруг Солнца, то они по законам классической электродинамики должны излучать электромагнитные волны, теряя при этом на излучение кинетическую энергию орбитального движения и в результате «упасть» на ядро. Расчёты, выполненные с помощью методов классической электродинамики показывают, что электроны должны «упасть» на ядро за время порядка 10−11 с. Это противоречие было снято последующим развитием планетарной модели в модели атома Бора, постулирующая другие, отличные от классических законы орбитального движения электронов на основе волн де Бройля. Полностью противоречащие эксперименту выводы классической электродинамики смогло объяснить развитие квантовой механики. Планетарная модельВ целом атом нейтрален, в центре атома расположено положительно заряженное ядро, в котором сосредоточена почти вся масса атома. Число внутриатомных электронов, как и заряд ядра, равны порядковому номеру элемента в периодической системе Д. И. Менделеева. Электроны движутся вокруг ядра, подобно тому как планеты обращаются вокруг Солнца Такой характер движения электронов определяется действием кулоновских сил притяжения со стороны ядра. Закон Кулона: qα — заряд α-частицы; q — положительный заряд атома; r — его радиус; 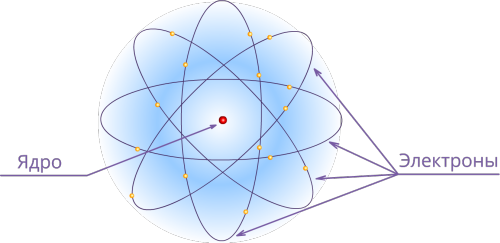 Резерфорд ЭрнестРезерфорд Эрнест Резерфорд Эрнест (1871–1937) – английский физик, основоположник ядерной физики. Его исследования посвящены атомной и ядерной физике, радиоактивности. Своими фундаментальными открытиями в этих областях заложил основы современного учения о радиоактивности и теории строения атома. В 1899 г. открыл альфа - и бета-лучи. Вместе с Ф. Содди в 1903 г. разработал теорию радиоактивного распада и установил закон радиоактивных превращений. В 1903 г. доказал, что альфа-лучи состоят из положительно заряженных частиц. Предсказал существование трансурановых элементов. В 1908 г. ему была присуждена Нобелевская премия.  Опыты РезерфордаИдея опыта Резерфорда: Зондировать атом альфа–частицами. Альфа-частицы возникают при распаде радия. Масса альфа-частицы в 8000 раз больше массы электрона. Электрический заряд альфа-частицы в 2 раза больше заряда электрона. Скорость альфа-частицы 1/15 скорости света. Альфа-частица является ядром атома гелия. Рассеяние (изменение направления движения) альфа -частиц может вызвать только положительно заряженная часть атома. Таким образом, по рассеянию альфа -частиц можно определить характер распределения положительного заряда и массы внутри атома. Модифицируя экспериментальную установку, Резерфорд попытался обнаружить отклонение альфа -частиц на большие углы. Для этого он окружил фольгу сцинтилляциоными экранами и определил число вспышек на каждом экране. Опыты показали: Подавляющая часть альфа-частиц проходит сквозь фольгу практически без отклонения или с отклонением на малые углы; Некоторая небольшая часть альфа-частиц при прохождении через фольгу отклоняется на значительные углы ( 90,120,150 градусов); Некоторые α-частицы отклонялись на большие углы, до 180º. Резерфорд понял, что такое отклонение возможно лишь при встрече с положительно заряженной частицей большой массы. На основе модели Томсона при распределении по всему атому положительный заряд не может создать достаточно сильное электрическое поле, способное отбросить альфа-частицу назад. Резерфорд понял, что такое отклонение возможно лишь при встрече с положительно заряженной частицей большой массы. Малая вероятность отклонения на большие углы говорила о том, что эта положительная частица имеет малые размеры, порядка 10–14 м. Выводы из опытовПоложительный заряд сосредоточен в малой части атома – ядре. Практически вся масса атома сосредоточена в этом ядре. Отклонения альфа-частиц на большие углы происходят в результате столкновения альфа – частиц с ядром одного из атомов. 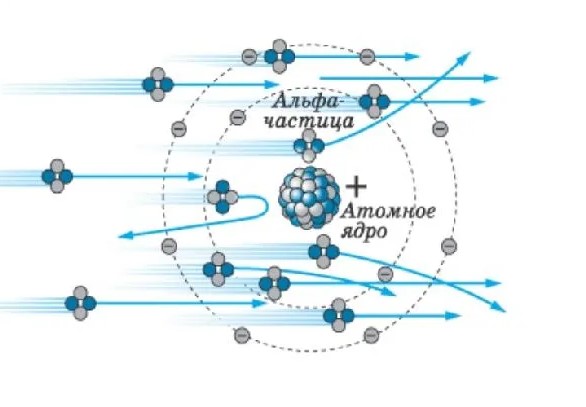 Недостатки модели атома РезерфордаЭта модель не согласуется с наблюдаемой стабильностью атомов. По законам классической электродинамики вращающийся вокруг ядра электрон должен непрерывно излучать электромагнитные волны, а поэтому терять свою энергию. В результате электроны будут приближаться к ядру и в конце концов упадут на него. Эта модель не объясняет наблюдаемые на опыте оптические спектры атомов. Оптические спектры атомов не непрерывны, как это следует из теории Резерфорда, а состоят из узких спектральных линий, т.е. атомы излучают и поглощают электромагнитные волны лишь определенных частот, характерных для данного химического элемента. ЗаключениеВ ХХ веке некоторые положения теории Н. Бора были дополнены и переосмыслены. Наиболее значительным изменением стало введение понятия об электронном облаке, которое сменило понятие об электроне только как частице. Позже теорию Бора сменила квантовая теория Альберта Эйнштейна, которая учитывает волновые свойства электрона и других элементарных частиц, образующих атом. Основой современной теории строения атома является планетарная модель, дополненная и усовершенствованная. Согласно данной теории, ядро атома состоит из протонов (положительно заряженных частиц) и нейронов (не имеющих заряда частиц). А вокруг ядра по неопределённым траекториям движутся электроны (отрицательно заряженные частицы). В ходе данного исследования был отражен процесс эволюции представлений о строении атомов на примере моделей Эрнеста Резерфорда и Нильса Бора. Полностью изучены, проанализированы и обобщены представления о строении атомов, высказанные Резерфордом и Бором. С точки зрения современной физики, наиболее верное предположение о строении атома было сделано датским ученым - Нильсом Бором. Список литературыБухгольц Н. Н. Основной курс теоретической механики (часть первая). – М.: Наука, 1972. Дягилев Ф. М. Из истории физики и жизни ее творцов. – М.: Просвещение, 1986. Корн Г. и Корн Т. Справочник по математике. – М.: Наука, 1968. Костко О. К. Универсальный справочник по физике школьникам и абитуриентам. – М.: Лист Нью, 2002. Купер Л. Физика для всех (том 1). – М.: Мир, 1973. |
