Методы выделения драгоценных металлов из сплавов. аналит реферат. Минобрнауки россии ргу нефти и газа (ниу) имени И. М. Губкина
 Скачать 0.93 Mb. Скачать 0.93 Mb.
|
|
МИНОБРНАУКИ РОССИИ РГУ нефти и газа (НИУ) имени И.М. Губкина
РЕФЕРАТ
СодержаниеВведение 3 Драгоценные металлы 4 Приемная плавка 5 Хлорный процесс 5 Электролитическое рафинирование серебра 7 Электролитическое рафинирование золота 9 Аффинаж металлов платиновой группы 12 Заключение 14 Библиографический список 16 ВведениеДрагоценные металлы – химическим элементы, обладающие уникальными химическими и физическими свойствами, которые отличают их от других металлов. Они обладают термостойкостью и пластичностью, тепло- и электропроводностью, устойчивостью к коррозионным и окислительным процессам, магнитными характеристиками. Присущие чистым металлам свойства относятся также и к сплавам на их основе, к порошкам, покрытиям. Поскольку области применения драгоценных металлов крайне разнообразны, потребности промышленности в них огромны, но содержание драгоценных металлов в земной коре составляет 10-5–10-11%, причем они не образуют месторождений, перспективных для промышленной разработки, поскольку залегают в форме россыпей, сопровождающих руды других металлов. В связи с этим драгоценные металлы необходимо как можно более полно выделять из содержащего их сырья, поэтому существует немало способов выделения их не только из концентратов и руд, но и из вторичного сырья – электронного лома, шлама, отходов фотопромышленности, радиодеталей. Актуальность темы заключается в том, что благодаря своим уникальным свойствам драгоценные металлы находят применение и ценятся в разных отраслях: в химии, анализе, катализе, биологии, медицине; особенное значение они имеют для электроники, радио- и электротехники, химической и нефтеперерабатывающей отраслей, приборостроения, атомной и ракетной техники. Кроме того, без них не представлялась бы возможной работа вычислительных, измерительных, контролирующих приборов и устройств. Цель работы заключается в изучении способов выделения драгоценных металлов из плавов, их различия, преимущества и недостатки. Задачи работы заключаются в рассмотрении процесса выделения драгоценных металлов из сплавов от поступления их на завод до выделения чистого металла и доведения его до высокой чистоты, особенности выделения разных видов драгоценных металлов, аппараты и реактивы, необходимые для проведения каждого процесса. Драгоценные металлыДрагоценный металл — цветной металл, обладающий высокой химической стойкостью в агрессивных средах, тугоплавкостью, ковкостью, тягучестью. К драгоценным металлам относятся золото, серебро, платина и металлы платиновой группы — палладий, иридий, родий, рутений и осмий. Металл платиновой группы — драгоценный металл, сопутствующий платине в рудах и имеющий схожие свойства с ней и другими металлами этой группы. К металлам платиновой группы относятся палладий и редкие металлы платиновой группы, являющиеся спутниками платины. Редкий металл платиновой группы — металл платиновой группы, содержание которого в руде ниже, чем содержание в ней платины и палладия. К редким металлам платиновой группы относятся иридий, родий, рутений и осмий [5]. Золото используется для изготовления стоматологических протезов, в качестве припоя или сварочного материала при изготовлении термопар, как гальваническое покрытие плат, контактов, разъемов. Серебро применяется в контактах электротехнических изделий, используется в фотографии, при изготовлении аккумуляторных батарей высокой энергоплотности. Из платины изготавливают термостойкую химическую посуду, гальванотехнику, нагревательные элементы, термометры сопротивления, контакты реле. Родий применяется при изготовлении термопар и детекторов нейтронов для ядерной техники, в фильерах для стеклонитей и термопарах. Палладий, осмий, иридий и рутений применяются при изготовлении измерительных датчиков, для нанесения специальных покрытий в изделиях оборонной и космической промышленности, в телекоммуникационных системах, при изготовлении технологического оборудования, эксплуатируемого в агрессивных средах [3]. Приемная плавкаПоступающее на завод сырье для усреднения свойств и отбора проб подвергают приемной плавке. Ее ведут в графитовых тиглях в электрических индукционных печах при температуре 1150–1200°С. Для сведения к минимуму потерь драгоценных металлов за счет улетучивания плавку ведут под слоем флюса – соды и буры, и избегают излишнего перегрева металла [2]. В зависимости от применяемого метода аффинажа расплавленный металл разливают в слитки, идущие на аффинаж хлорированием, или в аноды, поступающие на электролитическое рафинирование. Пробу металла отбирают непосредственно из печи, где расплав перемешивается токами высокой частоты, и отливают в изложницу в тонкие слитки, которые быстро охлаждают для придания сплаву однородности. Хлорный процессСущность метода заключается в продувании хлора через расплав чернового золота, а процесс основан на том, что хлор в первую очередь взаимодействует с недрагоценными металлами и серебром. Черновой металл, прошедший приемную плавку, в виде слитков загружают в тигельную печь. В тигель загружают смесь буры, кварца и хлористого натрия для образования шлака, уменьшающего улетучивание металла и предохраняющего стенки тигля от разъедания. После расплавления металла через крышку тигля в расплав вводят фарфоровую трубку, по которой подают газообразный хлор. Процесс ведут при температуре 1150 °С. Первыми хлорируются железо и цинк, низкокипящие хлориды которых переходят в газовую фазу, вызывая бурление расплава. Затем хлор реагирует с медью и серебром, образуя хлориды, температуры кипения которых выше температуры ведения процесса, поэтому на поверхности расплава образуется слой расплавленных хлоридов, которые удаляют из тигля [7, с. 102]. Конец процесса определяют по появлению над расплавом красного ввиду присутствия хлорида золота дыма. По окончании хлорирования с поверхности металла удаляют остатки хлоридов и шлака, очищенное золото разливают в слитки. Смесь хлоридов и шлака содержит корольки золота, поэтому ее плавят в тиглях при температуре 1100°С, в результате чего расплав расслаивается на шлак (сверху) и слой хлоридов (снизу) [7, с. 110]. На поверхность расплава небольшими порциями загружают соду, при этом часть серебра восстанавливается и, опускаясь в виде мелких капель на дно тигля, увлекает большую часть золота, находящегося в хлоридах. Процесс хлорирования проще и дешевле электрохимического и пригоден для рафинирования золота любой чистоты, но дает недостаточно чистый металл. К недостаткам хлорного метода аффинажа следует также отнести существенные потери серебра и платиновых металлов, которые остаются в очищенном золоте. 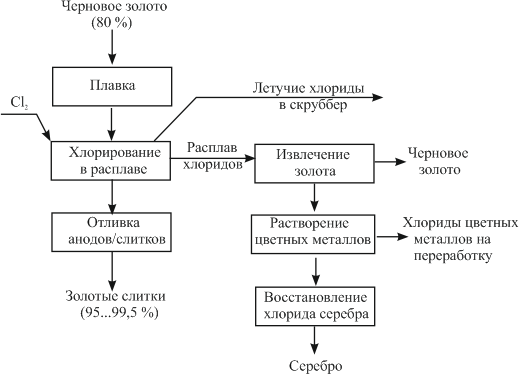 Рисунок 1 – Принципиальная схема хлорного процесса. Наиболее совершенным и эффективным методом аффинажа золота и серебра является электрохимическое рафинирование, позволяющее получать металлы высокой чистоты. Электролитическое рафинирование серебраПри электролитическом рафинировании серебра в качестве растворимого анода используют серебряный сплав. Электролитом является водный раствор азотнокислого серебра с добавкой небольшого количества азотной кислоты. Катодную основу делают из листового серебра, алюминия или титана. Серебро — один из наиболее электроположительных металлов (стандартный электродный потенциал φ0 Ag/Ag+ составляет +0,799 В). Примеси с более электроположительным потенциалом (золото, платина, палладий) выпадают в шлам. Примеси с потенциалом более электроотрицательным, чем потенциал серебра (медь, свинец, висмут, цинк и т. д.), переходят в раствор. Основной процесс на катоде — восстановление ионов серебра по схеме: Ag⁺ + e → Ag. В состав электролита, применяемого при электролитическом рафинировании серебра, входит свободная азотная кислота, увеличивающая электропроводность электролита и уменьшающая расход электроэнергии. Однако концентрация ее не должна превышать 10–20 г/л, в противном случае ускоряется процесс растворения катодного серебра и восстановления анионов NO3⁻, что ведет к уменьшению катодного выхода по току, повышению расхода кислоты, загрязнению атмосферы цеха выделяющимися оксидами азота. Примеси оказывают прямое влияние на процесс электролиза и на выход серебра по току, поэтому необходимо контролировать их содержание. В анодах в качестве примесей содержатся золото, металлы платиновой группы, медь, свинец, висмут, цинк, железо и т. д. Так, например, при содержании в анодном металле более 20% золота оно пассивирует анод и вызывает побочные реакции на электродах. Нормальный потенциал палладия (φ0 Рd/Рd²⁺ = +0,987 В) близок к потенциалу серебра, поэтому он соосаждается на катоде вместе с серебром, во избежание чего электролиз ведут при пониженной плотности тока (300–400 А/м2) с содержанием палладия в растворе в пределах 0,1–0,2 г/л. Медь (φ0 Cu/Cu²⁺ = +0,337 В) растворяется на аноде, ее ионы накапливаются в прикатодном пространстве и соосождаются с серебром при концентрации выше 100 г/л. При содержании теллура в анодном металле свыше 0,2% выделяются оксиды азота и образуются серые губчатые осадки, поэтому его следует как можно полнее удалять в предшествующих операциях [1, с. 315]. Электролиз серебра ведут в прямоугольных ваннах вместимостью до 600 л, изготовленных из винипласта, поливинилхлорида или фарфора и заключенных в каркас из стали, фибергласа и др. (рис. 2) [1, с. 320]. 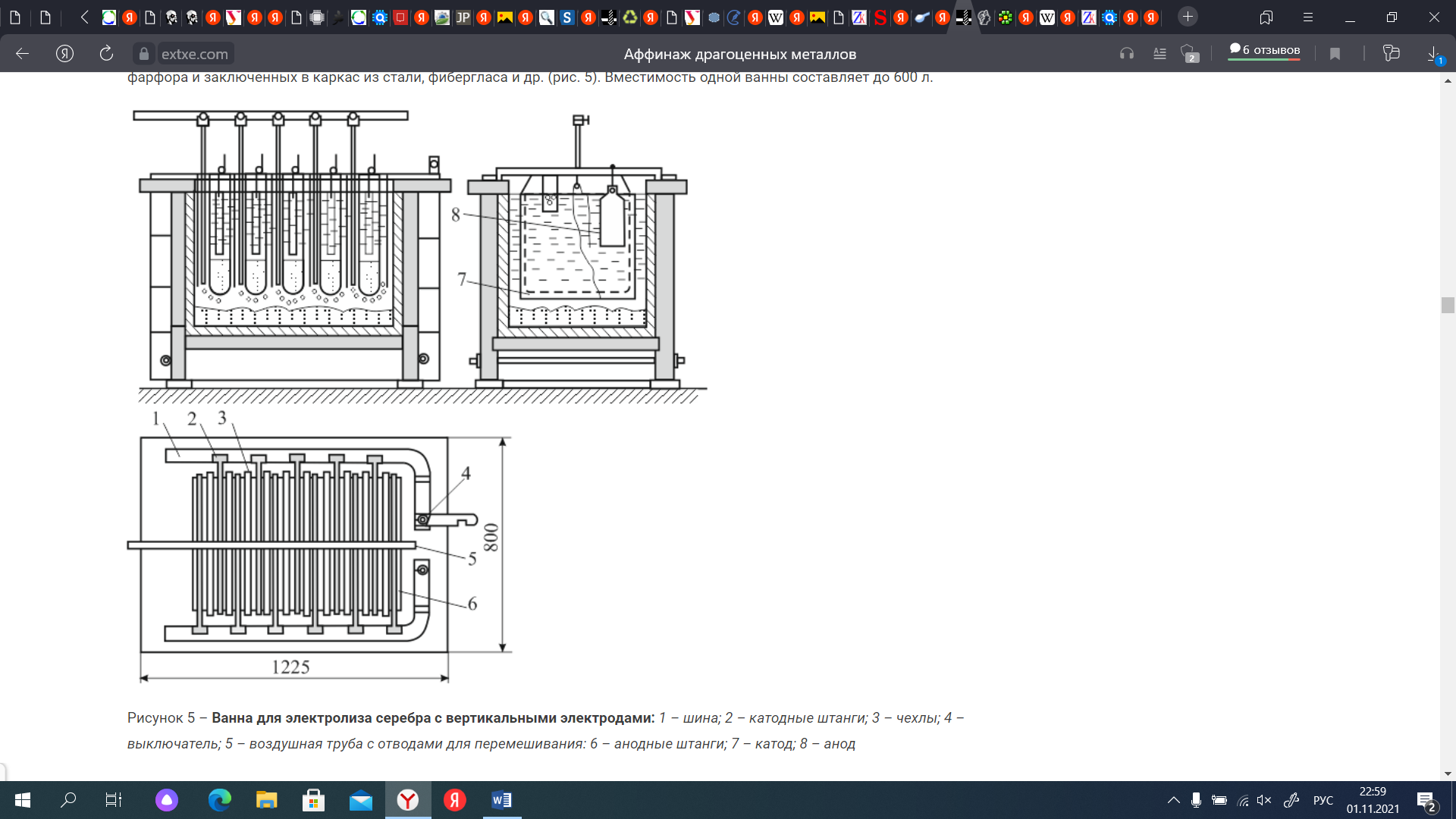 Рисунок 2 – Ванна для электролиза серебра с вертикальными электродами: 1 – шина; 2 – катодные штанги; 3 – чехлы; 4 – выключатель; 5 – воздушная труба с отводами для перемешивания: 6 – анодные штанги; 7 – катод; 8 – анод. Серебро осаждается на катоде в виде крупнокристаллического осадка, который периодически счищают лопатками или механическими скребками. Упавшие на дно ванны кристаллы серебра периодически извлекают совками из алюминия. Электролиз ведут при плотностях тока 200–600 А/м2, температура электролита составляет 30–50 °С. Катодный выход по току составляет 94–96 %, напряжение на ванне 1,0–2,5 В. Расход электроэнергии колеблется в пределах 0,3–0,6 кВт·час на 1 кг аффинированного серебра [2]. По окончании процесса серебро выгружают из ванн, промывают разбавленной азотной кислотой, горячей водой, сушат и плавят в электрических печах в слитки. К продуктам электролиза относятся также анодные остатки и отработанный электролит. Анодные остатки возвращают в плавку на аноды. Оставшееся в отработанном электролите серебро осаждают хлоридом натрия, затем хлористое серебро восстанавливают до чистого металла цинковой пылью. Электролитическое рафинирование золотаДля аффинажа золота электролизом аноды отливают из рафинируемого сплава, содержащего в качестве примесей серебро, платиновые металлы и некоторые недрагоценные металлы. Электролитом служит водный раствор золотохлористоводородной кислоты, диссоциирующей на катионы водорода и анионы тетрахлорида золота AuCl4⁻, с содержанием соляной кислоты [1, с.328]. Основной катодный процесс – восстановление анионов золота до металла: AuCl4⁻ + 3e  Au + 4Cl⁻. Au + 4Cl⁻.На аноде происходит растворение рафинируемого сплава с переходом золота в раствор: Au + 4Cl⁻ - 3e 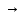 AuCl4⁻. AuCl4⁻.К особенностям аффинажа золота относится склонность анодного золота к пассивированию, приводящему к выделению газообразного хлора, прекращению растворения анода и обеднению электролита золотом. Другой особенностью процесса является переход золота в раствор в форме двух анионов: AuCl4⁻ и AuCl2⁻. Концентрация обеих форм анионов соизмеримы, поэтому на катоде начинается процесс восстановления AuCl2⁻, и часть золота в виде тонкого порошка выпадает в анодный шлам, извлечение металла из которого требует дополнительных операций. Третьей особенностью электрохимического рафинирования золота является его проведение при переменном асимметричном токе во избежание окисления на аноде серебра, образующего нерастворимый хлорид серебра, который, покрывая анод, способствует прекращению растворения золота и выделению газообразного хлора. Кроме серебра в золотых анодах присутствуют медь, висмут, железо, сурьма, платина и палладий. При содержании меди выше 90 г/л она разряжается совместно с золотом. При концентрации висмута выше 0,3% анод пассивируется пленкой, образованной его солями. Вредной примесью является железо, поскольку, переходя в раствор в виде ионов Fе+2, оно восстанавливает из электролита золото и повышает его содержание в шламе. Поскольку стандартные потенциалы платины и палладия близки к стандартному потенциалу золота, они соождаются с золотом на катоде, поэтому необходимо поддерживать содержание платины в электролите до 50 г/л, палладия – 15 г/л. Электролиз золота ведут в ваннах из фарфора или винипласта вместимостью 20–65 л. В качестве катодов используют золотую жесть толщиной 0,1–0,25 мм, изготовляемую прокаткой чистого электролитного золота. В ванны (рис.3) подвешивают 18 катодов на шести штангах (по три катода в ряд) и 15 анодов на пяти штангах (по три анода в ряд) [2].  Рисунок 3 – Ванна для электролиза золота: 1 – фарфоровый корпус; 2 – аноды; 3 – штанга для подвески анодов; 4 – водяная баня Ванна устанавливается в водяной бане для поддержания необходимой температуры электролита. Электролит перемешивается сжатым воздухом, подаваемым в ванну по стеклянным трубкам. Ввиду выделения в процессе хлора ванны помещают в специальном вытяжном шкафу. Электролит содержит 70–200 г/л Аu и 40–100 г/л HCl. Температура электролита 50–60°С. Электролиз ведут асимметрическим током плотностью 600–1500 А/м2. Под напряжением на ванне 0,5–1 вольт золото осаждается на катоде в виде плотного блестящего осадка. По окончании рафинирования катодное золото промывают горячей водой, обрабатывают соляной кислотой, сушат и плавят в индукционной печи в слитки. Чистота катодного золота, содержащего в качестве примесей серебро, медь и железо, составляет 99,98–99,99%. Содержащиеся в шламе крупные частицы золотого анодного скрапа и дендриты катодного золота сушат и плавят на аноды. Отработанный электролит перерабатывают в специальных ваннах, где электролизом с нерастворимыми анодами извлекают большую часть золота. 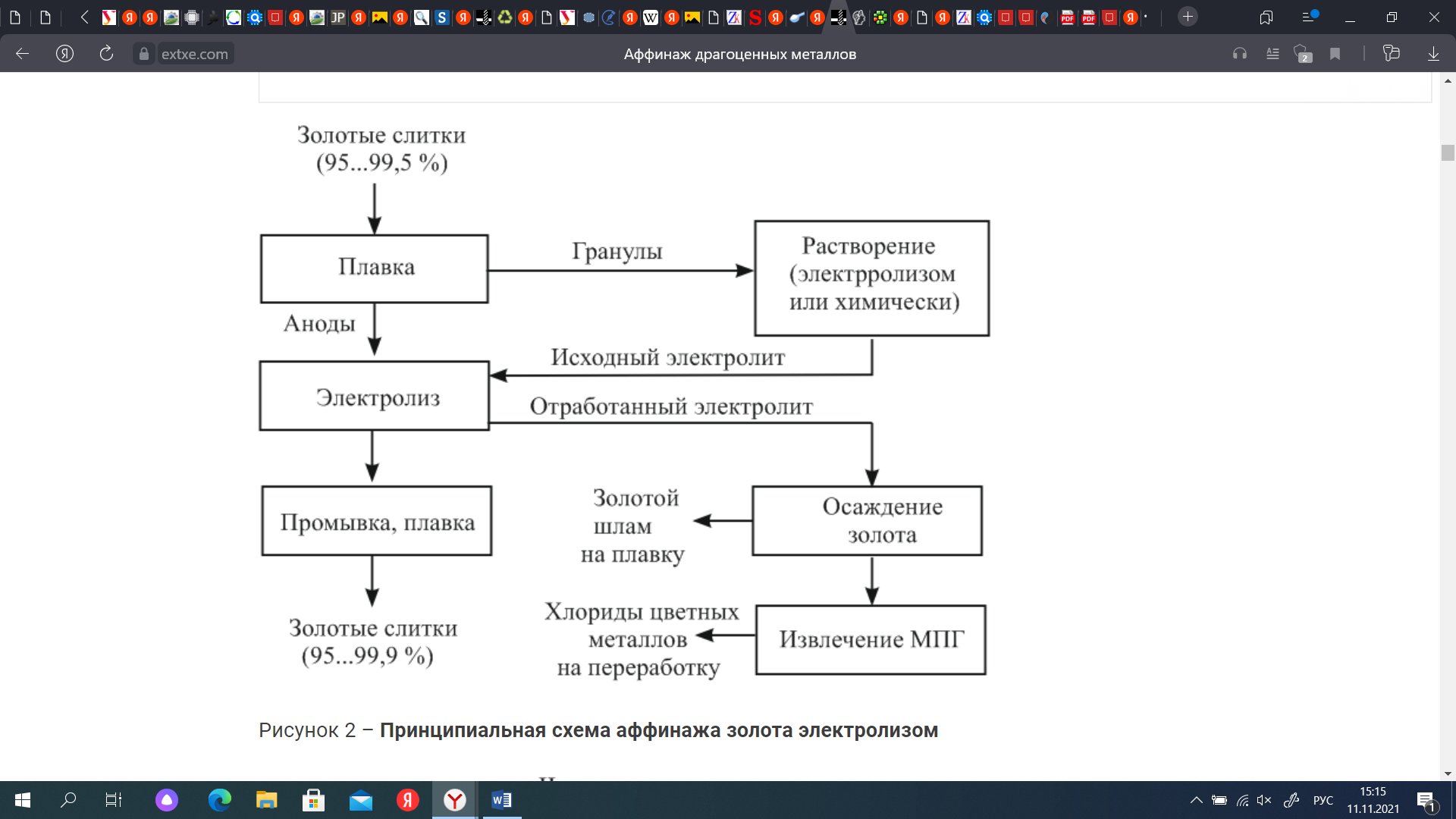 Рисунок 4 – Принципиальная схема аффинажа золота электролизом. Достоинством электролитического рафинирования золота является не только получение высокочистого металла, но и попутное извлечение металлов платиновой группы, теряемых при аффинаже хлорированием. Аффинаж металлов платиновой группыКонцентраты металлов платиновой группы, полученные из руд или в результате переработки анодных шламов, и шлиховую платину, извлекаемую при разработке и обогащении россыпей, передают на аффинажные заводы для получения металлов платиновой группы []. Также сырьем для получения платиновых металлов служит лом вторичных платиновых металлов. Шлиховая платина – это смесь зерен самородной платины, представляющая собой сплав платиновых металлов с железом, медью, никелем и другими элементами. Шлиховую платину вследствие высокого содержания в ней платины перерабатывают по простой схеме, основными операциями в которой являются растворение, доводка растворов и избирательное осаждение платиновых металлов. Первый этап переработки шлиховой платины – ее растворение в царской водке – смеси соляной и азотной кислот в объемном отношении 3:1. Процесс растворения длится сутки, причем через 5 часов после добавления шлихов в раствор начинается подогрев до 110–120 °С. 3Pt + 4HNO3 + 18 HCl = 3H2[PtCl6] + 4NO + 8H2O. Для избирательного осаждения платины, находящейся в нерастворимом хлорплатинате аммония, необходимо вначале перевести иридий и палладий (IV) в иридий и палладий (III), поскольку при осаждении платины хлористым аммонием они выпадут в осадок в виде труднорастворимых соединений (NH4)2[IrCl6] и (NH4)2[PdCl6], загрязняющих платиновый осадок [6, с. 87]. Раствор обрабатывают последовательно 5; 12,5 и 25% раствором хлористого аммония, платина выпадает в осадок в виде хлорплатината: H2[PtCl6] + 2NH4Cl = (NH4)2[PtCl6] + 2HCl. Полученный осадок отфильтровывают и промывают 5% раствором хлористого аммония, затем прокаливают в муфельных электропечах в течение 10–12 часов с постепенным повышением температуры до 1000 °С. При этом образуется губчатая платина, содержащая примеси других металлов. Для извлечения платины губку измельчают, растворяют в царской водке и осаждают в виде хлорплатината аммония [4, с.113]. Оставшийся раствор подкисляют серной кислотой и цементируют из него палладий, родий и рутений железом. Палладий выделяют из растворов действием аммиака, затем – соляной кислоты. Образовавшийся осадок – дихлордиамминпалладий – прокаливают в токе водорода с получением палладиевой губки: [Pd(NH3)2]Cl2 + H2 = Pd + 2NH3 + 2HCl. Родий можно выделить по способу В.В. Лебединского – нейтрализацией раствора щелочью и последующей обработкой азотнокислым натрием [6, с.117]: H3RhCl6 + 6NaNO2 = Na3Rh(NO2)6 + 3HCl + 3NaCl. Родий переходит в раствор, который подкисляют уксусной кислотой, обрабатывают хлористым аммонием, в результате чего он выделяется в виде кристаллического осадка – гексанитрородата (III) аммония: Na3Rh(NO2)6 + 3NH4Cl = (NH4)3Rh(NO2)6 + 3NaCl. Соль обрабатывают аммиаком и хлористым аммонием, после чего выпадает кристаллический осадок триамминнитрита родия, который при нагревании в атмосфере водорода при 900 °С превращается в губчатый родий. Осмий извлекается из нерастворимого остатка обработки сырья царской водкой, который спекают с BaO2, измельченный спек обрабатывают смесью соляной и азотной кислот. Тетраоксид осмия при этом перегоняется и улавливается из паров раствором едкого натра в виде осмиата натрия. Раствор обрабатывают затем хлористым аммонием, причем осмий выпадает в осадок в виде соли хлора, последний промывают, высушивают и прокаливают в атмосфере водорода, получая в итоге осмиевую губку: [OsO2(NH3)4]Cl2 + 3H2 = Os + 2H2O + 4NH3 + 2HCl. ЗаключениеШирокое распространение драгоценных металлов — от ювелирных изделий до электро- и гальванотехники — обусловлено их стойкостью к химическому и физическому воздействию, их прочностью, тугоплавкостью и электропроводностью. Именно поэтому в современном мире вместе с развитием отраслей, в которых находят применение драгоценные металлы, происходит повышению спроса на них в промышленности, поэтому большое внимание со стороны потребителей и производителей драгоценных металлов уделяется различным методам их получения. Ввиду того, что распространенность драгоценных металлов в природе невелика, а также из-за того, что выделение их из руд является трудоемким, ресурсо- и энергозатратным процессом, необходимо использовать методы их добычи и выделения из вторичного сырья, обеспечивающие наибольший выход и наименьшие потери целевого продукта. По этой причине каждый день происходит усовершенствование существующих и изобретение новых технологий по выделению драгоценных металлов из содержащего их сырья, отличающихся друг от друга чистотой целевого продукта, условиями, в которых его получают, химическими и физическими процессами, лежащими в их основе, реагентами и приборами, с помощью которых возможно провести процесс. Наиболее совершенным и качественным методом выделения драгоценных металлов из сплавов является электролитическое рафинирование: оно позволяет не только получить металл высокой чистоты, но и извлечь его из шлака и отработанного электролита. Металлы, переработанные по этому методу, не нуждаются в дополнительной очистке и удовлетворяют требованиям промышленности. Библиографический список1. Акулов А.И., Бельчук Г.А., Демянцевич В.И. Технология и оборудование сварки плавлением/ Акулов А.И., Бельчук Г.А., Демянцевич В.И. – Москва. Издательство «Машиностроение», 1977. 432 с. 2. Аффинаж драгоценных металлов. URL: https://extxe.com/11877/affinazh-dragocennyh-metallov/ (дата обращения: 13.11.2021 г.) 3. Благородные металлы: список, свойства и применение. URL: https://goserv.ru/metally/blagorodnye.html (дата обращения: 14.11.2021 г.) 4. Борбат В.Ф., Шиндлер А.А. Химия и химическая технология металлов платиновой группы. – Омск: Омский государственный университет, 2008. 176 с. 5. ГОСТ Р 52793-2007 Металлы драгоценные. Термины и определения от 24 декабря 2007. URL: https://docs.cntd.ru/document/1200060400 (дата обращения: 13.11.2021 г.) 6. Звягинцев О.Е. Аффинаж золота, серебра и металлов платиновой группы/ Звягинцев О.Е. – Москва. Государственное научно-техническое издательство литературы по черной и цветной металлургии, 1945. 244 с. 7. Чижиков Д.М. Хлорный метод переработки полиметаллических руд и концентратов/ Чижиков Д.М. – Москва; Ленинград: Онти, 1936. 224 с. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||