рома. Миоциты, или мышечные клетки особый тип клеток, составляющий основную часть мышечной ткани
 Скачать 332.16 Kb. Скачать 332.16 Kb.
|
|
Миоциты, или мышечные клетки — особый тип клеток, составляющий основную часть мышечной ткани. Миоциты представляют собой длинные, вытянутые клетки, развивающиеся из клеток предшественников — миобластов. Существует несколько типов миоцитов: миоциты сердечной мышцы (кардиомиоциты), скелетной и гладкой мускулатуры, миоциты радужки. Каждый из этих типов обладает особыми свойствами. Так, кардиомиоциты, помимо прочего, генерируют электрические импульсы, задающие сердечный ритм Миосимпласт (характерен для скелетных мышц) состоит из 3 компонентов: ядра (точнее множества ядер), цитоплазмы (саркоплазма) и плазмолеммы (которая покрыта базальной мембраной и называется сарколемма). Почти весь объем цитоплазмы заполнен миофибриллами — органеллами специального назначения; органеллы общего назначения — эндоплазматическая сеть, митохондрии, комплекс Гольджи, лизосомы, а также ядра смещены на периферию волокна. Строение мышечного волокна Мышечное волокно состоит из клеток, окруженных электровозбудимой мембраной — сарколеммой, которая, как и любая другая мембрана, имеет липопротеиновую природу (толщина бимолекулярного слоя около 10 нм). Сарколемма отгораживает внутреннее содержимое мышечного волокна от межклеточной жидкости. Подобно другим мембранам сарколемма имеет избирательную проницаемость для различных веществ. Через нее не проходят высокомолекулярные вещества (белки, полисахариды и др.), но проходят глюкоза, молочная и пировиноградная кислоты, кетоновые тела, аминокислоты и короткие пептиды.Перенос через сарколемму имеет активный характер (осуществляется с помощью посредников), что позволяет накапливать внутри клетки некоторые вещества, в том числе ионы, в большей концентрации, чем снаружи. Это приводит к возникновению мембранного потенциала, который в состоянии покоя мышечного волокна равен 90–100 мВ и является необходимым условием возникновения и проведения возбуждения. Внутриклеточная жидкость — саркоплазма .В саркоплазме локализованы органические вещества, минеральные соли, а также субклеточные частицы: ядра, митохондрии, рибосомы, лизосомы, функция которых заключается в регуляции обмена веществ в мышечном волокне путем воздействия на синтез специфических мышечных белков. Число митохондрий в мышечном волокне очень велико, и располагаются они цепочками вдоль миофибрилл, тесно прилегая к мембранам ретикулума. Внутри саркоплазмы находится система продольных и поперечых трубочек, мембран, пузырьков — саркоплазматический ретикулум. Толщина мембран саркоплазматического ретикулума около 6 нм. Саркоплазматический ретикулум делит саркоплазму на отдельные отсеки, в которых протекают различные биохимические процессы. Пузырьки и трубочки оплетают каждую миофибриллу. Через трубочки, связанные с наружной клеточной мембраной, возможен прямой обмен веществами между клеточными органеллами и межклеточной жидкостью. Трубочки, в частности Т трубочки, могут служить и для распространения волны возбуждения от наружной мембраны волокна к внутренним его зонам, к везикулам и цистернам саркоплазматического ретикулума. Мембраны пузырьков, прилегающих к миофибриллам, содержат белки (в частности, кальсеквестрин), связывающие катионы Са2+. Химический состав мышечной ткани • Вода 75–77% • Белки 20% • Липиды 1–3% • Углеводы 0,5–3,0% • Экстрактивные вещества 1,5–2,0% • Минеральные соли 1% Миофибриллярные белки Миозин: основа толстых нитей Актин: белок тонких нитей Тропомиозин: белок тонких нитей 13 Тропонин: белок тонких нитей Актинин: входит в Z линию и фиксирует там тонкие нити Актинин: регулирует длину тонких нитей МDбелок: входит в М линию и фиксирует там толстые нити СDбелок: регулирует длину толстых нитей Десмин: содержится между Z линиями соседних миофибрилл, обеспечивая совпадение границ всех их саркомеров Белки саркоплазмы: миоглобин, ферменты гликолиза, тканевого дыхания, кальмодулин и кальсеквестрин, способные обратимо связываться с ионами кальция Белки стромы: коллаген и эластин ПОПЕРЕЧНОПОЛОСАТАЯ МУСКУЛАТУРА Саркомер — структурно-функциональная единица поперечно-полосатой мышечной ткани, базовая сократительная единица поперечнополосатых мышц, представляющая собой комплекс нескольких белков, состоящий из трех разных систем волокон. Из саркомеров состоят миофибриллы. Миофибриллы — органеллы клеток поперечнополосатых мышц, обеспечивающие их сокращение. Служат для сокращений мышечных волокон. Миофибрилла — нитевидная структура, состоящая из саркомеров. Каждый саркомер имеет длину около 2 мкм и содержит два типа белковых филаментов: тонкие миофиламенты состоят из актина, толстые филаменты — из миозина. Границы между филаментами (Z-диски) состоят из особых белков, к которым крепятся концы актиновых филаментов. Миозиновые филаменты (толстые нити) также крепятся к границам саркомера с помощью нитей из белка титина (тайтина). С актиновыми филаментами (тонкие нити) связаны вспомогательные белки — небулин и белки тропонин-тропомиозинового комплекса. 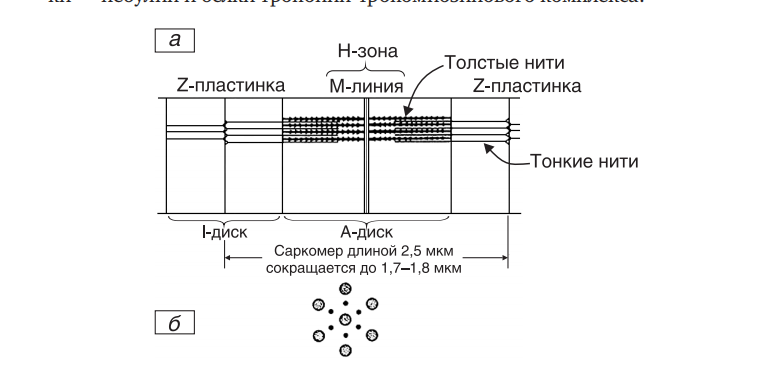 У человека толщина миофибрилл составляет 1–2 мкм, а их длина может достигать длины всей клетки (до нескольких сантиметров). Одна клетка содержит обычно несколько десятков миофибрилл, на их долю приходится до 2/3 сухой массы мышечных клеток. Строение толстого филамента Толстая нить состоит из молекул белка миозина. Миозин — круп$ ный олигомерный белок молекулярной массой 500 кД, состоит из 6 субъединиц, попарно одинаковых. При гидролизе трипсином миозин (рис. 4) распадается на легкий меромиозин (ЛММ) и тяжелый меро$ миозин (ТММ). 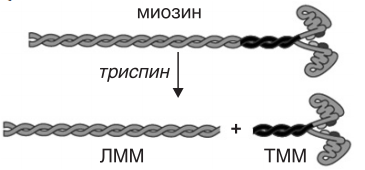 Расщепление миозина трипсином. ЛММ — легкий меромиозин, ТММ — тяжелый меромиозин. Тяжелая цепь: на С-конце — альфа-спираль, на N-конце — глобула (головка). При соединении двух тяжелых цепей С-концевыми участками образуется суперспираль. Две легкие цепи входят в состав глобулы (головки). Стержневой участок суперспирали имеет два отдела, где спирали оголены — эти места открыты для действия протеолитических ферментов и имеют повышенную подвижность. 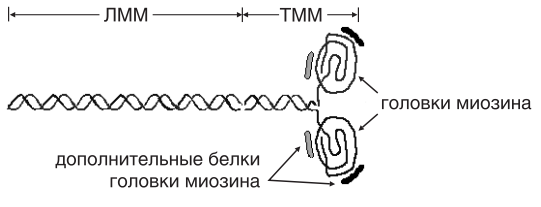 Рис. 5. Схема строения молекулы миозина. ЛММ — легкий меромиозин, ТММ — тяжелый меромиозин. Свойства миозина 1. В физиологических условиях (оптимальные pH, температура, концентрации солей) молекулы миозина спонтанно взаимодействуют между собой своими стержневыми участками (“конец в конец”, “бок в бок”) с помощью слабых типов связей. Взаимодействуют только стержни, головки остаются свободными. 2. Молекула миозина обладает ферментативной активностью (АТФазная активность: АТФ +Н2ОАДФ+Ф). Активные центры рас$ положены на головках миозина. Стадии ферментативной реакции I стадия Сорбция субстрата. В ходе этой стадии АТФ фиксируется на ад$ сорбционном участке активного центра головки миозина. II стадия Гидролиз АТФ. Происходит на каталитическом участке активного центра головки. Продукты гидролиза (АДФ и Ф) остаются фиксированными, а выделившаяся энергия аккумулируется в головке. Примечание: чистый миозин in vitro обладает АТФазной активностью, но она очень низка. III стадия Миозин способен взаимодействовать с актином тонких нитей. Присоединение актина к миозину увеличивает АТФазную активность миозина, в результате скорость гидролиза АТФ возрастает в 200 раз. Актин является аллостерическим активатором миозина. Ускоряется именно III стадия катализа. Освобождение продуктов реакции (АДФ и Ф) из активного центра головки миозина. Строение толстого филамента, состоящего из белка миозина, и его взаимодействие с тонким филаментом представлено на рисунке . 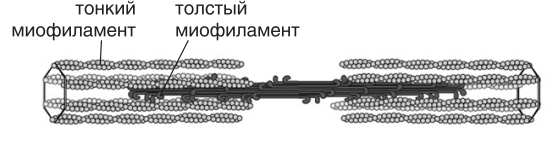 Рис. . Строение толстого филамента. Строение тонкого филамента В состав тонких нитей входят три белка: • сократительный белок актин, • регуляторный белок тропомиозин, • регуляторный белок тропонин. Актин — небольшой глобулярный белок, его молекулярная масса 42 кД. G-актин представляет собой глобулу. В физиологических условиях его молекулы способны к спонтанной агрегации с образованием F-актина . В состав тонкой нити входят две F-актиновые нити , образуется суперспираль (две перекрученные нити). В области Z-линий актин прикрепляется к актинину. Образование фибриллярного актина nG-актин+nАТФ=(G-актин)n +nАДФ+nН3 РО4 , где *n — неопределенное большое число молекул и такое же число мономеров в фибриллярном F-актине — (G-актин)n. 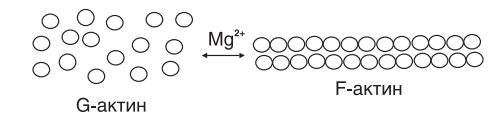 Рис. . Схема взаимопревращения G-актина и F-актина. 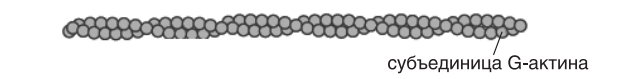 Рис. . Строение F-актина. Тропомиозин — фибриллярный белок молекулярной массой 70 кД. Имеет вид спирали. В тонкой нити на 1 молекулу тропомиозина приходится 7 молекул G-актина. Располагается тропомиозин в желобке между двумя спиралями G-актина. Соединяется тропомиозин “конец в конец”, цепочка непрерывная. Молекула тропомиозина закрывает активные центры связывания актина на поверхности глобул актина. Тропонин — глобулярный белок молекулярной массой 80 кД, имеет 3 субъединицы: тропонин Т, тропонин С и тропонин I. Располагается на тропомиозине с равными промежутками, длина которых равна длине молекулы тропомиозина. Таким образом формируется тонкая нить — тонкий филамент . Функции субъединиц тропонина Тропонин Т (ТнТ) — отвечает за связывание тропонина с тропо$ миозином, через ТнТ конформационные изменения тропонина пе$ редаются на тропомиозин. 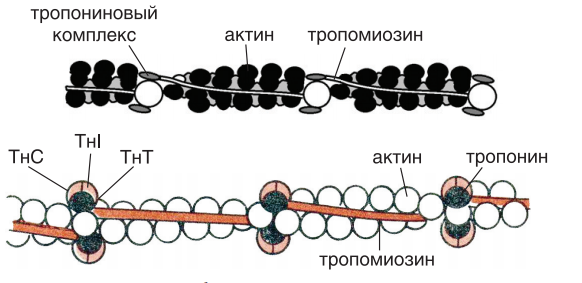 Строение тонкого миофиламента. Тропонин С (ТнС) — Ca2+связывающая субъединица, содержит 4 участка для связывания кальция, по строению похожа на белок кальмодулин. Тропонин I (ТнI) — ингибиторная субъединица — это ненастоящий ингибитор, он только создает пространственное препятствие, мешающее взаимодействию актина и миозина в момент, когда ТнС не связан с Са2+. |
