модуль 1. Модуль 1 Основы термодинамики. Химическое и фазовой равновесие
 Скачать 122.93 Kb. Скачать 122.93 Kb.
|
|
Модуль 1 «Основы термодинамики. Химическое и фазовой равновесие» Вариант №19 18. При каких условиях изменение энтальпии Н равно теплоте, получаемой системой из окружающей среды? При постоянном объеме. 37. При каких соотношениях Н и ТS химический процесс находится в состоянии равновесия. Важный смысл термодинамических потенциалов состоит в том, что они позволяют предсказывать направление термодинамических процессов. Так, например, если процесс происходит при постоянных температуре и давлении, то неравенство, выражающее второй закон термодинамики: эквивалентно неравенству dGp,T 51. Несколько одновременно существующих равновесий можно рассматривать как изолированные, если: а) они независимы друг от друга; б) смещение равновесия в одном не влияет на положение равновесия в другом; в) имеется несколько тождественных по типу химической реакции частиц; г) изменение положения равновесия в одном из них влечет за собой изменение и в других. Ответ объясните. Несколько равновесий можно рассматривать как изолированные, если они протекают независимо друг от друга и смещение равновесия в одном равновесном процессе не влияет на положение в другом. Если же равновесия зависят друг от друга и смещение равновесия в одном из них влечет за собой изменение в других, то такие равновесия являются совмещенными. Значит,ответ а,б. 56. Построить диаграмму состояния однокомпонентных систем на примере углекислого газа и дать ей характеристику. Указать на диаграмме с помощью точек, когда система моновариатная, бивариантная, инвариантная. Обосновать каждую точку с помощью правила фаз Гиббса. Может ли данная система быть тривариантной? Из диаграммы следует, что при внешнем постоянном давлении P1 в точке 1 вещество находится в твердом 8 состоянии, причем давление насыщенных паров над твердой фазой при заданной температуре равно Ртв. При нагревании вещества и заданном постоянном давлении фигуративная точка системы перемещается по горизонтальной прямой вправо, и в точке 2 происходит его плавление, причем температура при этом остается постоянной, так как по правилу фаз Гиббса число степеней свободы двух фаз F = K + n – Ф = 1 + 1 2 = 0 до тех пор, пока одна из фаз полностью не превратится в другую, в данном случае твердая в жидкую. Далее от точки 2 до точки 4 нагревается жидкая фаза, при этом непрерывно возрастает по линии ОК давление ее насыщенного пара. В точке 3 его величина равна Рж, а в точке 4 становится равным внешнему давлению. При температуре, соответствующей точке 4, начинается и заканчивается (F = 0) кипение жидкости, после чего остается одна фаза газ, а система приобретает одну степень свободы, температура газа растет (точка 5). Да,может быть. 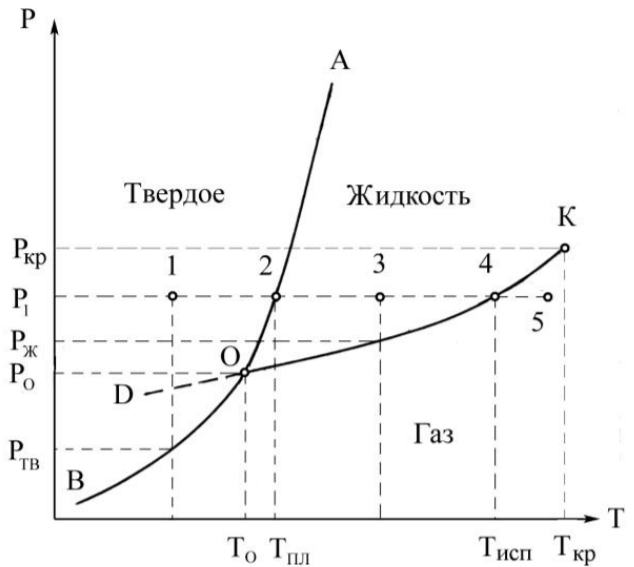 Задача 19. Fe3O4 (т) + H2 (г) → 3FeO(т) + H2O(г) Используя справочные данные стандартных энтальпий веществ, находим: ΔHр-ции = 2·ΔH0Fe+3·ΔH0H2O— ΔH0Fe2O3 — 3·ΔH0H2= 2·0 + 3·(- 241,82) – (-822,16) — 3·0 = 96,7 кДж/моль ΔSр-ции=ΣS0кон – ΣS0исх Дж/(моль·K) Используя справочные данные стандартных энтропий веществ, находим: ΔSр-ции = 2·ΔS0Fe + 3·ΔS0H2O — ΔS0Fe2O3 — 3·ΔS0H2= 2·27,15 + 3·188,7 – 89,96 — 3·131 = 137,44 Дж/(моль·K) ΔG = ΔH – TΔS= 96,7 – 298 ·137,44 /1000 = 55,75 кДж/моль При Т=298°К, ΔG > 0 – реакция не идет самопроизвольно, т.е. реакция будет протекать в обратном направлении. Чтобы рассчитать температуру, при которой равновероятны оба направления реакции, надо ΔG приравнять к нулю: ΔG = ΔH – TΔS = 0, тогда T= — (ΔG – ΔH) / ΔS= — (0-96,7)/0,137 = 705,83 K При Т = 705,83 К реакция будет идти равновероятно как в прямом так и в обратном направлении. |
