Молекулярные основы действия 7-(3-хлорфенил)пиперазинилалкильных производных 8-алкоксипурин-2,6-диона и кетопрофена и их комбина. МОДЛС зачетный реферат Ларионова М.А.. Молекулярные основы действия 7(3хлорфенил)пиперазинилалкильных производных 8алкоксипурин2,6диона и кетопрофена и их комбинация на модели индуцированной боли у мышей
 Скачать 114 Kb. Скачать 114 Kb.
|
|
Федеральное государственное автономное образовательное учреждение высшего образования Первый Московский государственный медицинский университет им. И.М.Сеченова Министерства здравоохранения Российской Федерации (Сеченовский Университет) Институт фармации им. А.П. Нелюбина Кафедра Фармакологии ИФ Реферат на тему: «Молекулярные основы действия 7-(3-хлорфенил)пиперазинилалкильных производных 8-алкоксипурин-2,6-диона и кетопрофена и их комбинация на модели индуцированной боли у мышей» Работу выполнила: Ларионова Мария Александровна Институт фармации им. А.П. Нелюбина, 4 курс, 1 группа М  осква 2020 осква 2020Содержание Обоснование актуальности изучения молекулярных основ действия (МОД) 7-(3-хлорфенил)пиперазинилалкильных производных 8-алкоксипурин-2,6-диона, кетопрофена.....................................................................................................3 1. Экспериментальные подходы к изучению МОД..................................................6 1.1 Объекты исследования..........................................................................................6 1.2 Экспериментальные модели, методы и их модификации..................................7 1.3 Фиксируемые параметры, методики, аппаратура и реактивы...........................8 1.4 Особенности при проведении исследования......................................................9 1.5 Результаты исследования......................................................................................9 2. Представление о МОД разобранной группы ЛС, составленное на основе исследований..............................................................................................................13 Список использованной литературы.......................................................................17 Обоснование актуальности изучения молекулярных основ действия (МОД) 7-(3-хлорфенил)пиперазинилалкильных производных 8-алкоксипурин-2,6-диона и кетопрофена Согласно определению экспертов Международной ассоциации по изучению боли: «Боль – неприятное ощущение и эмоциональное переживание, связанное с реальным или потенциальном повреждением тканей или описываемое в терминах такого повреждения» [9]. Около 90% всех заболеваний связано с болью. По данным разных исследователей, от 7 до 64% населения периодически испытывают чувство боли, а от 7,6 до 45% страдают рецидивирующей или хронической болью. По данным отечественных эпидемиологических исследований [5], распространенность болевого синдрома продолжительностью не менее 1 дня в течение года наблюдалась у 92,4% пациентов. Международное эпидемиологическое исследование, выполненное среди пациентов, обратившихся в учреждения первичной медицинской помощи, показало, что 49,2% предъявляют жалобы на боль [11]. Основными препаратами, применяемыми для лечения болевых синдромов, являются нестероидные противовоспалительные препараты (НПВП), опиоиды и местные анестетики, которые вводятся различными путями и способами [1]. За счет комбинации анальгетиков может быть достигнут анальгетический эффект, что является приоритетным, и минимизированны побочные эффекты лекарств этой группы. Анальгетики не редко дополняются ко-анальгетиками (адъювантами), особенно при боли воспалительного и невропатического типа. В случае невропатической боли лечение опиоидами может иметь ограниченную эффективность, и необходима комбинация с ко-анальгетиками. Ко-анальгетические препараты (адьювантные анальгетики) — это препараты, прямое назначение которых не связано с обезболиванием, однако они помогают уменьшать боль при некоторых болезненных состояниях или способны уменьшить побочные эффекты анальгетиков. Адьюванты также могут быть определены как препараты, которые обладают слабым обезболивающим действием или вовсе не обладают анальгетическим эффектом при введении по отдельности, но могут усиливать обезболивающее действие при совместном применении с анальгетиками. Такие комбинации позволяют усиливать анальгетический эффект без увеличения дозы анальгетиков и, следовательно, могут снизить частоту побочных эффектов. Комбинированное лечение двумя типами лекарств в дозах, намного меньше терапевтических, может иметь большое значение при лечении боли [3]. Ко-анальгетики включают антидепрессанты, нейролептики, противосудорожные средства, антиаритмические средства, кортикостероиды и другие. Эффективность этих препаратов зависит от типа боли, ее патофизиологии, клинического статуса и адекватности лечения боли. Количество этих препаратов со временем увеличивается, и теперь они играют важную роль в лечении хронической боли [6]. Антидепрессанты применяются для лечения хронических болей наряду с классическими анальгетиками. Эти препараты относятся к группам тетрациклических антидепрессантов (амоксапин, мапротилин), трициклических антидепрессантов (амитриптилин, доксепин, имипрамин), селективных ингибиторов обратного захвата серотонина, ингибиторов обратного захвата серотонина и норадреналина (венлафаксин, милнаципран) и атипичные антидепрессанты (бупропион, тразодон, миртазапин, нефазодон) [2,7]. Антидепрессанты, эффективные при хронической боли, действуют посредством различных механизмов, как показано в таблице 1. Таблица 1. «Механизмы действия антидепрессантов, эффективных при хронической боли.»
Антидепрессанты обычно используются для лечения следующих хронических болевых состояний: артрита, центрального болевого синдрома, фибромиалгии, боли в пояснице, мигрени, диабетической невропатии. С другой стороны, некоторые клинические данные свидетельствуют о том, что головная боль может возникать после длительного применения амитриптилина у пациентов с депрессией, но без болевых симптомов [4]. 1. Экспериментальные подходы к изучению МОД 7-(3-хлорфенил)пиперазинилалкильных производных 8-алкоксипурин-2,6-диона и кетопрофена 1.1 Объекты исследования Нестероидные противовоспалительные препараты (НПВП) являются наиболее часто используемыми анальгетиками. НПВП клинически эффективны, поскольку они облегчают боль и воспаление. Таким образом, НПВП (кетопрофен) был выбран в настоящем исследовании в качестве стандартного препарата для совместного введения с тестируемыми соединениями (1–4), 7- (3- хлорфенил) пиперазинилалкильные производные 8-алкоксипурин-2,6-диона. Объектами исследования при изучении МОД 7-(3-хлорфенил)- пиперазинилалкильных производных 8-алкоксипурин-2,6-диона и кетопрофена являются мыши, у которых болевой синдром вызывали введением раствора фенилбензохинона и помещенем на горячую пластину. Строения исследованных соединений 1–4 представлены на рисунке 1 и в таблице 2. Рис. 1 «Химическая структура исследуемых соединений 1-4» 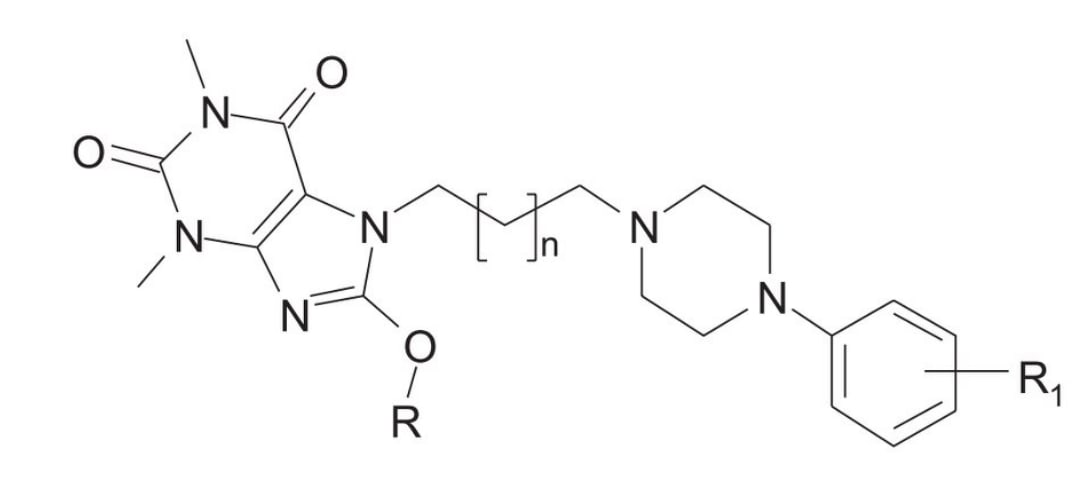 Таблица 2 «Данные о структуре и сродстве связывания для серотониновых рецепторов 5-HT1A и 5-HT2 исследуемых соединений.»
Соединения 1-4 синтезированы путем нуклеофильного замещения ранее полученных 7-хлоралкил-8-алкокси-1,3-диметил-3,7-дигидропурин-2,6-дионов соответствующими фенилпиперазинами в присутствии K2CO3. 1.2 Экспериментальные модели, методы и их модификации Животные. Эксперименты проводились на самцах швейцарских мышей-альбиносов (масса тела 20-26 г). Животных содержали в помещениях с постоянной температурой, подвергшихся 12:12-часовому циклу свет-темнота, и содержали на стандартной пеллетной диете, воду из-под крана применяли ad libitum («по желанию»). Контрольная и экспериментальная группы состояли из шести-восьми животных каждая. Исследуемые соединения вводили внутрибрюшинно в виде суспензии в 0,9% NaCl [16]. 1.3 Фиксируемые параметры, методики, аппаратура и реактивы 1) Тест на судорожный синдром. Мышам вводили 0,25 мл 0,02% раствора фенилбензохинона через 30 мин после внутрибрюшинного введения исследуемого соединения или растворителя. Затем мышей по отдельности помещали в стеклянные стаканы и ждали 5 минут. После этого периода за каждым животным наблюдали в течение 10 минут и подсчитывали количество характерных судорог. Контрольной группе вводили внутрибрюшинно 0,9% NaCl. Обезболивающий эффект тестируемых веществ определялся уменьшением количества наблюдаемых судорог [12]. Значения ED50 и их доверительные границы оценивали по методу Литчфилда и Уилкоксона [14]. 2) Тест с горячей пластиной. В тесте с горячей пластиной мышей обрабатывали внутрибрюшинно либо тестируемым соединением, либо растворителем за 30 минут до помещения животного на устройство с горячей пластиной (Hot Plate 2A, тип Omega) с температурой, контролируемой на уровне 55-56°C. Время, прошедшее до облизывания задних лап или прыжков животного, фиксируется секундомером [10]. Значения ED50 и их доверительные границы оценивали по методу Литчфилда и Уилкоксона [14]. Статистический анализ. Статистическую значимость рассчитывали с помощью t-критерия Стьюдента. Статистически значимыми считали различия при p ≤ 0,05. 1.4 Особенности при проведении исследования 7- (3-Хлорфенил)пиперазинилалкильные производные 8-алкоксипурин-2,6-диона вводили в дозе 5 мг/кг, потому что это была самая низкая используемая доза, которая не снижала подвижность животных. Более высокие дозы 10-30 мг/кг значительно снижали подвижность. Таким образом, эта доза использовалась для исключения ложноположительных результатов в тестах, оценивающих анальгетическую активность. Анальгетическая активность 7-(3-хлорфенил)пиперазинилалкильных производных 8-алкоксипурин-2,6-диона 1–4 измерялась с помощью теста на судорожный синдром, индуцированного фенилбензохиноном. Этот тест заключается во внутрибрюшинном введении химического раздражителя с последующим подсчетом судорог, т.е. характерных сокращений мышц живота, сопровождающихся движением разгибателей задних конечностей. Этот тест определяет периферическую анальгетическую активность; однако некоторые психоактивные агенты (включая клонидин и галоперидол) также проявляют активность в этом тесте. Соединения с противовоспалительными свойствами, такие как НПВП, проявляют значительную активность в этом анализе, а именно устраняют рефлекс, вызванный введением раздражающего вещества, например фенилбензохинона. Результаты исследования Анальгетическая активность исследуемых соединений в тесте на «судорожный синдром». Все производные ксантина проверяли в тесте на судороги. В этом тесте боль вызывалась инъекцией раздражителя (такого как фенилбензохинон) в брюшную полость мышей. В этом тесте исследуемые соединения (1–4), введенные в дозе 5 мг/кг, показали значительные анальгетические свойства (таблица 3). Таблица 3 «Влияние исследуемых соединений и кетопрофена на болевую реакцию в тесте «судорожный синдром» у мышей.»
Данные представлены как средние значения ± стандартная ошибка среднего для 6-8 мышей на группу. Результаты анализировали с помощью t-критерия Стьюдента. ** p <0,01, *** p <0,001 по сравнению с контролем. Кетопрофен был эталонным препаратом в этом исследовании. Среднее количество судорог у мышей, которым вводили растворитель, составляло 30,5. Самый сильный анальгетический эффект наблюдался для соединений 3 и 4. Соединение 3, вводимое внутрибрюшинно в дозе 5 мг/кг веса тела, уменьшало количество судорог в ответ на раздражающий стимул на 84,6%. Введение соединения 4 в той же дозе оказало сильное аналгезирующее действие (ингибирование на 87,2%). Соединение 1 уменьшало количество сокращений живота на 71,4% по сравнению с контрольной группой, в то время как соединение 2 статистически значимо уменьшало количество сокращений живота на 69,5% по сравнению с животными, предварительно обработанными 0,9% NaCl. В этой модели боли каждое лекарство использовалось как отдельно для проверки его обезболивающего действия. так и в комбинации с кетопрофеном (в дозе 5 мг/кг) для поиска возможного усиления его обезболивающего эффекта. Комбинация исследуемого соединения 3 и кетопрофена давала немного больший эффект в тесте на судороги по сравнению с каждым из них, используемым по отдельности (снижение количества судорог на 96,8%) (таблица 4). Комбинация исследуемого соединения 4 и кетопрофена также давала немного больший эффект в тесте на судороги по сравнению с каждым из них, используемым отдельно (снижение на 97,6%). Что касается соединения 2 и кетопрофена, эта комбинация также увеличивала анальгетическую активность в тесте на судороги (увеличение на 95,5% против 69,5 и 93,7% соответственно) (таблица 4). Таблица 4 «Влияние комбинации исследуемых соединений и кетопрофена на болевую реакцию в тесте «судорожный синдром» у мышей.»
Данные представлены как средние значения ± стандартная ошибка среднего для 6-8 мышей на группу. Результаты анализировали с помощью t-критерия Стьюдента. *** p <0,001 по сравнению с контролем. Соединение 1 и кетопрофен снижали количество судорог в ответ на раздражитель на 95,2%. Эта комбинация дала более высокий эффект в тесте на судороги по сравнению с соединением 1 (71,4%) и кетопрофеном (93,7%), используемыми отдельно. Тест с горячей пластиной Как показано в таблице 5, в тесте на горячей пластине исследуемые соединения 1-4 не проявляли анальгетической активности в дозе 5 мг/кг веса тела. Морфин, который был эталонным препаратом в этом исследовании, показал высокую антиноцицептивную активность. Таблица 5 «Влияние исследуемых соединений и кетопрофена на болевую реакцию в тесте с горячей пластиной у мышей.»
Данные представлены в виде средних значений ± стандартная ошибка среднего для 6–8 мышей на группу. Результаты анализировали с помощью t-критерия Стьюдента. ** р <0,01 по сравнению с контролем. 2. Представление о МОД разобранной группы ЛС, составленное на основе исследований Исследования на животных продемонстрировали антиноцицептивное действие серотонина через спинномозговые 5-HT рецепторы в тесте на судороги. Обезболивающее действие различных веществ в этом тесте могло быть результатом их действия на серотонинергическую систему, вероятно, опосредованного рецепторами 5-HT2 и 5-HT3. Исследования на животных выявили обезболивающий потенциал антидепрессантов, который частично опосредуется серотониновыми рецепторами, но также может быть результатом сложных взаимодействий между серотонинергической, адренергической и опиоидной системами. Из-за их антиноцицептивного действия некоторые антидепрессанты могут использоваться в качестве ко-анальгетиков. Соединения 3 и 4 продемонстрировали сродство к рецептору 5-HT2 в 8,3 и 11,5 раз больше, чем к 5-HT1A, тогда как соединения 1 и 2 оказались высокоактивными лигандами рецептора 5-HT1A. Механизм действия исследуемых соединений аналогичен тразодону, который ингибирует белок-переносчик серотонина и является антагонистом серотониновых рецепторов 2-го типа (5-HТ2; блокирует как 5-НТ2А, так и 5-HT2С-рецепторы). Целью первого этапа исследований было определение анальгетической активности исследуемых соединений и кетопрофена в тесте на судороги и тесте с горячей пластиной. Анальгетическая активность 7-(3-хлорфенил)пиперазинилалкильных производных 8-алкоксипурин-2,6-диона 1–4 измерялась с помощью теста на «судорожный синдром», индуцированного фенилбензохиноном. Этот тест заключается во внутрибрюшинном введении химического раздражителя с последующим подсчетом судорог, т.е. характерных сокращений мышц живота, сопровождающихся движением разгибателей задних конечностей. Этот тест определяет периферическую анальгетическую активность; однако некоторые психоактивные агенты (включая клонидин и галоперидол) также проявляют активность в этом тесте. Соединения с противовоспалительными свойствами, такие как НПВП, проявляют значительную активность в этом анализе, а именно устраняют рефлекс, вызванный введением раздражающего вещества, например фенилбензохинона. Все протестированные соединения 1–4 продемонстрировали статистически значимую анальгетическую активность в этом тесте, при этом соединения 3 и 4 показали наивысшую (аналогичную кетопрофену) эффективность. Однако наблюдаемый эффект был не сильнее, чем у кетопрофена в той же дозе. Вероятно, что анальгетическая активность тестируемых соединений опосредуется рецепторами 5-HT2, поскольку они связываются с 5-HT2 в несколько раз сильнее, чем с рецепторами 5-HT1A. Это дополнительно подтверждалось тем фактом, что анальгетическая активность различных веществ в тесте на судороги могла быть результатом стимуляции рецепторов 5-HT2, тогда как они играли менее важную роль. Было ясно показано, что периферические 5-HT2 и пресинаптические 5-HT1A рецепторы участвуют в 5-HT-индуцированной гипералгезии. С другой стороны, не исключено, что рецепторы 5-HT1A также сыграли роль в этом эффекте. Для выяснения механизма действия планировалось определить анальгетическую активность исследуемых соединений, вводимых вместе с антагонистами рецепторов серотонина. Кроме того, участие серотониновых рецепторов в анальгетическом эффекте подтверждается тем фактом, что 5-HT при периферическом применении является мощным провоспалительным и ядовитым агентом, вызывающим гипералгезию как у людей, так и у грызунов. 5-гидрокситриптамин, высвобождаемый из тромбоцитов, тучных клеток и базофилов в поврежденных или воспаленных тканях, может играть роль в воспалительной реакции. Гипералгезия, которая является основным симптомом воспаления и повреждения тканей, вероятно вызванной фенилбензохиноном, была результатом сенсибилизации ноцицепторов различными медиаторами воспаления. 5-гидрокситриптамин является одним из этих медиаторов [17]. Затем была определена обезболивающая активность тестируемых соединений в другой модели боли, а именно в тесте с горячей пластиной. Ни одно из протестированных производных ксантина не увеличивало время реакции на термический раздражитель. Доказанная активность в тесте на судороги с сопутствующим отсутствием активности в тесте с горячей пластиной указывает скорее на периферический, чем центральный механизм обезболивающего действия тестируемых соединений. Следующий этап исследования был направлен на определение возможности использования тестируемых соединений, обладающих антидепрессивной активностью, в качестве коанальгетиков. Чтобы ответить на этот вопрос, соединения были протестированы на анальгетическую активность в тесте на судороги при введении в сочетании с кетопрофеном. Соединения слегка усиливали анальгетический эффект кетопрофена в тесте на судороги при совместном применении. Таким образом, было обнаружено, что соединения 1-4 обладают обезболивающим эффектом при приеме отдельно, однако их эффекты различались в зависимости от используемой модели боли. Обезболивающая активность наблюдалась только в тесте на судороги. Наиболее сильный эффект (аналогичный кетопрофену) показали соединения 3 и 4. Предполагается, что возможный механизм антиноцицептивного действия этих соединений включает активацию анальгезии, опосредованную серотонинергическими путями, или комбинацию этого механизма с другими важными медиаторами, играющими роль в модуляции боли. Соединения слегка усиливали анальгезирующий эффект кетопрофена в тесте на судороги при применении в комбинации. Подводя итог, можно сказать, что проблема участия конкретных подтипов рецепторов серотонина в различных моделях боли на животных очень сложна и требует дальнейшего прояснения. Следует помнить, что роль серотонина в ЦНС и его рецепторно-опосредованные действия, включая анальгетический эффект, тесно связаны с другими системами нейротрансмиттеров. Список литературы Болевой синдром / Под ред. Михайловича В.А., Игнатова Ю.Д.— Л.: Медицина, 1990.— 336 с.: илл Данилов Д.С. Антидепрессанты – селективные ингибиторы обратного нейронального захвата серотонина: 40-летняя история. Неврология, нейропсихиатрия, психосоматика. 2015;(1):66–74. Краткая медицинская литература., Москва, 1999 г. Кукес В.Г.Клиническая фармакология. — 3-е. — М.: ГЭОТАР-Медиа, 2006. Павленко С.С. Состояние и проблемы эпидемиологических исследований болевых синдромов // Боль.— 2006.— № 4.— С. 2–7. Перспективы и проблемы лекарственного обезболивания., «Врачебное дело», Ф.П. Тинус, А.Е.Руденко, 1992 г., №6, с. 56-59. Энциклопедия лекарств. – 12-й вып. / Гл. ред. // М.: РЛС. - 2014. С.- 1440. Assessment and management of chronic pain.— www.guideline.gov Beaulieu P., Lussier D., Porreca F. et al. Pharmacology of Pain. – IASP Press. Seattle, 2010. – 622 p. Eddy N., Leimbach D.:. J. Pharmacol. Exp. Ther. 107, 385 (1953). Gureje O., Simon G.E., Von Korff M. A cross-national study of the course of persistent pain in primary care // Pain.— 2001.— Vol. 92.— P. 195–200. Henderson L.C., Forsaith J.: J. Pharmacol. Exp. Ther. 125, 237 (1959). Jeong C. Y., Choi J. I., Yoon M. H.: Eur. J. Pharmacol. 502, 205 (2004). Litchfield J.T., Wilcoxon F.: J. Pharmacol. Exp. Ther. 96, 99 (1949). M. Zygmunt, G. Chłoń-Rzepa, J.Sapa. The effect of serotonin 5-HT1A, 5-HT2 receptor ligands, ketoprofen and their combination in models of inducted pain in mice - Acta Pol Pharm. May-Jun 2015;72(3):579-85 McQuay H.J., Tramer M, Nye B.A., et. al. A systematic review of antydepressants in neuropatic pain // Pain.— 1994.— Vol. 68.— P. 217–227. Melzak R., Wall P.D. Pain mechanisms: a new theory // Science.— 1965. - Vol. 150.— P. 971–979 zzz | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
