Национальный стандарт республики казахстан вода для охлаждения двигателей тепловозов
 Скачать 342 Kb. Скачать 342 Kb.
|
Лабораторные методы оценки качества воды, применяемой для охлаждения тепловозных дизелей Определение общей жесткости по методика № 1: – определение содержания хлоридов по методике № 2; – определение щелочности по фенолфталеину по методике № 3; – определение фосфатов по методике ЦХТЛ-26-28-04-2003г или по ниже приведенной методике № 4; – определение нитрита натрия по методике № 5; – определение борной кислоты по методике № 6; С.1 Методика определения общей жесткости С.1.1 Необходимые реактивы: – трилон Б (комплексом III, двунатривая соль этилендиаминтетрауксусной кислоты) по ГОСТ 10652; – аммоний хлористый по ГОСТ 3773; – аммиак водный, концентрированный по ГОСТ 3760; – хромтемно-синий кислотный, (индикатор) [3]; – вода дистиллированная по ГОСТ 6709; – натрий сернистый (сульфид натрия) по ГОСТ 2053; – натрий хлористый по ГОСТ 4233; – спирт этиловый по ГОСТ 18300. С.1.2 Посуда, материалы и приборы Посуда мерная лабораторная стеклянная II класса по ГОСТ 1770 вместимостью: – пипетки на 5,10 см3 мерные; – пипетки на 25,50,100 см3 без деления; – бюретка на 25 см3; – колбы конические по ГОСТ 10394 вместимостью 250-300 см3; – капельница по ГОСТ 9876; – пипетка 1, 5 см3 с ценой делением 0,01см3; – цилиндр мерный 100 см3; – воронки стеклянные по ГОСТ 23932. – фильтровальная бумага ГОСТ 12026-76. С.1.3 Подготовка к анализу Приготовление 0,1 Н трилона Б: – раствор готовят из фиксанала, рассчитанного на приготовление 1 литра 0,1Н раствора. Приготовление буферного раствора: – 10 г хлористого аммония (NH4CI) растворяют в дистиллированной воде, добавляют 50 см3 концентрированного аммиака и доводят до 500 см3 дистиллированной водой. Приготовление индикатора: – 0,5 г индикатора растворяют в 20 см3 буферного раствора и доводят до 100 см3 этиловым спиртом. Раствор индикатора хромтемно-синего может сохраняться длительно время без изменения. Приготовление раствора сернистого натрия: – 5 г сернистого натрия Na2S × 9Н2О или 3,7г Na2S × 5Н2О растворяют в 100 см3 дистиллированной воды. Раствор хранят в склянке с резиновой пробкой. С.1.4 Выполнение анализа 100 см3 исследуемой воды, предварительно отфильтрованной через промытый фильтр. Затем в колбу приливают 5,0 см3 аммиачного буферного раствора, добавляют приблизительно 5-7 капель индикатора и перемешивают. Медленно титруют при тщательном перемешивании 0,01 Н раствором трилона Б до изменения окраски в эквивалентной точке (окраска должна быть синей с фиолетовым оттенком). Часто в анализируемой воде содержится цинк или медь (нечеткое изменение окраски в эквивалентной точкд), тогда перед определением жесткости таких вод приливают к пробе 1,0 см3 2%-ного раствора сернистого натрия (Na2S) и затем проводят определение по обычной методике. С.1.5 Обработка результатов Общую жесткость воды в моль/м3 вычисляют по формуле: где, v - количество раствора трилона Б, израсходованное на титрование, см3; Н- нормальность раствора трилона Б; К - поправочный коэффициент к нормальности раствора трилона Б; V- объем воды, взятой для определения, см3. Расхождение между повторными определениями не должно превышать 0,05 моль/м3. С.2 Методика определения содержания хлоридов С.2.1 Необходимые реактивы: – серебро азотнокислое по ГОСТ 1277; – натрий хлористый по ГОСТ 4233; – калий хромовокислый по ГОСТ 4459; – вода дистиллированная по ГОСТ 6709. С.2.2 Посуда, материалы и приборы: Смотри пункт С.1.2 С.2.3 Подготовка к анализу С.2.3.1 Приготовление титрованного раствора азотнокислого серебра. Для приготовления 1,0 л раствора азотнокислого серебра (AgNO3), 1 см3 которого соответствует 1 мг хлор-иона по расчету требуется 4,8 г AgNO3. Навеску 4,8 г AgNO3 переносят в литровую мерную колбу и, растворив ее в небольшом количестве дистиллированной воды, доводят объем раствора до метки дистиллированной водой. Раствор хранится в склянке из стекла темного цвета. С.2.3.2 Приготовление 10-% раствора хромата калия. Навеску 10 г хромата калия (К2СrO4) переносят в колбу объемом 100 см3 и доводят дистиллированной водой до метки. Установка поправочного коэффициента к раствору азотнокислого серебра. Коэффициент подготовленного раствора азотнокислого серебра устанавливают не ниже ч.д.а. по хлористому натрию. 1,649 г химически чистого хлористого натрия, высушенного при 105 °С, растворяют в дистиллированной воде и доводят объем раствора дистиллированной водой до 1000 см . 1 см3 раствора содержит 1 мг Сl. При отсутствии условий точного приготовления раствора хлористого натрия из соли NaCI, титр приготовленного азотнокислого серебра проверяют по фиксанальному 0.1N NaCI. Для этого из приготовленного 0,1N NaCI отбирают точно 282 см3 раствора переносят в мерную колбу, емкостью 1000 см3 и доводят раствор дистиллированной водой до метки. Полученный раствор содержит 1 мг Сl в 1 см3. В три конические колбы на 100 см3 вносят пипеткой 10 см3 приготовленного раствора хлористого натрия и 90 см3 дистиллированной воды, добавляют 1 см3 10 %-ного раствора хромовокислого калия и титруют раствором азотнокислого серебра до появления красноватого окрашивания жидкости, исчезающего при прибавлении одной капли раствора NaCI, содержащего 1 мг хлор иона в 1 см3. Поправочный коэффициент (К) вычисляют по формуле: где, К- поправочный коэффициент раствора азотнокислого серебра; 10 -теоретический расход раствора азотнокислого серебра, пошедшего на титрование 10 см3 раствора хлористого натрия, содержащего 1 мг Сl в 1 см3. С.2.4 Выполнение анализа К 100 см3 исследуемой воды, предварительно отфильтрованной через фильтровальную бумагу, добавляют 5-7 капель 10 % калия хромовокислого (К2СrO4). Нейтрализованную пробу воды (определение производят после определения щелочности) титруют раствором азотнокислого серебра до появления оранжево-желтого окрашивания раствора от образующегося осадка хромовокислого серебра. С.2.5 Обработка результатов Содержание хлориона в мг/дм3 вычисляют по формуле: где, v - количество азотнокислого серебра, израсходованное на титрование, cм3; К - поправочный коэффициент к титру раствора нитрата серебра; V - объем пробы, взятый для определения, см3. Расхождение между результатами повторных определений при содержании Сl от 20 до200мг/л-2мг/дм3 При более высоком содержании - 2 отн. %. C. 3 Методика определения щелочности по фенолфталеину С.3.1 Необходимые реактивы: – соляная кислота ГОСТ 3118 или азотная кислота ГОСТ 4461; – фенолфталеин 1 % спиртовой раствор; – вода дистиллированная по ГОСТ 6709. С.3.2 Посуда, материалы и приборы: Смотри пункт С.1.2 С.3.3 Подготовка к анализу. Приготовление индикатора. 0,5 г фенолфталеина не ниже ч.д.а. растворяют в 50 мл этилового спирта. Приготовление 0,1 Н раствора соляной или азотной кислоты. Раствор готовят из фиксанала, рассчитанного на приготовление 1000 см3 0,1Н раствора соляной или азотной кислоты. С.3.4 Выполнение анализа 100 см3 исследуемой воды, предварительно отфильтрованной через фильтровальную бумагу, отбирают в колбу емкостью 250 см , прибавляют 3-5 капель фенолфталеина и титруют 0.1Н раствором соляной или азотной кислоты до исчезновения розовой окраски. С.3.5 Обработка результатов: Щелочность по фенолфталеину в моль/дм3 , вычисляют по формуле: где, V1 -объем раствора соляной и азотной кислоты, израсходованный на титрование, см3; Н - нормальность раствора соляной или азотной кислоты, моль/дм3; V-объем исследуемого раствора, взятый для анализа, см3. Расхождение между повторными определениями не должно превышать 0,11 моль/дм3. С.4. Ускоренный метод определения фосфорного ангидрида (фосфатов) При отсутствии фотоэлектроколориметра допускается определение фосфорного ангидрида по следующей методике. С.4.1 Необходимые реактивы: – аммоний молибденово-кислый (молибдат аммония) ГОСТ 3769; – кислота соляная (концентрация) ГОСТ 3118 или кислота азотная (концентрация) ГОСТ 4461; – индиго кармин - индикатор; – оловянная палочка, длиной 100-150мм, диаметр-3,5мм. С.4.2 Посуда, материалы и приборы: – мерная колба на 200см3; – пробирки из безцветного стекла; – пипетка мерная 1, 5, 10 см3. С.4.3 Подготовка к анализу С.4.3.1 Приготовление шкалы из индиго кармина: 0,060 г ( с точностью до 0,0002 г.) индигокармина растворить в стакане в 100 см3 воды, нагретой до 70-80 С. После растворения, перелить содержимое стакана в мерную колбу на 200см3, ополоснуть стакан несколько раз горячей дистиллированной водой и слить в эту же колбу. Колбу охладить и долить до метки водой. В десять пробирок из бесцветного стекла, одинаковых по высоте и диаметру, налить соответственно по таблице С.1. Таблица С.1 – Количество индигокармина и воды в пробирках
Пробирки закупорить и жидкость в них хорошо перемешать. Приготовленная таким образом шкала стандартов устойчива и пригодна для работы в течение месяца. С.4.3.2 Приготовление молибдата аммония (запасной) раствор. Для приготовления которого 10 г х.ч. молибдата аммония растворить при нагревании (но не доводить до кипения) в 100 см3 дистиллированной воды, раствор отфильтровать горячим. По остыванию прибавить при помешивании 200 см3 соляной кислоты (конц.) или азотной кислоты (конц.) и 100 см3 дистиллированной воды. Раствор хранить в темном месте. С.4.3.3 Приготовление молибдата аммония (рабочего) раствора. Получаем при добавлении к одному объему запасного раствора молибдата аммония четырех объемов дистиллированной воды. Палочка из химически чистого олова длиной 100-150 мм., диаметром 3-5 мм. С.4.4 Выполнение анализа Колориметрическое визуальное определение фосфатов. Определение фосфатов производят в охлаждающей воде. 1 см3 охлаждающей воды, затем в пробирку добавить 4 см3 дистиллированной воды, 5 см3 рабочего раствора молибдата и перемешивать жидкость оловянной палочкой до появления постоянной синей окраски. Окраску сравнивают со шкалой стандартов в пробирках. Перед употреблением оловянная палочка должна иметь чистую блестящую поверхность. После каждого анализа необходимо сразу же вытирать досуха. Если на палочке образовался трудно счищаемый серый налет , то его нужно снять тонкой наждачной бумагой, после чего палочку ополоснуть дистиллированной водой или обработать в пробирке азотной кислотой (1:2) и тщательно отмыть сначала под краном, а затем дистиллированной водой. С.5 Методика определения содержания нитрита натрия С.5.1 Необходимые реактивы: – оксалат натрия (натрии щавелевокислый) ГОСТ 5839 – марганцевокислый калий ГОСТ 20490 – серная кислота, х.ч.; ч.д.а или азотная кислота х.ч.; ч.д.а. – песочные часы на 1 минуту – вода дистиллированная по ГОСТ 6709. С.5.2 Посуда, материалы и приборы Смотри пункт С.1.2 С.5.3 Подготовка к анализу С.5.3.1 Приготовление 0,1 Н раствора перманганата калия. Раствор готовят из фиксанала, рассчитанного на приготовление 1 дм3 0,1Н раствора перманганата калия. Раствор хранится в склянках из темного стекла. Допускается приготовление из навески. Формула перманганата калия КМnО4, молекулярный вес 158,04, Э =31,608. 3,16г перманганата калия химически чистого растворяют в мерной колбе на 1 дм3 в небольшом количестве дистиллированной воды, предварительно нагретой до 40-50°С. Растворение КМnО4 происходит медленно. В темном растворе трудно заметать полное растворение кристаллов, поэтому колбу, в которой производят растворение, приводят во вращательное движение в наклонном или опрокинутом положении и смотрят на стенки, которые последовательно освобождаются от раствора. После охлаждения раствора, его доводят дистиллированной водой до метки. Концентрация раствора в первые дни после приготовления очень неустойчива ввиду возможного разложения КМnО4 до МnО2 из-за наличия в растворе пыли органического происхождения, окисляющейся перманганатом калия. Поэтому раствор оставляют в темноте в течение 10-14 дней, после чего приступают к установке титра. Если раствор перманганата калия после восстановления содержит осадок МnО2 его необходимо слить сифоном или профильтровать через стеклянную вату. Для быстрого приготовления небольшого количества титрованного раствора перманганата калия , растворяют необходимое количество химически чистого КМпО4 в соответствующем объеме воды, доводят раствор до кипения, еще 1 час кипятят. В случае выпадения осадка МnО2 раствор фильтруют через стеклянную вату. В этом случае к установке титра можно приступить немедленно. Раствор перманганата калия хранится в склянках из темного стекла. Следует избегать соприкосновение раствора перманганата калия с резиновыми трубками и корковыми пробками, а также бумагой. Бюретки и другую стеклянную посуду нельзя оставлять в течении продолжительного времени с раствором КМnО4, так как при этом образуется коричневато-бурая пленка МnО2. С.5.3.2 Установка титра 0,1Н раствора КМnО4 по оксалату натрия. Навеску из предварительно высушенного до постоянного веса при 105-110°С х.ч. оксалата натрия в количестве 0,134г, взятую с точностью до 0,О002г помещают в коническую колбу емкостью 250 см3, растворяют ее в 100 см горячей (80-90°С) воды, прибавляют 10 см3 разбавленной серной кислотой H2SO4 (1:3) или разбавленной азотной кислотой HNO3 (1:3) и титруют 0,1Н раствором КМnО4 при постоянном сильном перемешивании до появления слабо-розового окрашивания. При титровании первые капли перманганата калия обесцвечиваются очень медленно, так как в реакционной среде отсутствуют ионы Мn+2 Реакция окисления ускоряется и титровать можно быстрее, но не допускать переливания титрованного раствора струей. Титрование считают законченным, когда появившаяся розовая окраска раствора не исчезает в течение 1 мин. Поправочный коэффициент: где, V- объем перманганата калия, пошедшего на титрование навески 0,134 г ; 20 - соответствует 0,134г навески. Поправочный коэффициент проверяют не реже 1 раза в 3 месяца. С.5.4 Выполнение анализа. С.5.4.1 25 см3 исследуемой воды отмеривают пипеткой в колбу на 250 см3, добавляют туда же 75 см3 дистиллированной воды и 4 мл серной кислоты (1:3) или азотной кислоты 1:3). Раствор в колбе перемешивают и быстро титруют (без подогрева) раствором марганцевокислого калия до появления устойчивого розового цвета. не исчезающего в течение одной минуты при непрерывном перемешивании. Содержание нитрита натрия определяют по следующей формуле: где, NaNO2 - содержание нитрита натрия в мг/дм3; а- объем 0,1Н раствора перманганата, пошедшего на титрование в см3; k- поправочный коэффициент марганцевокислого калия; V - объем воды, взятой для анализа; 3,45 - количество мг нитрита натрия (NaNO2), эквивалентное 1,0 см3 0,1Н - раствора марганцевокислого калия; 1000 - коэффициент для приведения объема к дм3. Имеется и другой, более ускоренный метод определения концентрации нитрита натрия для растворов с содержанием их от 3500 до 172 мг/дм3. С.5.4.2 Титруют по следующей методике: 10 см3 0,1 КМnО4 помещают в коническую колбу, прибавляют 5 см3 H2SO4 (1:3) или HNO3 (1:3) и титруют охлаждающей водой до исчезновения розового окрашивания. Содержание NaNO2 рассчитывают по формуле: где, 10 - 0,1Н КМnО4, взятых для титрования; 3,45 - пересчетный коэффициент; 1000 - пересчет на 1 см3; V - объем охлаждающей воды. С.6 Методика определения борной кислоты методом рН-метрического титрования в присутствии сорбита С.6.1 Назначение и область применения методики. Методика предназначена для определения в природных водах (пресных, солоноватых, соленых) бора, содержащегося в виде аниона ВО3-3, при содержании его 1,94г/дм3 и минерализации воды до 8г/дм3. Оптимальное содержание бора, позволяющее проводить определение из объема 5-50 см3 (без предварительного разбавления) составляет 3-400 мг/дм . При более высоком содержании бора анализируемую воду следует предварительно разбавить. Основные компоненты, входящие в состав природных вод не мешают определению бора при их содержании в аликвотной части анализируемой пробы воды кальция - до 20мг, магния - до 10мг, карбонатов -до 2,0 мг, бикарбонатов-до 10мг, фторидов -до 1,0 мг. С.6.2 Сущность метода. Методика основана на способности борной кислоты образовывать с сорбитом более сильную комплексную сорбито-борную кислоту, титруемую гидроксидом натрия, происходящей по реакции по формуле (С 8). Конец титрования фиксируется рН-метром, используя метод титрования "до постоянного рН". 2С6Н14О6 + Н3ВO3 = Н [ВО2(С6Н8(ОН)6)2] + Н2О; Н [ВО2(С6Н8(ОН)6)2] + NaOH = Na[ВО2(С6Н8(ОН)6)2] + Н2О (С 8) Титрование проводят в закрытом стакане на установке, состоящей из универсального иономера ЭВ-74 (или рН-метра), стеклянного и вспомогательного электродов, магнитной мешалки, микробюретки, заполненной раствором гидроксида натрия. Для предохранения щелочи от поглощения углекислого газа из воздуха используют насадку с аскаритом. Сущность метода титрования "до постоянного рН" заключается в следующем. Раствор, содержащий борную кислоту, титруют гидроксидом натрия до определенного значения рН ( в данном случае до рН=8,0), не фиксируя расход реагента, так как сначала титруются минеральные кислоты. Затем добавляют сорбит ( при этом происходит уменьшение рН раствора за счет образования сорбито-борной кислоты) и вновь титруют раствор до рН = 8,0, отмечая при этом расход гидроксида натрия, вступившего в реакцию на титрование сорбито-борной кислоты. При содержания бора не выше 4-5 мг в титруемом объеме оптимальное содержание сорбита составляет 1 г. Нижний предел определения бора - 0,2 мг/дм3; Продолжительность одного определения не более 15-20 мин. С.6.3 Отбор и хранение проб. Пробы воды отбирают по ГОСТ 24481-80. Минимальный обьем пробы 150 см3. Пробы воды не консервируют. С.6.4 Аппаратура, материалы и реактивы. 1.Универсальный иономер ЭВ-74 или рН-метр , милливольтметр рН-121. 2.Весы лабораторные аналитические, 1 и 2-й класс точности (ГОСТ 24104-80) и технические квадрантные ВЛКТ-50, 4-й класс точности (ГОСТ 20104-80). З.Измерительный электрод с водородной функцией типа ЭСЛ-65-07 по ТУ 25.05.2234-77. 4.Вспомогательный электрод ЭВЛ-1МЗ. 5.Электромагнитная мешалка ММ-ЗМ. 6.Микробюретка на 5 см3 (ГОСТ 1770); 7.Колбы мерные на 100, 500 и 1000 см3 (ГОСТ 1770); 8. Пипетки мерные на 5,10,25 и 50 см3 (ГОСТ 20292); 9. Цилиндры мерные на 50, 100 и 250 см3 (ГОСТ 1770); 10.Стаканы стеклянные лабораторные на 100 см3 (ГОСТ 25336); 11.Воронки стеклянные конусообразные (ГОСТ 8613); 12.Трубки хлоркальциевые с одним шаром, тип ТХ-11, диаметр 30мм (ГОСТ 9964) или трубка стеклянная диаметром -30мм с оттянутым концом. 13.Тройник Т-образный стеклянный (ТУ 25-11-800-72); 14.Сосуд полиэтиленовый на 500 или 1000 см3; 15.Пробки резиновые № 14-19 и 36. 16.Трубка резиновая диаметром 5мм; 17.Фильтры обеззоленные "белая лента", 11см.; 18.Соляная кислота ч.д.а. или х.ч. (ГОСТ 3118); 19.Натрия гидроксид, ч.д.а. или х.ч. (ГОСТ 4328); 20. D (-) сорбит, чистый (или медицинский) [4]; 21.Борная кислота, ч.д.а. или х.ч. (ГОСТ 9656); 22.Аскарит [5] 23.Наборфиксанаповдля рН-метрии: рН=6,86; 9,18 и 1,68; 24.Вода дистиллированная (ГОСТ 6709). С.6.5 Подготовка к анализу. С.6.5.1 Подготовка лабораторной установки. Электроды подключают в соответствующие гнезда универсального иономера или рН-метра рН-121. Укрепляют электроды в штативе магнитной мешалки, а микробюретку устанавливают на подставке. Резиновую пробку (№ 35) разрезают на две части на расстоянии 0,05-1,0 см от края, наиболее подходящего для закрывания стакана для титрования. Просверливают в полученной пластине три отверстия и вставляют в них два электрода и носик микробюретки. Опускают электроды и носик микробюретки в стакан с дистиллированной водой. Заполняют аскаритом хлоркальциевую трубку ( или стеклянную трубку, заменяющую ед), закрепляют на штативе магнитной мешалки и соединяют через тройник с резервуаром и измерительной частью микробюретки для предотвращения поглощения углекислоты из воздуха раствором гидроксида натрия. Заполняют микробюретку 0,03 М раствором гидроксида натрия. Настраивают рН-метр на рабочий режим измерения по буферным растворам с рН 1,68; 6,86 и 9,18; С.6.6 Приготовление растворов. 1. Соляная кислота, 0,1 н раствор. 8,3 см3 концентрированной соляной кислоты (плотность 1,19 г/см3) доводят дистиллированной водой до 1000 см3; 2. Гидроксид натрия 0,3 н раствор. 12г гидроксида натрия растворяют в 400-500 см3 дистиллированной воды, предварительно прокипяченной для удаления углекислоты. После охлаждения доливают той же водой до 1000 см3, хранят в полиэтиленовой посуде. 3. Гидроксид натрия, 0,03 н раствор. Раствор готовят из 0,3 н раствора гидроксида натрия на предварительно прокипяченной дистиллированной воде. 4. D (-) сорбит, 20% раствор. 20г сорбита растворяют в 80 см3 дистиллированной воды, фильтруют через сухой фильтр. Используют свежеприготовленный раствор. 5. Буферные растворы о рН = 1,68; 6,86 и 9,18. Фиксанал с соответствующим значением рН растворяют в 1000 см3 дистиллированной воды. 6. Стандартный раствор бора с содержанием 0,1 мг бора в 1 см3 раствора. 0,286г. перекристаллизованной борной кислоты растворяют в воде в мерной колбе вместимостью 500 см3. С.6.7 Проведение анализа. В стакан на 100 см3 в зависимости от содержания бора отбирают 5-50 см3 анализируемой воды (оптимально 0,15-2 мг бора). К аликвотной части менее 50 см3 прибавляют дистиллированную воду до объёма 50 см3. Стакан ставят на электромагнитную мешалку, раствор перемешивают, погружают в него электроды и носик микробюретки. Подготовку пробы к титрованию проводят при постоянном перемешивании раствора. Для этого нажимают кнопку рН-метра в диапазоне измерения рН = минус 1 плюс 19 и по каплям прибавляют 0,1 н раствор соляной кислоты до рН-3,0. При этом происходит разрушение карбонатов и удаление углекислоты из раствора. Через 1-2 мин прибавляют по каплям О.ЗМ раствор гидроксида натрия до рН 8,0, при этом переключают кнопку рН-метра в диапазон измерения рН 4 плюс 9 и точно устанавливают рН = 8,0, добавляя по каплям 0,03 н раствора гидроксида натрия (показание прибора должно быть устойчивым). Затем к анализируемому раствору прибавляют пипеткой 5 см3 20 %-ного свежеприготовленного раствора сорбита. При этом стрелка рН-метра отклоняется в области рН менее 8,0 за счет образования комплексной сорбито-борной кислоты, которую титруют из микробюретки 0.03М раствором гидроксида натрия до тех пор, пока стрелка рН-метра вновь не достигнет устойчивого показания рН = 8,0, что указывает на конец титрования. Записывают объём раствора гидроксида натрия, пошедший на титрование сорбито-борной кислоты и рассчитывают содержание бора. Если на титрование бора расходуется больше 10 см3 гидроксида натрия, то в титруемый раствор следует добавить еще 5 см3 раствора сорбита (учесть при расчете "двойную холостую") или повторить титрование из меньшей аликвотной части анализируемой пробы воды. С.6.8 Установка титра раствора гидроксида натрия. Титр раствора гидроксида натрия по бору устанавливают в тех же условиях, в каких проводят титрование бора в природных водах одновременно с анализом проб. Для этого в три стакана вместимостью 100 см отбирают по 5 см3 стандартного раствора бора, доливают водой до 50 см3 и титруют гидроксидом натрия как описано при выполнении анализа проб воды. Обязательно производят "холостое титрование" (учитывают его при расчетах), для этого в стакан на 100 см3 наливают 50см3 дистиллированной воды и титруют как при титровании анализируемых проб воды. Титр гидроксида натрия по бору рассчитывают по формуле: где, С - массовая концентрация бора в стандартном растворе, равная 0,1мг/см3; V1 - объём стандартного раствора бора, см3; V2 - объём 0,03 н раствора гидроксида натрия, пошедший на титрование бора (среднее значение из трех определений); V3 - объём 0,03 н гидроксида натрия, пошедший на "холостое титрование". С.6.9 Обработка результатов. Содержание бора в пробе воды рассчитывается по формуле: где, Т - титр раствора гидроксида натрия по бору мг/ см3; V1 - объём раствора гидроксида натрия, пошедший на титрование бора, см3; V2 - объем аликвотной части анализируемой пробы воды, см3; V3 - объём раствора гидроксида натрия, пошедший на "холостое титрование", см3; 1000 - коэффициент перевода см3 в дм3. Результаты анализов выражают в виде элементного бора, что объясняется трудностью установления его миграционной формы. Сходимость результатов анализа (А) в относительных процентах вычисляется по формуле: 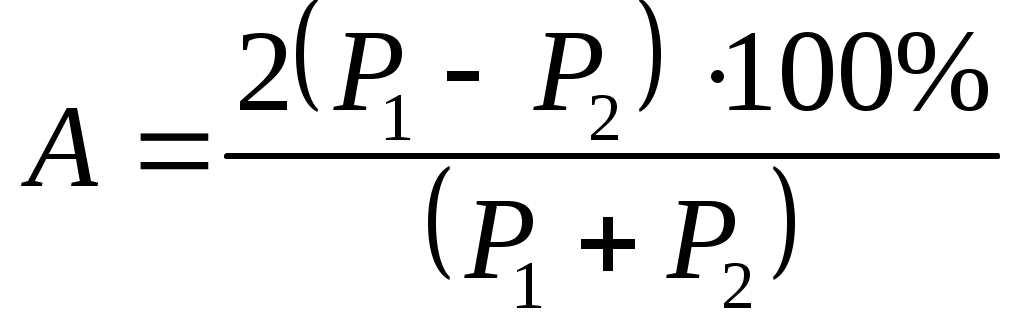 (С.11) (С.11)где, Р1- больший результат из двух параллельных определений; Р2 - меньший результат из двух параллельных определений. Расхождения между результатами двух параллельных определений не должны превышать величин, указанных в таблице №5. Результат округляют до двух значащих цифр. Таблица С.2 – Допустимые расхождения между результатами параллельных определений бора в природных водах, выполняемых титриметрическим методом
Библиография [1] ТУ 2415-001-52323505-2002 Технические условия. Присадка "ИНКОРТ 8М3" (универсальная).[2] ЦХТО-26-28.04-2003 Модельная методика формирования системы оплаты труда и стимулирования работников образовательных учреждений субъектов Российской Федерации. [3] ТУ 6—09—3870—75 Индикатор хромовый темно-синий. [4] ТУ 6-09-1588-77 Д (+) - сорбит (гексит, Д-сорбитол) квалификации чистый. [5] ТУ 6-09-4128-88 Аскарит чистый. Технические условия.
РАЗРАБОТЧИК РГП «Казахстанский институт стандартизации и сертификации»
СОИСПОЛНИТЕЛИ АО «Казахская академия транспорта и коммуникаций им. М.Тынышпаева»
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
