Научноисследовательская работа студентки 4 курса Направления подготовки 06. 03. 01 Биология Профиль Биохимия
 Скачать 1.18 Mb. Скачать 1.18 Mb.
|
2.3. Описание неравновесных процессов взаимодействия гемоглобина с кислородомНеравновесные процессы, происходящие при взаимодействии гемоглобина с кислородом, описываются следующей системой уравнений: 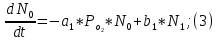 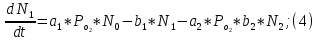 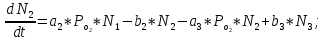 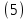 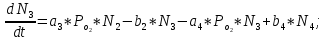 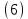 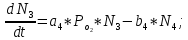 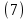 где 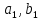 кинетические коэффициенты реакции присоединения и отсоединения кислорода от гемоглобина. кинетические коэффициенты реакции присоединения и отсоединения кислорода от гемоглобина.В настоящее время детальный анализ системы уравнений, описывающей кинетику взаимодействия гемоглобина с кислородом, сделан лишь для случая стационарного состояния. Общая задача вычисления кинетических коэффициентов 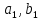 не решена. Обычно из экспериментальных данных определяют не восемь коэффициентов, а всего два. Эти параметры получаются 15 в случае рассмотрения реакции взаимодействия гемоглобина с кислородом как реакции первого порядка, то есть вычисляются некие усредненные по всем состояниям коэффициенты [a], [b]. не решена. Обычно из экспериментальных данных определяют не восемь коэффициентов, а всего два. Эти параметры получаются 15 в случае рассмотрения реакции взаимодействия гемоглобина с кислородом как реакции первого порядка, то есть вычисляются некие усредненные по всем состояниям коэффициенты [a], [b].Для того чтобы установить связь между кинетическими коэффициентами 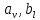 рассмотрим стационарное решение системы уравнений (9): рассмотрим стационарное решение системы уравнений (9):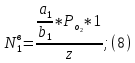 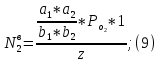 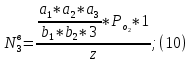 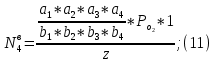 Где 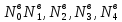 – – 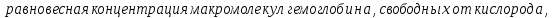 с одной, двумя, тремя, четырьмя молекулами кислорода соответственно, Z=1+ 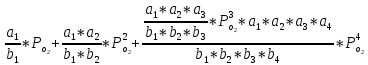 (12) (12)Если сделать предположение, что процесс присоединения кислорода к гемоглобину определяется диффузией, то константа скорости ассоциации остаётся без изменений. Действительно, по данным [6] ни изменение pH, ни изменение температуры не влияет на скорость реакции соединения гемоглобина с кислородом, тогда как скорость реакций диссоциации возрастает при повышении температуры, а изменение концентрации протонов водорода влияет лишь в ограниченной зоне, между 5,5 и 7,5 pH Исходя из вышесказанного, для описания кинетических уравнений примем все константы прямой реакции оксигенации одинаковыми: (a)= 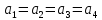 (13) (13)Константы обратной реакции находятся из соотношения констант реакций ( 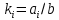 ) с коэффициентами Эйдера (8), которые были найдены раннее из термодинамической модели: ) с коэффициентами Эйдера (8), которые были найдены раннее из термодинамической модели: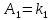 , , 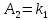 * *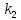 , , 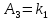 * *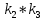 , , 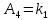 * *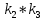 * *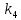 (14) (14)На рисунке 13 показана зависимость степени заполнения гемоглобина кислородом в растворе от времени для процесса дезоксигенации. Точки экспериментальные данные работы [7] при различных начальных степенях заполнения гемоглобина кислородом. Описание экспериментальных данных наилучшим образом получилось при a=(4+1.2)*1 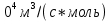 . .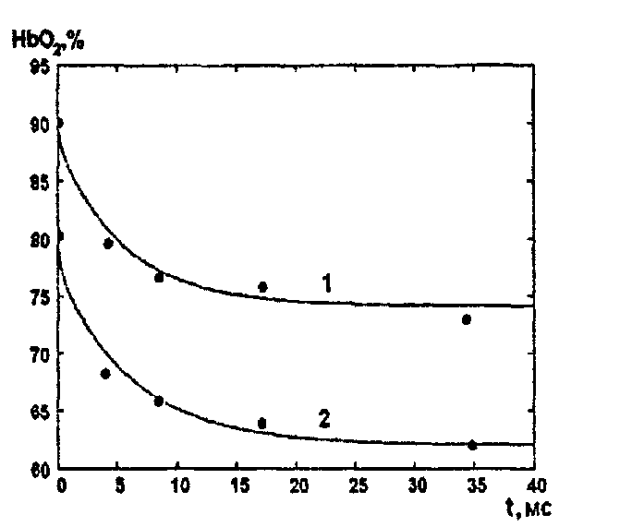 Рисунок 13 – Зависимость степени заполнения гемоглобина кислородом в растворе от времени для процесса дезоксигенации Точки экспериментальные данные [7]. Кривые моделирование. 1начальная степень заполнения гемоглобина кислородом 90%. 2 80%. Таким образом, можно получить выражения для констант обратных реакций: 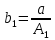 , , 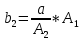 , , 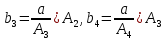 (15) (15)Так как коэффициенты Эйлера зависят от различных физиологических условий, то и коэффициенты обратных реакций взаимодействия гемоглобина с кислородом также зависят от них. Экспериментальное изучение неравновесных процессов проведено в классической работе Мосшизуки [7]. Он разработал и применил весьма точный метод для измерения скорости реакций. Нами было проведено описание экспериментальных данных, по кинетике оксигенации гемоглобина, полученных этим автором. Для описания кинетики взаимодействия гемоглобина с кислородом численно решалась система уравнений (9). При описании кинетики присоединения кислорода к гемоглобину начальное распределение кислорода в гемоглобине рассчитывалось при некотором давлении 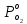 , соответствующем начальной степени заполнения гемоглобина кислородом. Затем система выводилась из состояния равновесия путем изменением давления с , соответствующем начальной степени заполнения гемоглобина кислородом. Затем система выводилась из состояния равновесия путем изменением давления с 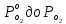 . Для процесса оксигенации гемоглобина . Для процесса оксигенации гемоглобина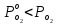 Для процесса дезоксигенации оксигемоглобина Для процесса дезоксигенации оксигемоглобина 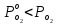 На рисунке 14 изображена Зависимость степени заполнения гемоглобина кислородом в эритроцитах от времени для процесса оксигенации при разных значениях кислотности. Коэффициент прямой реакции гемоглобина с кислородом оказался равным a=(1.1+0,3)*1 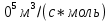 . .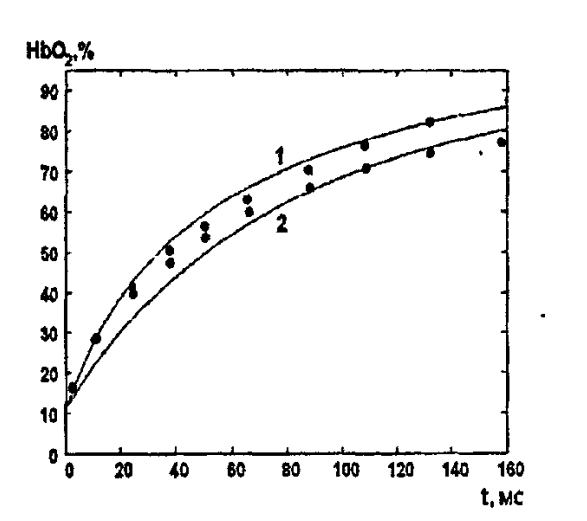 Рисунок 14 – Зависимость степени заполнения Отличие коэффициента прямой гемоглобина кислородом в эритроцитах от времени для процесса оксигенации. При описании экспериментальных кривых, описывающих неравновесные процессы, подбирается только параметр а. Коэффициенты 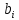 определялись из соотношений (13), а коэффициенты Эйдера были взяты из выражения (8). определялись из соотношений (13), а коэффициенты Эйдера были взяты из выражения (8). |
