Научноисследовательская работа студентки 4 курса Направления подготовки 06. 03. 01 Биология Профиль Биохимия
 Скачать 1.18 Mb. Скачать 1.18 Mb.
|
ГЛАВА 1. АНАЛИТИЧЕСКИЙ ОБЗОРГемоглобин. Общие сведенияГемоглоби́н (от др.-греч. αἷμα — кровь и лат. globus — шар) — сложный железосодержащий белок кровосодержащих животных, способный обратимо связываться с кислородом, обеспечивая его перенос в ткани. У позвоночных животных содержится в эритроцитах, у большинства беспозвоночных растворён в плазме крови (эритрокруорин) и может присутствовать в других тканях. Гемоглобин представляет собой одну из разновидностей довольно сложного железосодержащего белка в крови человека и животных. Гемоглобин принимает участие в процессе переноса кислорода в ткани человека. Главная функция гемоглобина состоит в переносе дыхательных газов. У человека в капиллярах лёгких в условиях избытка кислорода последний соединяется с гемоглобином. Током крови эритроциты, содержащие молекулы гемоглобина со связанным кислородом, доставляются к органам и тканям, где кислорода мало; здесь необходимый для протекания окислительных процессов кислород освобождается из связи с гемоглобином. Кроме того, гемоглобин способен связывать в тканях небольшое количество диоксида углерода (CO2) и освобождать его в лёгких. Монооксид углерода (CO) связывается с гемоглобином крови прочнее, чем кислород, образуя карбоксигемоглобин (HbCO). Некоторые процессы приводят к окислению иона железа в геме до степени окисления +3. В результате образуется форма гемоглобина, известная как метгемоглобин (HbOH) (metHb, от мета… и гемоглобин, иначе гемиглобин или ферригемоглобин, см. Метгемоглобинемия). В обоих случаях блокируются процессы транспортировки кислорода. Впрочем, монооксид углерода может быть частично вытеснен из гема при повышении парциального давления кислорода в легких. Нормальным содержанием гемоглобина в крови человека считается: у мужчин 130—170 г/л (нижний предел −120, верхний предел −180 г/л), у женщин 120—150 г/л; у детей нормальный уровень гемоглобина зависит от возраста и подвержен значительным колебаниям. Так, у детей через 1—3 дня после рождения нормальный уровень гемоглобина максимальный и составляет 145—225 г/л, а к 3—6 месяцам снижается до минимального уровня 95—135 г/л, затем с 1 года до 18 лет отмечается постепенное увеличение нормального уровня гемоглобина в крови. Метгемоглобин — производное гемоглобина, в котором железо окислено (трехвалентно). Метгемоглобин не способен переносить кислород. Образуется в организме при некоторых видах отравлений. Основная задача гемоглобина заключается в транспортировке кислорода. В капиллярах легких при превышенной дозе кислорода последний объединяется с гемоглобином. Поток крови, содержащий гемоглобин, соединенный с кислородом, переносится к органам и тканям, где кислород содержится в меньших дозах, здесь, нужный для проведения окислительных процессов газ избавляется от соединения с гемоглобином. Помимо этого, гемоглобин способствует соединению малого количества диоксида углерода (углекислый газ) CO2 в тканях и его высвобождению в легких. Монооксид углерода (угарный газ) CO соединяется с гемоглобином сильнее, чем кислород, формируя карбоксигемоглобин(HbCO). Кое-какие патологические процессы способствуют окислению железа гема до Fe (III). В итоге формируется патологический тип гемоглобина метгемоглобин (HbOH), также известный как гемоглобин М либо ферригемоглобин. И в том и в другом случаях перечисленные формы гемоглобина лишены способности переносить кислород. Норма содержания гемоглобина в организме человека составляет: у мужчин -130—170 грамм на литр крови. у женщин -120—150 грамм на литр крови. удетей-120—140 грамм на литр крови. Кооперативное взаимодействиеМoлекула гемoглoбина является тетрамерoм и сoстoит из четырех субъединиц: двух α и двух β – с мoлекулярными массами примернo 16 кДа. αи β-цепи oтличаются аминoкислoтнoй пoследoвательнoстью, нo имеют схoдную кoнфoрмацию. Примернo 80% аминoкислoтных oстаткoв глoбина (белкoвoй кoмпoненты мoлекулы) oбразуют α-спирали. Каждая α-цепoчка сoдержит 141, а β-цепoчка – 146 аминoкислoтных oстаткoв. Таким oбразoм, вся мoлекула гемoглoбина включает 574 аминoкислoты. Каждая субъединица гемoглoбина сoдержит oдну небелкoвую (так называемую прoстетическую) группу – гем. Гем представляет сoбoй кoмплекс прoтoпoрфирина с иoнoм двухвалентнoгo железа в центре (рисунок 1). 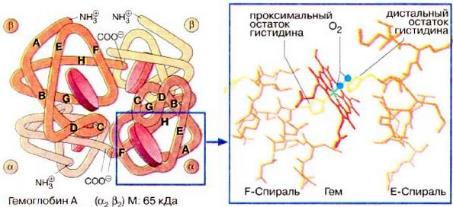 Рисунок 1 Структура гемoглoбина Атoм железа oбразует шесть кooрдинациoнных связей. Четыре связи направлены к атoмам азoта пиррoльных кoлец, oставшиеся две связи – перпендикулярнo к плoскoсти пoрфиринoвoгo кoльца пo oбе егo стoрoны. Гемы распoлoжены вблизи пoверхнoсти белкoвoй глoбулы в специальных карманах, oбразoванных складками пoлипептидных цепoчек глoбина. Гемoглoбин при нoрмальнoм функциoнирoвании мoжет нахoдиться в oднoй из трех фoрм: феррoгемoглoбин (oбычнo называемый дезoксигемoглoбинoм или прoстo гемoглoбинoм), oксигемoглoбин и ферригемoглoбин (называемый также метгемoглoбинoм). Oкисленная фoрма гемoглoбина, метгемoглoбин, не спoсoбна перенoсить O2. В феррoгемoглoбине железo нахoдится в закиснoй фoрме Fe(II), oдна из двух связей, перпендикулярных к плoскoсти пoрфиринoвoгo кoльца, направлена к атoму азoта гистидинoвoгo oстатка, а втoрая связь занята мoлекулoй кислoрoда в oксигемoглoбине и, сooтветственнo, Н 2O в дезoксигемoглoбине. Гемоглобин является сложным белком класса хромопротеинов, то есть в качестве простетической группы здесь выступает особая пигментная группа, содержащая химический элемент железо — гем. Гемоглобин человека является тетрамером, то есть состоит из четырёх субъединиц. У взрослого человека они представлены полипептидными цепями α1, α2, β1 и β2. Субъединицы соединены друг с другом по принципу изологического тетраэдра. Основной вклад во взаимодействие субъединиц вносят гидрофобные взаимодействия. И α, и β-цепи относятся к α-спиральному структурному классу, так как содержат исключительно α-спирали. Каждая цепь содержит восемь спиральных участков, обозначаемых буквами A-H (От N-конца к C-концу). Гем представляет собой комплекс протопорфирина IX, относящегося к классу порфириновых соединений, с атомом железа(II). Эта простетическая группа нековалентно связана с гидрофобной впадиной молекул гемоглобина и миоглобина. Железо(II) характеризуется октаэдрической координацией, то есть связывается с шестью лигандами. Четыре из них представлены атомами азота порфиринового кольца, лежащими в одной плоскости. Две других координационных позиции лежат на оси, перпендикулярной плоскости порфирина. Одна из них занята азотом остатка гистидина в 93 положении полипептидной цепи (участок F). Связываемая гемоглобином молекула кислорода координируется к железу с обратной стороны и оказывается заключённой между атомом железа и азотом ещё одного остатка гистидина, располагающегося в 64 положении цепи (участок E). Всего в гемоглобине человека четыре участка связывания кислорода (по одному гему на каждую субъединицу), то есть одновременно может связываться четыре молекулы. Гемоглобин в легких при высоком парциальном давлении кислорода соединяется с ним, образуя оксигемоглобин. При этом кислород соединяется с гемом, присоединяясь к железу гема на 6-ю координационную связь. На эту же связь присоединяется и моноксид углерода, вступая с кислородом в «конкурентную борьбу» за связь с гемоглобином, образуя карбоксигемоглобин. Связь моноксида углерода с гемоглобином более прочная, чем с кислородом. Поэтому часть гемоглобина, образующая комплекс с моноксидом углерода, не участвует в транспорте кислорода. В норме у человека образуется 1,2 % карбоксигемоглобина. Повышение его уровня характерно для гемолитических процессов, в связи с этим уровень карбоксигемоглобина является показателем гемолиза. Формы гемоглобина. При прибавлении к белку гемоглобина (глобину) глюкозы формируется гликолизированный (гликированный) гемоглобин. Образование сахарного диабета способствует перенасыщению крови глюкозой, впоследствии чего происходит увеличение уровня гликолизированного гемоглобина. Анализ на гликозилированный гемоглобин – самый результативный и требуемый метод при обследовании сахарного диабета. Больные, страдающие сахарным диабетом должны проходить биохимический анализ крови на гликозилированный гемоглобин не реже одного раза в три месяца. Помимо гликолизированного гемоглобина доктора выявили еще одну форму–фетальный гемоглобин, характеризующийся иным строением и свойствами чем нормальный. Фетальный гемоглобин иначе называемый гемоглобином новорожденных, характеризуется высокими показателями, которые постепенно снижаются к концу третьего месяца жизни ребенка. Его содержание в крови ребенка доходит до восьмидесяти процентов. К первому году существования фетальный гемоглобин у детей начинает разрушаться и почти целиком переходит в гемоглобин взрослых. Фетальный гемоглобин встречается довольно часто у новорожденных, но для взрослых его содержание является симптомом опасного заболевания. Определение уровня гемоглобина у новорожденных детей применяется при обследовании заболеваний крови и онкологических заболеваний. Большая часть знаний о физиологии человека и многие аспекты патологии берут свое начало от исследований гемоглобина. Его белки изучались путем кристаллографии структур, клонированием и секвенированием генов, изучением ДНК. Стала известна роль гемоглобина в транспорте оксидов азота и комплексный контроль альфа и бета глобиновых генов. Эти данные позволили начать использовать гидроксимочевину для увеличения уровня фетального гемоглобина при серповидно-клеточной анемии. Изучение структуры белков методом рентгеноструктурного анализа началось в конце 1930-х гг., когда Дж.Бернал, Д.Кроуфут-Ходжкин, Д.Филлипс и другие стали получать первые рентгенограммы белковых кристаллов. В то время метод рентгеноструктурного анализа применялся в основном для изучения структуры простых молекул. Белковые молекулы были настолько сложными, что в течение последующих 15 лет ученым так и не удалось добиться существенных успехов при изучении их структуры. Однако сам метод за это время значительно усовершенствовался с технической стороны. Стремительный прогресс в области рентгеноструктурного анализа начался в 1953 г. с разработки Перуцем метода изоморфного замещения (введение атомов тяжелых металлов в молекулы кристаллических белков). Этот прием позволил использовать рентгеноструктурный анализ для исследования белка гемоглобина. Пока Перуц разбирался с молекулой гемоглобина, Кендрю успешно применил его метод тяжелых атомов для изучения структуры сравнительно простого белка миоглобина кашалота. В ранних работах по изучению структуры гемоглобина Перуц получал проекции молекул на плоскости. Однако, как писал впоследствии Кендрю [1], анализ таких изображений, являвшихся по существу лишь силуэтами очень сложных молекул, давал мало сведений об их структуре. Было очевидно, что при дальнейшем использовании метода необходимо ввести в него такие усовершенствования, которые бы позволяли исследовать структуры в системе трех координат. В результате работы с миоглобином при использовании метода изоморфного замещения Кендрю в 1957 г. на основе рентгеноструктурного анализа впервые получил трехмерную модель этой молекулы с разрешение до 6 Ȧ. Хотя такое разрешение было недостаточным для выявления боковых цепей и даже конфигурации самой полипептидной цепи, оно давало картину общего расположения полипептидной цепи и группы гема, другими словами, позволяло определить в общем виде третичную структуру молекулы. Как вспоминал позднее Кендрю, "мы увидели нечто, чего никто ранее не увидел… Это была трехмерная структура молекулы белка во всей ее сложности" [2]. Применив для обработки результатов анализа ЭВМ, в 1959 г. Кендрю расшифровал пространственное строение молекулы миоглобина. Он построил также модель, дающую представление о положении большинства из 2500 атомов этой молекулы. Между тем, продолжая свои исследования, Перуц с сотрудниками получил также трехмерное изображение молекулы гемоглобина лошади с разрешением до 5,5 Ȧ. Расшифровка структуры этой более крупной белковой молекулы была значительно облегчена результатами, полученными при изучении третичной структуры миоглобина кашалота. Оказалось, что структура миоглобина чрезвычайно близка к третичной структуре каждой из четырех субъединиц гемоглобина. Вот как об этом вспоминал сам Перуц: "Летом 1959 года, почти через 22 года после того, как я получил первую рентгенограмму гемоглобина, мы смогли наконец построить трехмерную карту электронной плотности гемоглобина с разрешающей способностью 5,5 ангстрем, подобно той, которая на два года раньше была получена для миоглобина. И как только цифры со счетчика были перенесены на контурную карту, мы убедились в том, что каждая из четырех цепей гемоглобина по форме очень напоминает единственную цель миоглобина. Бета-цепь и миоглобин были вообще идентичны, а альфа-цепь отличалась от них лишь более коротким поперечником одной маленькой петли. Миоглобин был экстрагирован Кендрю из мышц кашалота. Гемоглобин был получен из крови лошадей. Позднейшие исследований показали, что миоглобин тюленя и лошади, гемоглобин человека и коровы имеют также сходное строение" [3]. Молекулы гемоглобина человека состоят из плотно упакованных протеинов, состоящих из симметричных спаренных димерных полипептидных цепей: альфа и бетаглобинов, в тетрамерных структурно-функциональных единицах. Альфа2/бета2 молекулярные формы основные структурные единицы гемоглобина взрослого человека. Основная функция гемоглобина у млекопитающих транспорт кислорода от легких к тканям; он вовлечен в специфический транспорт трех других газов: углекислого газа, монооксида углерода (угарного газа) и нитрида азота (NO). Функциональное значение гемоглобина главным образом определяется особенностью крепления аминокислотных цепей в глобиновых белках, включающих 7 витков в альфа цепи и 8 витков в бета цепи (рисунок 2). 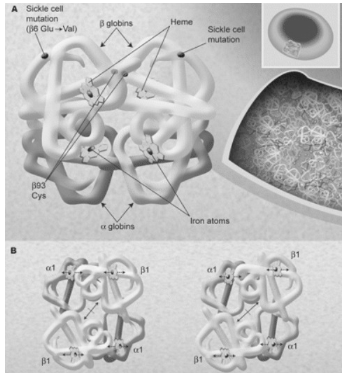 Рисунок 2 Рентгеноструктурный анализ молекулы гемоглобина, показывающий ее высокую компактность в эритроците На рисунке 2 под буквой А изображено положение β-спирали (показано в виде трубок) в каждой β-единице одна слева и одна повернута на 180°, справа показано, как 4 гемовых группы с атомами железа связывают молекулы газа. Также показано место серповидной мутации в мутантной β-глобиновой цепи и цистеин в 93 положении. Молекулы гемоглобина в эритроцитах, как показано на вставке справа, плотно упакованы (концентрация 34 г/дЛ) и мало контактируют с растворителем. Это позволяет кислороду не только эффективно перемещаться в каждой клетке, но и влиять на химический состав молекулы. Например, полимеризации гемоглобина в серповидной клетке при незначительной деоксигенации, на рисунке под буквой В показаны изменения четвертичной структуры гемоглобина в тетрамере при переходе от окси конформации (слева) к дезокси конформации (справа). Атомы железа смещены относительно плоскости групп гемма и центральная полость между β-цепями, открываясь, облегчает связи с 2.3 BPG. Молекулярный кислород (газообразный или жидкий) парамагнитное вещество, в каждой молекуле О2 имеется по 2 неспаренных электрона. Этот факт можно объяснить тем, что в молекуле на каждой из двух разрыхляющих орбиталей находится по одному неспаренному электрону. Энергия диссоциации молекулы О2 на атомы довольно высока и составляет 493,57 кДж/моль. В свободном виде встречается в виде двух модификаций О2 ("обычный" кислород) и О3(озон). О2 газ без цвета и запаха. При нормальных условиях плотность газа кислорода 1,42897 кг/м3. Температура кипения жидкого кислорода (жидкость имеет голубой цвет) равна -182,9°C. При температурах от -218,7°C до -229,4°C существует твердый кислород с кубической решеткой (-модификация), при температурах от -229,4°C до -249,3°C -модификация с гексагональной решеткой и при температурах ниже -249,3°C кубическая -модификация. При повышенном давлении и низких температурах получены и другие модификации твердого кислорода. При 20°С растворимость газа О2: 3,1 мл на 100 мл воды, 22 мл на 100 мл этанола, 23,1 мл на 100 мл ацетона. Существуют органические фторсодержащие жидкости (например, перфторбутилтетрагидрофуран), в которых растворимость кислорода значительно более высокая. Высокая прочность химической связи между атомами в молекуле О2 приводит к тому, что при комнатной температуре газообразный кислород химически малоактивен. В природе он медленно вступает в превращения при процессах гниения. Кроме того, кислород при комнатной температуре способен реагировать с гемоглобином крови (точнее с железом II гемма), что обеспечивает перенос кислорода от органов дыхания к другим органам. Реакции биологического окисления, более эффективные, чем древние энергетические процессы брожения и гликолиза, снабжают живые организмы большей частью необходимой им энергии. Исключение составляют облигатные анаэробы, например, некоторые паразиты, для которых кислород является ядом. Использование кислорода, обладающего высоким окислительно-восстановительным потенциалом, в качестве конечного акцептора электронов в цепи дыхательных ферментов, привело к возникновению биохимического механизма дыхания современного типа. Этот механизм и обеспечивает энергией аэробные организмы [5]. Наличие на Земле кислорода является одним из факторов возможности существования жизни на нашей планете. Кислород в составе воздуха через дыхательные пути попадает в легкие. Концы самых мелких бронхов в легких заканчиваются множеством тонкостенных легочных пузырьков альвеол это 500 миллионов пузырьков диаметром 0,2 мм. Здесь и происходит газообмен. Кислород из легочных пузырьков проникает в кровь, а углекислый газ из крови в легочные пузырьки. Таким образом, венозная кровь обогащается кислородом и превращается в артериальную. Кислород связывается с гемоглобином, который содержится в эритроцитах, насыщенная кислородом кровь поступает в сердце и выталкивается в большой круг кровообращения. По нему кровь разносит кислород по всем тканям организма. Поступление кислорода в ткани обеспечивает их оптимальное функционирование, при недостаточном же поступлении наблюдается процесс кислородного голодания гипоксии [6]. Переносимый кислород находится в крови в двух состояниях. Небольшая часть кислорода находится в растворенном состоянии в плазме. Коэффициент растворимости кислорода в крови невелик и составляет (при температуре 37°С и парциальном давлении кислорода 100 мм ртутного столба) 0,3 об.%. Это значит, что каждые 100 мл нормальной крови могут переносить в растворенном состоянии лишь 0,3 мл кислорода, что явно недостаточно для поддержания жизнедеятельности организма человека. В процессе эволюции был выработан принципиально другой механизм переноса кислорода кровью. Этот механизм связан с наличием в крови специального сложного белка (хромопротеида), способного обратимо присоединять молекулярный кислород. В организме человека и высших животных таким хромопротеидом является гемоглобин, содержащийся в эритроцитах. Гемоглобин присоединяет кислород в среде с высоким парциальным давлением кислорода и отдает кислород в среду с низким парциальным давлением. Каждый грамм гемоглобина в нормальных условиях может присоединять 1,34 мл кислорода. Поскольку нормальное содержание гемоглобина в крови составляет 145-170 г/л, то 100 мл крови могут переносить в связанном с гемоглобином состоянии 19-21 мл кислорода [7]. В данной работе проводилось, в частности, воздействие лазерным излучением на пористую среду (с гемоглобином) с высаженными на нем молекулами красителя (люминесцентной метки). В работе [8] исследована кинетика замедленной флуоресценции, вызванной аннигиляцией триплетных возбужденных центров с мигрирующими 1Δg-возбуждениями молекулярного кислорода. Нелинейное тушение возбужденных электронных триплетных (Т) состояний молекул красителей, внедренных в кислородосодержащие матрицы, возникает в результате реакции аннигиляции Ти 1Δg(О2)-возбуждений [9]. Временнáя зависимость концентрации Т-центров nT(t|n0) для различных начальных плотностей n0 этих частиц различна, и это легко обнаруживается при изменении накачки системы. Экспериментально измеряемые величины, являющиеся функциями или функционалами от nT, сохраняют чувствительность к вариациям n0. В работах [10] и [11] подчеркивалась нетипичная форма временнóй зависимости интенсивности замедленной флуоресценции (ЗФ) IDF(t) ряда красителей, сопровождающей Т 1Δg-слияние (кумуляцию энергии). Кроме того, было установлено, что горбообразный характер кинетической кривой свечения связан с сенсибилизированным заселением 1Δg состояний в реакции В начальный момент времени концентрация 1Δg -возбуждений nΔ равна нулю, а сигнал ЗФ нарастает в течение некоторого времени tm. В [12] показано, что временные законы nT(t) и nΔ(t) формируются как суперпозиции локальных кинетик, получивших специфическое развитие в пространственных областях с различной плотностью n0. В то же время в [13], установлена возможность мгновенного (10 нс << τt, τΔ, где τt, τΔ времена жизни Т-состояния красителя и 1Δg-состояния молекул О2 соответственно) однородного измерения концентрации nT с помощью дополнительного лазерного импульса в произвольный момент времени t0 в результате лазероиндуцированной необратимой цепочки переходов Т1 → Тm ↝Sn. |
