Называют популяцию, представляющую собой потомство одной или нескольких клеток одного вида микроорганизма
 Скачать 123.26 Kb. Скачать 123.26 Kb.
|
|
Чистая культура Чистой называют популяцию, представляющую собой потомство одной или нескольких клеток одного вида микроорганизма. Для изучения морфологических, физиологических и биохимических свойств микроорганизмов необходимо выделить чистую культуру. Поэтому выделение и сохранение чистых культур является первоочередной работой микробиологов, а это тесно связано, прежде всего, с применением основного метода в микробиологии – культивирования микроорганизмов. Культивирование Культивированием называют выращивание микроорганизмов на питательных средах в определенных условиях, а развивающийся при этом организм — культурой. Культивирование при определенной температуре называется инкубированием (или инкубацией). В процессе культивирования происходят рост и размножение культуры. Строго говоря, рост — это физиологический процесс, в ходе которого увеличиваются размеры и масса одной популяции. После размножения увеличивается число особей. Однако обычно под ростом культуры подразумевают не только рост одной клетки, но и общее увеличение числа клеток — биомассы — в результате размножения, т. е. рост культуры микроорганизмов. Культурная жидкость Сочетание питательной среды и растущих в ней микроорганизмов называют культуральной жидкостью. Методы культивирования Культивировать микроорганизмы можно поверхностным или глубинным, периодическим или непрерывным методами, в аэробных или анаэробных условиях. Большое значение при выборе способа культивирования имеют отношение выбранного для культивирования микроорганизма к молекулярному кислороду и конечная цель культивирования: накопление биомассы или получение определенного метаболита (спирт, кислород, фермент и др.). Микроорганизмы выращивают на поверхности плотной, сыпучей или в тонком слое жидкой среды, при этом микроорганизмы получают кислород непосредственно из воздуха. При поверхностном культивировании стараются увеличить площадь соприкосновения среды с воздухом. В жидких средах аэробные микроорганизмы часто растут, образуя на поверхности пленку. Факультативные анаэробы развиваются не только на поверхности, но и в толще жидкой среды, вызывая более или менее равномерное ее помутнение. На сыпучих средах поверхностным методом получают ферментные препараты. Поверхностное культивирование микроорганизмов применяется как в лабораторных условиях, так и в промышленности. Все способы культивирования аэробных микроорганизмов сводятся к увеличению поверхности соприкосновения питательной среды с кислородом воздуха. При глубинном культивировании в жидких средах микроорганизмы используют растворенный кислород. Вместе с тем растворимость кислорода в воде невелика, поэтому, чтобы обеспечить рост аэробных микроорганизмов в толще среды, ее необходимо постоянно аэрировать (подводить кислород вглубь жидкой среды). Сочетание питательной среды и растущих в ней микроорганизмов называют культуральной жидкостью. Наиболее широко распространенный в лабораторной практике способ глубинного культивирования — выращивание на качалках, обеспечивающих встряхивание или вращение колб или пробирок. Преимущества глубинного культивирования заключаются в отсутствие больших площадей и громоздкого оборудования (объем ферментеров можно увеличить за счет увеличения высоты), в простоте обслуживания, возможности автоматизации, удобстве выделения целевого продукта из культуральной жидкости. Глубинное культивирование микроорганизмов может быть периодическим и непрерывным. При периодическом методе культивирования весь объем питательной среды засевают чистой культурой и выращивание ведут в оптимальных условиях в течение определенного периода до накопления нужного количества целевого продукта. Поскольку культивирование ведется на невозобновляемой питательной среде (в стационарных условиях), клетки все время находятся в меняющихся условиях. 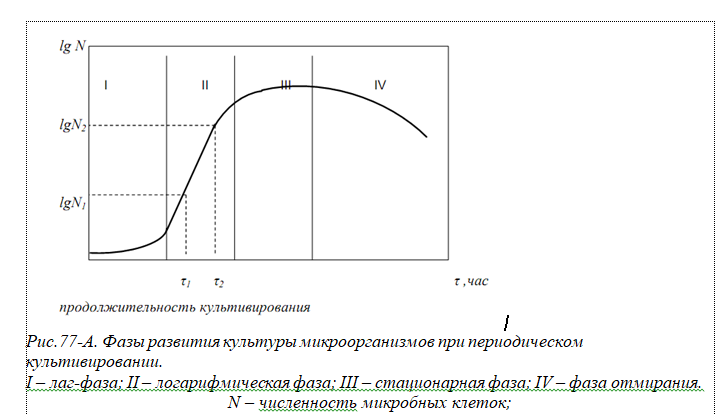 Первая стадия — лаг-фаза (латентная), или фаза задержки роста, следует непосредственно за внесением посевного материала в питательную среду. В этой фазе микроорганизмы не размножаются, а приспосабливаются к среде, происходит повышение содержания нуклеиновых кислот, увеличение размера клеток. Эта стадия служит подготовкой к дальнейшему интенсивному синтезу белка клеткой, т. е. ее росту и размножению. Вторая стадия — фаза логарифмического роста (экспоненциальная) характеризуется высокой скоростью размножения клеток, так как в среде много питательных веществ и мало вредных продуктов обмена. Время, необходимое для удвоения числа клеток, называется продолжительностью генерации. В благоприятных условиях клетки бактерий делятся каждые 20 — 30 мин, их число увеличивается в геометрической прогрессии (1, 2, 4, 8, 16 и т. д.). Третья стадия — стационарная фаза (фаза зрелости), когда размножение микроорганизмов замедляется и скорости размножения и отмирания уравновешиваются, в результате чего число клеток остается постоянным. Четвертая стадия — фаза отмирания, когда начинается гибель клеток и их количество уменьшается за счет отмирания и автолиза (самопереваривания). Периодическое культивирование осуществляется во многих производствах, основанных на жизнедеятельности микроорганизмов. Его недостатком являются нерациональные затраты времени на прохождение всех четырех стадий развития культуры, причем период самой активной жизнедеятельности — фаза логарифмического роста — занимает небольшую часть производственного цикла. более прогрессивный метод непрерывного культивирования микроорганизмов. Он состоит в том, что культура находится в специальном аппарате, куда постоянно притекает свежая питательная среда и с той же скоростью отводится культуральная жидкость. Посевной материал выращивают до стадии логарифмического роста и вносят в питательную среду. Продолжительность периода логарифмического роста зависит от количества питательных веществ в среде, а также от количества вредных продуктов обмена, выделяемых клеткой. 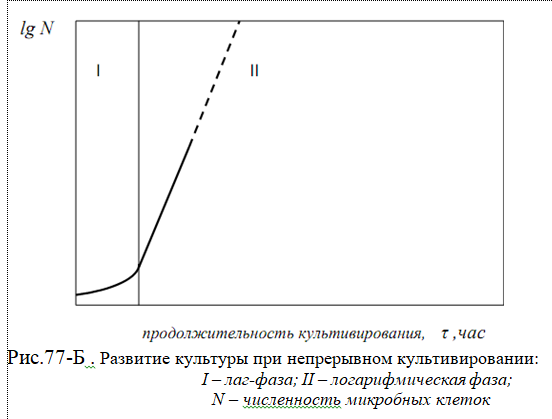 Питательные среды Питательные среды различают в основном по составу, назначению и физическому состоянию. По составу принято выделять естественные (натуральные) среды неопределенного состава и синтетические среды. Естественные (натуральные) среды состоят из продуктов животного или растительного происхождения. К ним относятся овощные или фруктовые соки, животные ткани, молоко, отвары или экстракты, полученные из природных субстратов, и др. Синтетические среды — это среды, в которые входят лишь соединения определенного химического состава, взятые в точно указанных количествах. Их широко используют при исследовании обмена веществ, физиологии и биохимии микроорганизмов. Наряду с натуральными и синтетическими средами выделяют так называемые полусинтетические среды. Их главными компонентами являются соединения известного химического состава: углеводы, соли аммония, фосфаты и др. Однако в их состав всегда включаются вещества неопределенного состава, такие, как дрожжевой автолизат, почвенный экстракт или гидролизат казеина. Эти среды находят широкое применение в промышленной микробиологии для получения аминокислот, витаминов, антибиотиков и других важных продуктов жизнедеятельности микроорганизмов. По назначению различают элективные и дифференциально-диагностические (индикаторные) среды. Элективные среды предназначены для выделения микроорганизмов из мест их естественного обитания. Они обеспечивают преимущественное развитие определенной группы микроорганизмов, для которой характерна общность физиологических свойств. Дифференциально-диагностические среды (индикаторные) дают возможность быстро отличить одни виды микроорганизмов от других или выявить некоторые их особенности. По физическому состоянию различают жидкие, сыпучие и плотные среды. Жидкие среды широко применяют для выяснения физиологобиохимических особенностей микроорганизмов, для накопления биомассы или продуктов обмена, а также поддержания и хранения многих микроорганизмов, плохо развивающихся на плотных средах. Сыпучие среды пригодны главным образом в промышленной микробиологии для культивирования некоторых продуцентов физиологически активных соединений, а также в коллекциях для сохранения культур микроорганизмов. К таким средам относятся, например, разваренное пшено, отруби и др. Плотные среды используют для выделения чистых культур, в диагностических целях для описания колоний, для определения количества микроорганизмов, их антибиотической активности, для хранения культур в коллекции и в ряде других случаев. С целью уплотнения сред применяют агар или желатин. Плотной основой могут служить пластинки силикагеля, которые пропитывают питательной средой. Хранение культур Хранение микроорганизмов осуществляется в специальных коллекциях типовых культур. периодическими пересевами; Жизнеспособность микроорганизмов после различных сроков хранения определяют путем высева на богатые питательные среды с последующим подсчетом выросших колоний. в условиях низких и ультранизких температур; Общепринято для хранения при низких температурах густые суспензии микроорганизмов в криозащитной среде, предохраняющей их от возможных повреждений, разливать в стеклянные или пластиковые ампулы или пробирки (флаконы) с завинчивающимися пробками. Замораживание дрожжей проводят при разных режимах и с различными скоростями охлаждения. лиофилизацией; Особое значение в последние десятилетия приобрел метод лиофилизации (freese-drying), заключающийся в высушивании клеток из замороженного состояния под вакуумом, минуя жидкую фазу (по типу сублимации). высушиванием; Высушивание – простейший метод хранения микроорганизмов. При высушивании клетки теряют свободную влагу, и рост микроорганизмов прекращается при остаточной массовой доле влаги 10…12%. При снижении массовой доли влаги до 2…5% сохраняется прочно связанная с клеточными структурами вода, которая строго локализована. В высушенных таким образом клетках биохимические реакции приостанавливаются, а отдельные реакции будут протекать очень медленно. под минеральным маслом. Метод применяется для сохранения крупных коллекций и в условиях микробиологических лабораторий. Он отличается простотой, не требует специальной аппаратуры и обеспечивает относительно длительное сохранение жизнеспособности и стабильности признаков большинства микроорганизмов различных систематических групп. Иммобилизованные клетки микроорганизмов применение иммобилизованных (закрепленных) микроорганизмов. Преимуществом использования иммобилизованных микроорганизмов является упрощение процесса подготовки посевного материала микроорганизмов в биотехнологическом процессе, при этом их биологическая активность сохраняется гораздо дольше, чем у интактных клеток. Иммобилизованные тем или иным способом клетки микроорганизмов можно использовать для получения биологически активных веществ и в пищевых производствах в течение нескольких месяцев или даже лет при соблюдении определенных санитарно-микробиологических мероприятий. Иммобилизованные микроорганизмы имеют ряд преимуществ по сравнению с иммобилизованными ферментами: отсутствие затрат на выделение и очистку ферментов и продуктов реакции, более высокая стабильность, возможность создания непрерывных и полунепрерывных автоматизированных процессов, способность к длительному функционированию полиферментных систем клеток микроорганизмов. три основные группы: механические, физические и химические. Практическое значение для отраслей промышленности, где применяют брожение, имеют следующие методы иммобилизации (рис. 78): адсорбция/адгезия микроорганизмов на поверхности носителей (древесная стружка, пористая керамика, кольца Рашига, растительные волокна, силикатные минералы, соединения титана, стекловолокно и др.); включение в гели (носитель: альгинат кальция, карраген, агароза, хитозан, пектин, желатин, полиакриламид и др.); ковалентное связывание; мембранное удерживание микроорганизмов (носитель: клетчатка, диатомит, двухфазные эмульсии, мембраны различного происхождения). Наибольший практический интерес представляет простой и относительно дешевый метод иммобилизации клеток — адсорбция, при которой происходит физическое взаимодействие микроорганизмов и носителя (сорбента). В качестве адсорбентов используют самые различные материалы, природные и синтетические, например керамику, уголь, песок, дробленые раковины, металлическую крошку, капрон, полиуретан. Ковалентное и поперечное связываниемикроорганизмов к носителям начали применять позднее других методов иммобилизации вследствие токсичности используемых реагентов, например, глутарового и других альдегидов, цианурхлорида и др. Метод основан на образовании ковалентных связей молекул белков и других соединений клеточной стенки микроорганизмов с активированными бифункциональными реагентами носителями. Включение в гели — в настоящее время этот метод иммобилизации имеет наибольшее применение. Метод отличается достаточной прочностью фиксации клеток. Микробная клетка заключается в полимерную сетку, в ячейки которой проникают молекулы субстрата. Чаще всего в качестве носителей применяют природные полимеры полисахаридного происхождения с карбоксильной группой (альгинат, каррагенан, агар, желатин, различные пектины) или с аминогруппой (хитозан), а также синтетические (полиакриламидный гель, фоточувствительные полимеры, полиуретаны, поливиниловый спирт и др.). В зависимости от их механических свойств и характера проводимого процесса полимеры могут использоваться в различной форме: гранул, мембран, волокон. Перед выделением чистой культуры получают накопительную культуру, в которой преобладают представители одного вида микроорганизмов, с этой целью создают элективные условия, обеспечивающие преимущественное развитие выделяемых микроорганизмов. Эти условия можно создать, используя элективные среды. О получении накопительной культуры судят визуально: по появлению характерных признаков развития выделяемых микроорганизмов. 7. Выделение ЧК из отдельной колонии. При выделении чистых культур аэробных микроорганизмов накопительную культуру высевают из её разведений в стерильной водопроводной среде на поверхности плотной среды. Разведения осуществляют с таким расчётом, чтобы при посеве из последних разведений получить на поверхности среды изолированный колонии. Нанесенную на поверхность каплю равномерно распределяют стерильным шпателем Дригальского, последовательно на нескольких чашах со стерильной питательной средой. Обычно на последних чашках образуются изолированные друг от друга колонии. Накопительную культуру можно рассеивать и методом истощающего штриха на поверхность плотной среды, используя микробиологическую петлю. Микробиологической петлёй отбирают культуру из разведения и затем последовательно поводят зигзагообразную линию по поверхности нескольких чашек Петри со стерильной питательной средой. После посева чашки помещают в термостат крышками вниз, чтобы конденсационная вода, образовавшаяся на крышке чашки Петри при застывании агара, не помешала получению изолированных колоний. Чашки инкубируются в термостате в течение 1-7 суток в зависимости от скорости роста микроорганизмов. Чашки необходимо просматривать ежедневно. Выросшие изолированные колонии отсеивают петлёй в пробирки на поверхность скошенной плотной среды или в жидкую среду. Изолированные колонии микроорганизмов, являющиеся факультативными анаэробами, чаще всего получают методом глубинного посева. Готовят разведения с таким расчётом, чтобы получить изолированные колонии при высеве глубинным способом (перемешав расплавленную и охлаждённую среду с приготовленным разведением). После застывания среды чашку Петри помещают в термостат. При высеве глубинным способом часть колоний оказывается в толще среды. Такие колонии вырезают стерильным скальпелем, стерильными капиллярными трубками, или просто петлёй и переносят в жидкую среду, благоприятную для развития выделяемых форм. Выделение чистой культуры анаэробных микроорганизмов по методу Коха требует создания условий, ограничивающих к культуре доступ кислорода. Разведение накопительной культуры и посев в пробирки с плотной питательной средой проводят так же, как и при глубинном посеве. Иногда бывает достаточно одного посева в плотную питательную среду, чтобы получить чистую культуру. Однако чаще посев в плотную питательную среду повторяют два-три раза. В качестве посевного материала используют культуру, полученную из отдельной колонии. 8. Выделение ЧК из одной клетки. Чистую культуру из одной клетки производят капельным методом, с помощью микроманипулятора или с помощью микроселектора. Капельный метод Линднера использую при работе с дрожжами и мицелиальными грибами. Накопительную культуру разводят таким образом, чтобы в небольшой капельке разведения были единичные клетки микроорганизмов. Затем готовят несколько препаратов «висячая капля». Препараты микроскопируют и отмечают те из них, в которых обнаруживается только одна клетка. Выбранный препарат помещают в чашку Петри с увлажнённой фильтровальной бумагой и ставят в термостат. Через 12-24 ч капли вновь микроскопируют. Тек капли, в которых произошло размножение клетки, осторожно снимают кусочками стерильной фильтровальной бумаги и переносят в пробирки со стерильной жидкой средой. 9. Определение чистоты выделенной культуры. После проведения процедуры выделения чистой культуры, необходимо про- верить ее чистоту. Проверяют чистоту несколькими методами: визуально, микроскопическим контролем и высевом на питательные среды. При визуальном контроле роста культуры на поверхности плотной питательной среды культура считается чистой, если рост по штриху однородный. Чистоту культур микроорганизмов обязательно контролируют под микроскопом, просматривая препараты живых или фиксированных окрашенных клеток. Чистая культура, как правило, морфологически однородная, возможно незначительное варьирование размеров клеток. Кроме того, чистоту культуры микроорганизмов проверяют высевом на питательные среды благоприятные для их роста. Однородность выросших колоний служит свидетельством чистоты культуры. 10. Обязательным условием работы с микроорганизмами является правильное их поддержание, чтобы сохранить не только жиз- недеятельность клеток, но и таксономические, физиологические свойства, присущие данной культуре. Проблема длительного хранения микроорганизмов сводится к созданию условий, способствующих торможению процессов обмена веществ. Общего метода, одинаково пригодного для разнообразных групп микроорганизмов, пока не существует. Хранение микроорганизмов осуществляют в специальных кол- лекциях типовых культур. В крупных коллекциях имеются банки данных бактерий, мицелиальных грибов, дрожжей, вирусов и др. В общей сложности в разных странах насчитывается свыше 500 коллекций. В коллекциях жизнеспособность микроорганизмов поддерживается преимущественно следующими методами: • периодическими пересевами; • в условиях низких и ультранизких температур; • лиофилизацией; • высушиванием; • под минеральным маслом. Периодические пересевы культур. Жизнеспособность микроорганизмов после хранения в течение различных сроков определяют путем высева на богатые питательные среды с последующим подсчетом выросших колоний. Определяют процент выживаемости по отношению числа сохранившихся клеток к первоначальному числу жизнеспособны до начала хранения), принятого за 100%. Обычно культуры поддерживают, пересевая их на плотные или жидкие питательные среды в нескольких поверхностях . Одна про- бирка, которую после засева не открывают, служит контрольной. Из других пробирок по мере необходимости делают отсевы. Между пересевами микроорганизмы хранят в специально предназначенном для этого помещении при температуре 4–20 °C (в зависимости от вида микроорганизма). Хранение микроорганизмов при низких и ультранизких температурах. Для хранения при низких температурах густые суспензии микроорганизмов в криозащитной среде, предохраняющей их от возможных повреждений, разливают в стеклянные или пластиковые ампулы или пробирки (флаконы) с завинчивающимися пробками. Замораживание дрожжей проводят при разных режимах и с раз- личными скоростями охлаждения. Лиофилизация Особое значение в последние десятилетия при- обрел метод лиофилизации (freese-drying), заключающийся в высушивании клеток из замороженного состояния под вакуумом, минуя жидкую фазу (по типу сублимации). Хранение микроорганизмов в высушенном состоянии. Высушивание — это простейший метод хранения микроорганизмов. При высушивании клетки теряют свободную влагу, и рост микроорганизмов прекращается при остаточной массовой доле влаги 10–12%. Хранение культур под минеральным маслом. Метод применяют для сохранения крупных коллекций и в условиях микробиологических лабораторий. Принцип метода заключается в следующем. Культуру микро- организма выращивают на благоприятной питательной среде и заливают стерильным вазелиновым маслом. Слой масла (0,5–1,0 см) замедляет скорость обменных процессов (reduced metabolism) микроорганизмов и предохраняет поверхность среды от высыхания. 11. Метод лиофилизации как метод хранения ЧК в коллекциях. метод лиофилизации (freese-drying), заключается в высушивании клеток из замороженного состояния под вакуумом, минуя жидкую фазу (по типу сублимации). Дрожжи, подлежащие лиофилизации, выращивают в оптимальных условиях на средах, не слишком обогащенных питательными веществами. Для этой цели пригодны среда Сабуро или глюкозопептонная среда, а также сусловый агар. Из культур возрастом 2–5 сут. готовят густую суспензию в специальных суспензионных жидкостях, содержащих защитные вещества, которые можно разделить на три группы: • коллоидные среды животного, растительного и минерального происхождения (сыворотка крови, плазма, желатин, снятое молоко, агар-агар, гель, гидрат оксида алюминия и др.; • среды с углеводами (чаще всего 10% раствор сахарозы) и продуктами гидролиза белков — пептоном и аминокислотами; • сложные среды, в состав которых входят вещества, образующие как коллоидные, так и истинные растворы Лиофилизированные клетки лучше сохраняются под вакуумом в атмосфере инертного газа (аргон, неон, гелий, криптон), чем на воздухе. Кислород оказывает токсическое действие, которое связано с образованием свободных радикалов и (или) с повреждением клеточной стенки и цитоплазматической мембраны. Лиофилизированные культуры желательно хранить при температуре 4-6˚С Лиофилизированные клетки необходимо хранить в темноте. Хранение на свету резко снижает их выживаемость. Большое значение придается процессу реактивации, т.е. выведению лиофилизированных клеток из состояния анабиоза. Условия, снижающие осмотический шок и стресс, возникающий при вскрытии ампул, увеличивают процент выживших клеток. Хорошие результаты получены при медленном добавлении водопроводной воды к сухим клеткам. В качестве регидратантов применяют также различные богатые питательные среды. Лиофилизированные клетки имеют удлиненную латентную фазу (фазу адаптации) роста 12. Хранение микроорганизмов в высушенном состоянии. Способы высушивания. Понятие Регидратации и реактивации. В небольших лабораториях применяют воздушное высушивание микроорганизмов на различных адсорбентах: в стерильной почве, песке, глине, силикагеле, на пшене, фильтровальной бумаге, вате, стеклянных и фарфоровых бусах, тканях, пластмассах, карбонате кальция, крахмале, кристаллах сахарозы и др. Предполагается, что адсорбенты защищают микроорганизмы от сильного высыхания, связывают свободную воду и поддерживают массовую долю влаги на определенном уровне. Существуют микроорганизмы, не выдерживающие процесса лиофилизации. Они переносят высушивание под вакуумом на сухих таблетках пептона, крахмала, декстрана, а также на бумажных, целлофановых или желатиновых дисках. В производственной практике широко применяют методы контактной (с адсорбентом) и конвективной (в сухом воздухе) сушки для хранения хлебопекарных и кормовых дрожжей, заквасок молочнокислых бактерий и др. Большое значение имеет процесс реактивации микроорганизмов из высушенного состояния, который включает следующие процессы: · - регидратацию (увлажнение клеток); · - репарацию (ликвидацию повреждений клеточных структур); · - восстановление численности популяции путем размножения жизнеспособных клеток. 13. Разведение чистой культуры на предприятии. Разведение чистой культуры на предприятии осуществляют путем посева микроорганизмов из коллекционной культуры в стерильную питательную среду, заключающегося в последовательных пересевах в постепенно возрастающие объемы питательной среды для накопления биомассы клеток. Процесс разведения состоит из двух стадий: лабораторной (разведение чистой культуры в микробиологической лаборатории) и производственной (разведение в отделении в специальных аппаратах для разведения чистой культуры). После производственной стадии разведения получают технически чистые культуры в количестве, достаточном для засева производственных емкостей. В разных производствах технически чистые культуры называют по-разному: семенные, засевные, маточные культуры и др. Для каждого производства разработаны свои схемы разведения чистой культуры. 14. Принципы составления питательных сред для культивирования микроорганизмов. Для культивирования микроорганизмов используют питательные среды, которые должны содержать все вещества, необходимые для их роста. Для этих целей предложены сотни различных сред, состав которых определяется потребностями микроорганизмов в соединениях, необходимых для биосинтеза и получения энергии. Конструктивные и энергетические процессы у микроорганизмов крайне разнообразны, поэтому столь же разнообразны их потребности в питательных веществах. Из этого следует, что универсальных сред, одинаково пригодных для роста всех без исключения микроорганизмов, не существует. Питательные среды различают в основном по составу, назначению и физическому состоянию. По составу принято выделять естественные (натуральные) среды неопределенного состава и синтетические среды. Наряду с натуральными и синтетическими средами выделяют так называемые полусинтетические среды. Их главными компонентами являются соединения известного химического состава: углеводы, соли аммония, фосфаты и др. Однако в их состав всегда включаются вещества неопределенного состава, такие, как дрож- жевой автолизат, почвенный экстракт или гидролизат казеина. Эти среды находят широкое применение в промышленной микробиологии для получения аминокислот, витаминов, антибиотиков и других важных продуктов жизнедеятельности микроорганизмов. Состав и типы питательных сред. По агрегатному состоянию среды делят на: жидкие, плотные и сыпучие. • Жидкие среды применяются для накопления биомассы или продуктов обмена микроорганизмов, для обновления долго хранящихся культур, для поддержания и хранения тех чистых культур, которые плохо растут на плотных средах. • Плотные среды необходимы для выделения и описания культуральных свойств чистых культур микроорганизмов, так как на них можно получить изолированные колонии (колония - популяция микроорганизмов, выросших из одной клетки). Плотные питательные среды используются также для количественного учета микроорганизмов в пищевых продуктах, других объектах внешней среды и для хранения чистых культур. Плотные среды готовятся из жидких путем добавления гелеобразующих веществ: агар-агара, желатина, кремнекислого геля (силикагеля). • Сыпучие среды применяют в основном в промышленной микробиологии. К таким средам относятся разваренное пшено, отруби, кварцевый песок, смоченный питательным раствором. Такие среды используются для культивирования аэробных микроорганизмов. По происхождению и составу питательные среды делятся на натуральные( естественные), синтетические (искусственные) и полусинтетические. • Натуральные среды готовятся из продуктов животного и растительного происхождения. Они содержат все ингредиенты, необходимые для роста и развития микроорганизмов. Основным недостатком этих сред является то, что они имеют сложный и непостоянный состав. Натуральные среды используют для выращивания микроорганизмов, накопления биомассы, хранения чистых культур, но они мало пригодны для изучения обменных процессов микроорганизмов. Такими средами являются мясной бульон, автолизат дрожжей, молоко, молочная сыворотка, гидролизаты из растительного сырья и т.д. Наиболее часто применяемыми натуральными питательными средами являются мясопептонный агар (МПА) и мясопептонный бульон (МПБ), предназначенные для культивирования бактерий, а также не охмеленное пивное сусло и сусло-агар, используемые для выращивания и накопления биомассы грибов и дрожжей. • Синтетические среды имеют в своем составе химически чистые органические и неорганические соединения в строго указанных концентрациях. Такие среды применяются для исследования обмена веществ, выяснения закономерностей роста или биосинтеза какого-либо метаболита и т.д. Наиболее часто в практической работе используют синтетическую среду Чапека для выращивания. Основным недостатком синтетических сред является то, что на таких средах микроорганизмы очень долго растут. • Полусинтетические среды в своем составе содержат химически чистые органические и неорганические вещества, (как и в синтетических средах) и вещества растительного или животного происхождения в качестве факторов роста для ускорения роста и развития микроорганизмов. Цель использования полусинтетических сред та же, что и синтетических. Так как натуральные компоненты вносятся в небольших количествах, то их химический состав не учитывается при изучении обменных процессов. По назначению среды делятся на стандартные (основные), избирательные (накопительные, элективные) и дифференциально- диагностические. • Стандартные среды используются для выращивания многих видов микроорганизмов. К стандартным средам, используемым для выращивания бактерий, относятся мясопептонный агар и бульон (МПА, МПБ). Грибы и дрожжи хорошо растут на не охмеленном пивном сусле, сусло-агаре (СА). • Избирательные (элективные) среды обеспечивают развитие только определенных микроорганизмов или группы родственных видов и непригодны для роста других. В такие среды, как правило, добавляют вещества, избирательн подавляющие развитие сопутствующей микрофлоры. Избирательные среды применяют для выделения определенных микроорганизмов из мест их естественного обитания и для получения накопительных культур. В качестве накопительных питательных используют, например жидкие среды Кесслера (используется для накопления бактерий группы кишечной палочки). Элективными средой также может быть плотная питательная среда, такая как агар с гидролизованным молоком и мелом – для количественного учета молочнокислых бактерий. •Дифференциально -диагностические среды используются для определения видовой принадлежности исследуемого микроба, основываясь на особенностях его обмена веществ. Состав этих сред позволяет четко выделить наиболее характерные свойства изучаемого микроорганизма. Примером таких сред является плотная среда Эндо, применяемая для определения бактерий группы кишечной палочки, в состав которой входит Лактоза. Кишечная палочка на такой среде ферментирует лактозу с образованием альдегидов, вследствие чего бесцветная фуксин-сернистая кислота переходит в фуксин-сернистое соединение с образованием красителя фуксина, который окрашивает колонии кишечной палочки в красный цвет с металлическим блеском, а саму среду в малиновый цвет. |
