ЛР 1. Нейтрализация сточных вод. Нейтрализация сточных вод
 Скачать 25.62 Kb. Скачать 25.62 Kb.
|
|
Федеральное государственное бюджетное образовательное учреждение высшего образования Саратовский государственный технический университет имени Гагарина Ю.А. НЕЙТРАЛИЗАЦИЯ СТОЧНЫХ ВОД Методическое указание к лабораторной работе Одобрено УМКН для ведения образовательной деятельности по образовательной программе 18.03.01 Химическая технология Саратов 2021 1. ЦЕЛЬ РАБОТЫ Исследование метода нейтрализации сточных вод отходящими газами, содержащими СО2. 2. ТЕОРЕТИЧЕСКИЕ ПОЛОЖЕНИЯ Кислые и щелочные воды перед выпуском в водоем или подачей в биологические очистные сооружения должны быть нейтрализованы. Нейтрализация сточных вод достигается добавкой в сточные воды таких веществ, под влиянием которых наступает нейтрализация содержащихся в них кислот или щелочей и выделение в виде осадка других загрязнений, в основном ионов тяжелых металлов. Применяемые реагенты должны способствовать образованию легко фильтрующихся осадков. Кроме того, нейтрализация сточных вод необходима для предотвращения коррозии трубопроводов, канализационных сооружений. Применяют следующие способы нейтрализации: а) взаимную нейтрализацию кислых и щелочных сточных вод (если они имеются на данном предприятии); б) нейтрализацию реагентами; в) фильтрование через нейтрализующие материалы (известняк СаСО3 магнезит MgCО3, доломит CaCO3*7MgCO3, обожженный магнезит MgO). Кислые сточные воды травильных отделений нейтрализуются известковым молоком до рН = 8-9, вследствие чего наступает нейтрализация содержащихся в них кислот и выделение железа и других металлов в виде осадка соответствующих гидроокисей. Наименьший объем занимают осадки, полученные при нейтрализации концентрированных сточных вод травильных отделений растворами карбоната натрия, однако из-за технологических трудностей (обильное выделение СО2) этот реагент применяют редко. Осаждение выделенных осадков, содержащих гидроксид железа и образованных в процессе нейтрализации известняковым молоком, можно значительно ускорить добавками определенных соединений коагуляционного и флокуляционного действия (например, полиакриламида). В промышленной практике часто применяют перемешивание нейтрализованных сточных вод сжатым воздухом, что способствует окислению Fe(OH)2 до Fe(ОН)3 и образованию очень быстро оседающей взвеси. Для нейтрализации любых щелочей применимы серная, соляная, азотная, фосфорная и другие кислоты. Для нейтрализации щелочных сточных вод можно использовать углекислый газ. Основным преимуществом нейтрализации углекислым газом является низкая стоимость проведения процесса, так как для этой цели можно использовать СО2 дымовых газов. 3. Оборудование, РЕАКТИВЫ Посуда и реактивы: колба Вюрца, колба на 250 мл, химический стакан, бюретка, пипетка, индикаторная бумага, рН-метр, мел, соляная кислота 0,1 н раствор, фенолфталеин. 4. ПОРЯДОК ВЫПОЛНЕНИЯ И ОФОРМЛЕНИЯ РАБОТЫ Для определения начальной концентрации исследуемой щелочной воды в коническую колбу для титрования налейте аликвотный объем щелочной воды, добавьте 1 каплю фенолфталеина. Оттитруйте пробу 0,1 н раствором соляной кислоты, рассчитайте концентрацию гидроокиси в растворе по формуле: 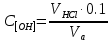 , ,где VHCl − объем 0,1н раствора HCl, израсходованного на титрование, мл; Vа − объем пробы, взятой на титрование, мл. Затем при помощи индикаторной бумаги и рН-метра определяется pH. После определения pH в химический стакан наливают 200 мл щелочной воды и барботируют СО2, где происходит реакция: 2HCl + CaCO3 → CaCl2 + H2O +CO2. Углекислый газ можно получать в колбе Вюрца, добавляя к мелу соляную кислоту в пропорции 1:4. Через 3, 5, 7, 10, 15 мин после начала обработки щелочной воды отбирают с помощью пипетки аликвотный объем исследуемой воды. Определяют pH и С[OH] титрованием раствором HCl (аналогично титрованию исходной воды). Полученные данные заносятся в таблицу. Таблица
Количество углекислого газа, поглощенного щелочным раствором, рассчитывается по уравнению: МСО2 = (С[OH]нач − C[OH]τ) * Vводы * τ где Vводы = 200 – V на титрование; τ − время. Степень нейтрализации вычисляется по уравнению: 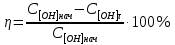 Затем строятся зависимости η = f(τ); η = f(МСО2). НЕЙТРАЛИЗАЦИЯ СТОЧНЫХ ВОД Методические указания к выполнению лабораторной работы по дисциплине «Рециклинг техногенных отходов» Составитель: ВИКУЛОВА Мария Александровна |
