курсовая работа. Неорганические лекарственные средства на основе перекиси водорода
 Скачать 83.34 Kb. Скачать 83.34 Kb.
|
|
Автономная некоммерческая организация Профессиональная образовательная организация медицинский колледж «Монада» Курсовая работа на тему: «Неорганические лекарственные средства на основе перекиси водорода» Выполнила Ашурова Элзара Студентка 1 курса ОЗФМ-2 группы Специальность Фармация Руководитель Железная Е.В. Оценка _____________________________ «____» _________________2019г.___________ (подпись) Евпатория - 2019 Отзыв на курсовую работу Студентки Ашурова Элзары 1 курса ОЗФМ-2 группы Специальность Фармация Курсовая работа на тему: «Неорганические лекарственные средства на основе перекеси водорода» Положительные стороны работы ________________________________________________________________________________________________________________________________________________________________________________________________ Перечень недостатков работы ________________________________________________________________________________________________________________________________________________________________________________________________ Оценка работы ________________________________________________________________ Руководитель ___________________________________________________ ФИО ______________________________ «____» _____________________2019 г (подпись) Содержание Введение……………………………………………………………………………. Глава 1.Производные перкеси водорода…………………………………………. 1.1.Общая характеристика препаратов водород пероксида…………………….. 1.2.Изомерия……………………………………………………………………….. 1.3. Способы получения водород пероксида…………………………………….. 1.4.Физические свойства и строение водород пероксида……………………….. 1.5 Химические свойства………………………………………………………….. Глава 2. Неорганические лекарственные средства на основе водород пероксида…………………………………………………………………………… 2.1. Магния пероксид. Magnesiiperoxydum …………………………………….... 2.2 Перекись водорода.Hydrogen peroxide ………………………………………. 2.3 Гидроперит.TabulettaeHydroperiti……………………………………………. 2.4 Натрия тиосульфат.Natrii thiosulfas Sodium thiosulfate……………………… Заключение………………………………………………………………………… Список использованных источников…………………………………………….. Введение Актуальность исследования Перекись водорода (систематическое наименование — пероксид водорода, H2O2) — это самое первое из открытых соединений подобного вида. Вещество представляет собой несимметричную молекулу, состоящую из атомов водорода и кислорода, с образованием сильных полярных связей ). Ими обусловлены основные физико-химические свойства перекиси водорода, ее реакционная способность и активность в качестве растворителя. Перекись водородасчитается одним из сильнейших окислителей, в связи с чем это вещество получило широкое распространение, как в бытовых, так и в промышленных целях. На бытовом уровне пероксид водорода используется в качестве эффективного антисептика для обработки открытых ран и других травм. Установлено, что растворы с концентрацией в 1 % способны полностью убивать большинство патогенных микроорганизмов, не угнетая активность клеток человеческого организма. Кроме того, пероксид водорода обладает способностью мягко очищать ткани от инородных включений. Весьма часто слабые растворы пероксида используются для обесцвечивания волос и пигментных пятен на коже, что может негативно сказаться на состоянии роговых покровов. Промышленная сфера применения перекиси водорода значительно шире. Благодаря высоким реакционным свойствам это вещество широко используется в качестве катализатора или восстановителя в различных реакциях, в том числе — для очистки металлов. Пероксид водорода является незаменимым компонентом большинства средств бытовой химии, а также используется в пищевой промышленности в качестве безопасного антисептика. Также это вещество нашло применение в сфере энергетики: его используют в качестве окислителя для ракетного топлива, торпед и турбин. Цель работы: изучить физические и химические свойства пероксида водорода, рассмореть неорганические лекарсивенные средства на основе пероксида водорода. Объект: растворы пероксида водорода различной концентрации Предмет: исследование неорганических лекарственных средств пероксида водорода. Глава 1 .Производные водород пероксида 1.1.Общая характеристика водород пероксида Водорода пероксид – (старое название – перекись водорода), соединение водорода и кислорода Н2О2, содержащее рекордное количество кислорода – 94% по массе. В молекулах Н2О2 содержатся пероксидные группы –О–О– , которые во многом определяют свойства этого соединения. Впервые пероксид водорода получил в 1818 французский химик Луи Жак Тенар (1777 – 1857), действуя сильно охлажденной соляной кислотой на пероксид бария: BaO2 + 2HCl BaCl2 + H2O2. Пероксид бария, в свою очередь, получали сжиганием металлического бария. Для выделения из раствора Н2О2 Тенар удалил из него образовавшийся хлорид бария: BaCl2 + Ag2SO4 2AgCl + BaSO4. Чтобы не использовать дорогую соль серебра в последующем для получения Н2О2 использовали серную кислоту: BaO2 + H2SO4 BaSO4 + H2O2, поскольку при этом сульфат бария остается в осадке. Иногда применяли другой способ: пропускали углекислый газ во взвесь ВаО2 в воде: BaO2 + H2O + CO2 BaCO3 + H2O2, поскольку карбонат бария также нерастворим. Этот способ предложил французский химик Антуан Жером Балар (1802–1876), прославившийся открытием нового химического элемента брома (1826). Применяли и более экзотические методы, например, действие электрического разряда на смесь 97% кислорода и 3% водорода при температуре жидкого воздуха (около –190° С), так был получен 87%-ный раствор Н2О2. Концентрировали Н2О2 путем осторожного упаривания очень чистых растворов на водяной бане при температуре не выше 70–75° С; так можно получить примерно 50%-ный раствор. Сильнее нагревать нельзя – происходит разложение Н2О2, поэтому отгонку воды проводили при пониженном давлении, используя сильное различие в давлении паров (и, следовательно, в температуре кипения) Н2О и Н2О2. Так, при давлении 15 мм рт.ст. сначала отгоняется в основном вода, а при 28 мм рт.ст. и температуре 69,7° С, отгоняется чистый пероксид водорода. Другой способ концентрирования – вымораживание, так как при замерзании слабых растворов лед почти не содержит Н2О2. Окончательно можно обезводить поглощением паров воды серной кислотой на холоде под стеклянным колоколом. Многие исследователи 19 в., получавшие чистый пероксид водорода, отмечали опасность этого соединения. Так, когда пытались отделить Н2О2 от воды путем экстракции из разбавленных растворов диэтиловым эфиром с последующей отгонкой летучего эфира, полученное вещество иногда без видимых причин взрывалось. В одном из таких опытов немецкий химик Ю.В.Брюль получил безводный Н2О2, который обладал запахом озона и взорвался от прикосновения неоплавленной стеклянной палочки. Несмотря на малые количества Н2О2 (всего 1–2 мл) взрыв был такой силы, что пробил круглую дыру в доске стола, разрушил содержимое его ящика, а также стоящие на столе и поблизости склянки и приборы. Водорода перекись Жифрер Международное название: Водорода пероксид (Hydrogen peroxide) Лекарственная форма: раствор (дезинфицирующий), раствор для наружного применения, раствор для наружного применения (спиртовой) Водорода перекись медицинская Международное название: Водорода пероксид (Hydrogen peroxide) Лекарственная форма: раствор [дезинфицирующий], раствор для наружного применения, раствор для наружного применения [спиртовой] Оксилизин Международное название: Водорода пероксид (Hydrogen peroxide) Лекарственная форма: раствор [дезинфицирующий], раствор для наружного применения, раствор для наружного применения [спиртовой] Паркон Международное название: Водорода пероксид (Hydrogen peroxide) Лекарственная форма: спрей назальный дозированный Пергидроль Международное название: Водорода пероксид (Hydrogen peroxide) Лекарственная форма: раствор [дезинфицирующий], раствор для наружного применения, раствор для наружного применения [спиртовой] 1.2.Изомерия Чистый пероксид водорода – вещество очень опасное, так как при некоторых условиях возможно его взрывное разложение: Н2О2 Н2О + 1/2 О2 с выделением 98 кДж на моль Н2О2 (34 г). Это очень большая энергия: она больше, чем та, которая выделяется при образовании 1 моля HCl при взрыве смеси водорода и хлора; ее достаточно, чтобы полностью испарить в 2,5 раза больше воды, чем образуется в этой реакции. Опасны и концентрированные водные растворы Н2О2, в их присутствии легко самовоспламеняются многие органические соединения, а при ударе такие смеси могут взрываться. Для хранения концентрированных растворов используют сосуды из особо чистого алюминия или парафинированные стеклянные сосуды. Чаще приходится встречаться с менее концентрированным 30%-ным раствором Н2О2, который называется пергидролем, но и такой раствор опасен: вызывает ожоги на коже (при его действии кожа сразу же белеет из-за обесцвечивания красящих веществ), при попадании примесей возможно взрывное вскипание. Разложение Н2О2 и его растворов, в том числе и взрывное, вызывают многие вещества, например, ионы тяжелых металлов, которые при этом играют роль катализатора, и даже пылинки. Взрывы Н2О2 объясняются сильной экзотермичностью реакции, цепным характером процесса и значительным снижением энергии активации разложения Н2О2 в присутствии различных веществ, о чем можно судить по следующим данным: Таблица 1.1.
Фермент каталаза содержится в крови; именно благодаря ей «вскипает» от выделения кислорода аптечная «перекись водорода», когда ее используют для дезинфекции порезанного пальца. Реакцию разложения концентрированного раствора Н2О2 под действием каталазы использует не только человек; именно эта реакция помогает жуку-бомбардиру бороться с врагами, выпуская в них горячую струю. Другой фермент – пероксидаза действует иначе: он не разлагает Н2О2, но в его присутствии происходит окисление других веществ пероксидом водорода. Ферменты, влияющие на реакции пероксида водорода, играют большую роль в жизнедеятельности клетки. Энергию организму поставляют реакции окисления с участием поступающего из легких кислорода. В этих реакциях промежуточно образуется Н2О2, который вреден для клетки, так как вызывает необратимое повреждение различных биомолекул. Каталаза и пероксидаза совместно превращают Н2О2 в воду и кислород. Реакция разложения Н2О2 часто протекает по радикально-цепному механизму, при этом роль катализатора заключается в инициировании свободных радикалов. Так, в смеси водных растворов Н2О2 и Fe2+ (так называемый реактив Фентона) идет реакция переноса электрона с иона Fe2+ на молекулу H2O2 с образованием иона Fe3+ и очень неустойчивого анион-радикала [H2O2]. –, который сразу же распадается на анион ОН– и свободный гидроксильный радикал ОН. Радикал ОН очень активен. Если в системе есть органические соединения, то возможны их разнообразные реакции с гидроксильными радикалами. Так, ароматические соединения и оксикислоты окисляются (бензол, например, превращается в фенол), непредельные соединения могут присоединить гидроксильные группы по двойной связи: СН2=СН–СН2ОН + 2ОН. НОСН2–СН(ОН)–СН2–ОН, а могут вступить в реакцию полимеризации. В отсутствие же подходящих реагентов ОН. реагирует с Н2О2 с образованием менее активного радикала НО2., который способен восстанавливать ионы Fe2+, что замыкает каталитический цикл: H2O2 + Fe2+ Fe3+ + OH. + OH– ОН. + Н2О2 H2O + HO2. HO2. + Fe3+ Fe2+ + O2 + H+ H+ + OH– H2O. При определенных условиях возможно цепное разложение Н2О2, упрощенный механизм которого можно представить схемой ОН. + Н2О2 H2O + HO2.2. + H2O2 H2O + O2 + OH. и т.д. Реакции разложения Н2О2 идут в присутствии различных металлов переменной валентности. Связанные в комплексные соединения, они часто значительно усиливают свою активность. Например, ионы меди менее активны, чем ионы железа, но связанные в аммиачные комплексы [Cu(NH3)4]2+, они вызывают быстрое разложение Н2О2. Аналогичное действие оказывают ионы Mn2+ связанные в комплексы с некоторыми органическими соединениями. В присутствии этих ионов удалось измерить длину цепи реакции. Для этого сначала измерили скорость реакции по скорости выделения из раствора кислорода. Затем в раствор ввели в очень малой концентрации (около 10–5 моль/л) ингибитор – вещество, эффективно реагирующее со свободными радикалами и обрывающее таким образом цепь. Выделение кислорода сразу же прекратилось, но примерно через 10 минут, когда весь ингибитор израсходовался, снова возобновилось с прежней скоростью. Зная скорость реакции и скорость обрыва цепей, нетрудно рассчитать длину цепи, которая оказалась равной 103 звеньев. Большая длина цепи обусловливает высокую эффективность разложения Н2О2 в присутствии наиболее эффективных катализаторов, которые с высокой скоростью генерируют свободные радикалы. При указанной длине цепи скорость разложения Н2О2 фактически увеличивается в тысячу раз. Иногда заметное разложение Н2О2 вызывают даже следы примесей, которые почти не обнаруживаются аналитически. Так, одним из самых эффективных катализаторов оказался золь металлического осмия: сильное каталитическое действие его наблюдалось даже при разведении 1:109, т.е. 1 г Os на 1000 т воды. Активными катализаторами являются коллоидные растворы палладия, платины, иридия, золота, серебра, а также твердые оксиды некоторых металлов – MnO2, Co2O3, PbO2 и др., которые сами при этом не изменяются. Разложение может идти очень бурно. Так, если маленькую щепотку MnO2 бросить в пробирку с 30%-ным раствором Н2О2, из пробирки вырывается столб пара с брызгами жидкости. С более концентрированными растворами происходит взрыв. Более спокойно протекает разложение на поверхности платины. При этом на скорость реакции сильное влияние оказывает состояние поверхности. Немецкий химик Вальтер Шпринг провел в конце 19 в. такой опыт. В тщательно очищенной и отполированной платиновой чашке реакция разложения 38%-ного раствора Н2О2 не шла даже при нагревании до 60° С. Если же сделать иглой на дне чашки еле заметную царапину, то уже холодный (при 12° С) раствор начинает выделять на месте царапины пузырьки кислорода, а при нагревании разложение вдоль этого места заметно усиливается. Если же в такой раствор ввести губчатую платину, обладающую очень большой поверхностью, то возможно взрывное разложение. Быстрое разложение Н2О2 можно использовать для эффектного лекционного опыта, если до внесения катализатора добавить к раствору поверхностно-активное вещество (мыло, шампунь). Выделяющийся кислород создает обильную белую пену, которую назвали «зубной пастой для слона». Некоторые катализаторы инициируют нецепное разложение Н2О2, например: H2O2 + 2I– + 2H+ 2H2O + I2 I2 + H2O2 2I– + 2H+ + O2. Нецепная реакция идет и в случае окисления ионов Fe2+ в кислых растворах: 2FeSO4 + H2O2 + H2SO4 Fe2(SO4)3 + 2H2O. Поскольку в водных растворах почти всегда есть следы различных катализаторов (катализировать разложение могут и ионы металлов, содержащихся в стекле), к растворам Н2О2, даже разбавленным, при их длительном хранении добавляют ингибиторы и стабилизаторы, связывающие ионы металлов. При этом растворы слегка подкисляют, так как при действии чистой воды на стекло получается слабощелочной раствор, что способствует разложению Н2О2. Все эти особенности разложения Н2О2 позволяют разрешить противоречие. Для получения чистого Н2О2 необходимо проводить перегонку при пониженном давлении, поскольку вещество разлагается при нагревании выше 70° С и даже, хотя очень медленно, при комнатной температуре. В таком случае, как же получена фигурирующая в той же энциклопедии температура кипения при атмосферном давлении, равная 150,2° С? Обычно в таких случаях используют физико-химическую закономерность: логарифм давления пара жидкости линейно зависит от обратной температуры (по шкале Кельвина), поэтому если точно измерить давление пара Н2О2 при нескольких (невысоких) температурах, то легко можно рассчитать, при какой температуре это давление достигнет 760 мм рт.ст. А это и есть температура кипения при обычных условиях. Теоретически радикалы ОН. могут образоваться и в отсутствие инициаторов, в результате разрыва более слабой связи О–О, но для этого нужна довольно высокая температура. Несмотря на относительно небольшую энергию разрыва этой связи в молекуле Н2О2 (она равна 214 кДж/моль, что в 2,3 раза меньше, чем для связи Н–ОН в молекуле воды), связь О–О все же достаточно прочная, чтобы пероксид водорода был абсолютно устойчив при комнатной температуре. И даже при температуре кипения (150° С) он должен разлагаться очень медленно. Расчет показывает, что при этой температуре разложение на 0,5% должно происходить тоже достаточно медленно, даже если длина цепи равна 1000 звеньев. Несоответствие расчетов и опытных данных объясняется каталитическим разложением, вызванным и мельчайшими примесями в жидкости и стенками реакционного сосуда. Поэтому измеренная многими авторами энергия активации разложения Н2О2 всегда значительно меньше, чем 214 кДж/моль даже «в отсутствие катализатора». На самом деле катализатор разложения всегда есть – и в виде ничтожных примесей в растворе, и в виде стенок сосуда, именно поэтому нагревание безводного Н2О2 до кипения при атмосферном давлении неоднократно вызывало взрывы. В некоторых условиях разложение Н2О2 происходит очень необычно, например, если нагреть подкисленный серной кислотой раствор Н2О2 в присутствии иодата калия KIO3, то при определенных концентрациях реагентов наблюдается колебательная реакция, при этом выделение кислорода периодически прекращается, а потом возобновляется с периодом от 40 до 800 секунд. 1.3. Способы получения водород пероксида На сегодняшний день пероксид водорода получают на основе реакции с антрахиноном. Концентрация получаемого раствора варьирует в пределах от 20 до 40%. При необходимости концентрацию можно увеличить до 50-70% с помощью вакуумного дистиллятора. В вакуумном дистилляторе создается пониженное давление, в результате чего вода испаряется при температуре ниже 100 °С, в то время как пероксид водорода, температура кипения которого при нормальных условиях составляет 155 °С, остается в растворе. Конечный продукт хранится и транспортируется в цистернах, изготовленных из нержавеющей стали или из алюминия. За счет добавления стабилизатора в раствор пероксида водорода мы имеем возможность значительно продлять срок его хранения, удается добиться того, чтобы за месяц распаду подвергалось менее 0,1 % вещества. Подобную защиту обеспечивают такие вещества, как станнат натрия и различные фосфаты, которые связывают все металлы, находящиеся в растворе, и не дают им катализировать разложение перекиси. Ежегодно во всем мире производится более миллиона тонн пероксида водорода. Около 30% от этого количества идет на отбеливание бумаги и около 20% на отбеливание текстиля, примерно из такого же количества вещества получают твердые пероксиды. Оставшиеся 30% используются самыми различными способами: в качестве химического реагента; в качестве дезинфектанта для очистки и дезодорации загрязненной воды; для получения металлов из руд, к примеру, при экстракции и очистке урана; для создания стиральных и моющих средств. Пероксид водорода также используется в производстве хлорфенола. Пероксид водорода находит широкое применение, а его мировое производство исчисляется сотнями тысяч тонн в год. Его используют для получения неорганических пероксидов, как окислитель ракетных топлив, в органических синтезах, для отбеливания масел, жиров, тканей, бумаги, для очистки полупроводниковых материалов, для извлечения из руд ценных металлов (например, урана путем перевода его нерастворимой формы в растворимую), для обезвреживания сточных вод. В медицине растворы Н2О2 применяют для полоскания и смазывания при воспалительных заболеваниях слизистых оболочек (стоматиты, ангина), для лечения гнойных ран. В пеналах для хранения контактных линз в крышку иногда помещают очень небольшое количество платинового катализатора. Линзы для их дезинфекции заливают в пенале 3%-ным раствором Н2О2, но так как этот раствор вреден для глаз, пенал через некоторое время переворачивают. При этом катализатор в крышке быстро разлагает Н2О2 на чистую воду и кислород. Когда-то модно было обесцвечивать волосы «перекисью», сейчас для окраски волос существуют более безопасные составы. В присутствии некоторых солей пероксид водорода образует как бы твердый «концентрат», который удобнее перевозить и использовать. Так, если к сильно охлажденному насыщенному раствору борнокислого натрия (буры) добавить Н2О2 в присутствии, постепенно образуются большие прозрачные кристаллы пероксобората натрия Na2[(BO2)2(OH)4]. Это вещество широко используется для отбеливания тканей и как компонент моющих средств. Молекулы Н2О2, как и молекулы воды, способны внедряться в кристаллическую структуру солей, образуя подобие кристаллогидратов – пероксогидраты, например, К2СО3·3Н2О2, Na2CO3·1,5H2O; последнее соединение широко известное под названием «персоль». Так называемый «гидроперит» CO(NH2)2·H2O2 представляет собой клатрат – соединение включения молекул Н2О2 в пустоты кристаллической решетки мочевины. В аналитической химии с помощью пероксида водорода можно определять некоторые металлы. Например, если к раствору соли титана(IV) – сульфата титанила добавить пероксид водорода, раствор приобретает ярко-оранжевый цвет вследствие образования надтитановой кислоты: TiOSO4 + H2SO4 + H2O2 H2[TiO2(SO4)2] + H2O. Бесцветный молибдат-ион MoO42– окисляется Н2О2 в интенсивно окрашенный в оранжевый цвет пероксидный анион. Подкисленный раствор дихромата калия в присутствии Н2О2 образует надхромовую кислоту: K2Cr2O7 + H2SO4 + 5H2O2 H2Cr2O12 + K2SO4 + 5H2O, которая довольно быстро разлагается: H2Cr2O12 + 3H2SO4 Cr2(SO4)3 + 4H2O + 4O2. Если сложить эти два уравнения, получится реакция восстановления пероксидом водорода дихромата калия: K2Cr2O7 + 4H2SO4 + 5H2O2 Cr2(SO4)3 + K2SO4 + 9H2O + 4O2. Надхромовую кислоту можно извлечь из водного раствора эфиром (в растворе эфира она значительно более устойчива, чем в воде). Эфирный слой при этом окрашивается в интенсивный синий цвет. 1.4.Физические свойства и строение молкулы водород пероксида 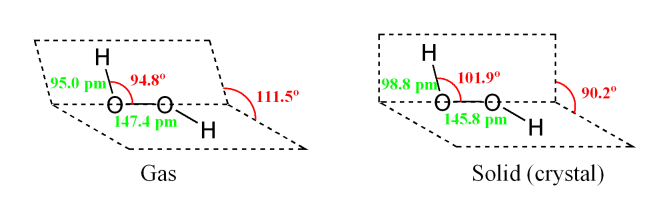 Рис.1.1.Строение молкулы водород пероксида Чистый пероксид водорода очень сильно отличается от знакомого всем 3%-ного раствора Н2О2, который стоит в домашней аптечке. Прежде всего, он почти в полтора раза тяжелее воды (плотность при 20° С равна 1,45 г/см3). Замерзает Н2О2 при температурой немного меньшей, чем температура замерзания воды – при минус 0,41° С, но если быстро охладить чистую жидкость, она обычно не замерзает, а переохлаждается, превращаясь в прозрачную стеклообразную массу. Растворы Н2О2 замерзают при значительно более низкой температуре: 30%-ный раствор – при минус 30° С, а 60%-ный – при минус 53° С. Кипит Н2О2 при температуре более высокой, чем обычная вода, – при 150,2° С. Смачивает стекло Н2О2 хуже, чем вода, и это приводит к интересному явлению при медленной перегонке водных растворов: пока из раствора отгоняется вода, она, как обычно, поступает из холодильника в приемник в виде капель; когда же начинает перегоняться Н2О2, жидкость выходит из холодильника в виде непрерывной тоненькой струйки. На коже чистый пероксид водорода и его концентрированные растворы оставляют белые пятна и вызывают ощущение жгучей боли из-за сильного химического ожога. В статье, посвященной получению пероксида водорода, Тенар не очень удачно сравнил это вещество с сиропом, возможно, он имел в виду, что чистый Н2О2, как и сахарный сироп, сильно преломляет свет. Действительно, коэффициент преломления безводного Н2О2 (1,41) намного больше, чем у воды (1,33). Однако то ли в результате неверного толкования, то ли из-за плохого перевода с французского, практически во всех учебниках до сих пор пишут, что чистый пероксид водорода – «густая сиропообразная жидкость», и даже объясняют это теоретически – образованием водородных связей. Но ведь вода тоже образует водородные связи. На самом деле вязкость у Н2О2 такая же, как и у чуть охлажденной (примерно до 13° С) воды, но нельзя сказать, что прохладная вода густая, как сироп. Современной физико - химическими методами установлено, что оба атома кислорода в перекиси водорода H2O2 связаны непосредственно друг с другом неполярной ковалентной связью . Связи же между атомами водорода и кислорода полярны. Поэтому молекула H2O2 также полярна . Между молекулами перекиси водорода возникает водородная связь , что приводит к их ассоциации с энергией связи O — O , равной 210 кДж ( 50,48 ккал ) , что значительно меньше энергии связи H -O ( 470 кДж , или 112,4 ккал ) 1.5 Химические свойства Разложение Н2O2 (диспропорционирование) 2Н2O2 = 2Н2O + O2↑ 2O-1 - 2e- → O20 2O-1 +2e- → 2О-2 При Т > 90° С пероксид водорода разлагается практически полностью. Причиной непрочности молекул Н2O2 является неустойчивость атома кислорода в степепени окисления -1. Н2O2 - слабая кислота Молекулы Н2O2 в незначительной степени диссоциируют в водном растворе по схеме: Н2O2 = Н+ + HO2- (Кдисс = 1,5 * 10-12 при 20°С) Кислотные свойства проявляются в реакциях со щелочами с образованием солей - средних (пероксидов) и кислых (гидропероксидов), например: Н2O2 + Ва(ОН)2 = ВаO2 + 2Н2O пероксид бария Гидролиз пероксидов металлов Хотя по составу пероксиды напоминают оксиды, они на самом деле обладают свойствами солей. В водных растворах полностью гидролизуются с выделением Н2O2: К2O2 + 2Н2O = 2КОН + Н2O2 Получение Н2O2 из пероксидов металлов Так как Н2O2 - очень слабая кислота, то она вытесняется из своих солей как сильными кислотами, так и слабыми, например: ВаO2 + H2SO4 = Н2O2 + BaSO4↓ ВаO2 + СO2 + Н2O = Н2O2 + ВаСO3↓ Н2O2 сильный окислитель Атомы кислорода, находящиеся в неустойчивой степени окисления -1, стремятся приобрести еще один электрон для перехода в устойчивое состояние. Поэтому пероксид водорода проявляет очень сильные окислительные свойства, особенно в кислой среде: Н2O-2 + 2H+ + 2e- → 2Н2O-2 Окисление неорганических веществ Примеры: ЗН2O2 + 2NH3 = N2 + 6Н2O 4Н2O2 + H2S = H2SO4 + 4Н2O Н2O2 + 2HI = I2 + 2Н2O 4Н2O2 + PbS = PbSO4 + 4Н2O ЗН2O2 + 2СrСl3 + 10КОН = 2К2СrO4 + 6KCl + 8Н2O Н2O2 + 2FeSO4 + H2SO4 = Fe2(SO4)3 + 2Н2O Окисление органических веществ Конц. водные растворы Н2O2 в смеси с органическими веществами способны к воспламенению и взрыву при ударе. Например, органические кислоты окисляются до СO2 и Н2О(как при горении в O2): 4Н2O2 + CH3COOH = 2CO2↑ + 6Н2O Н2O2 + Н2С2O4 = 2СO2↑ + 2Н2O Пероксиды щел. Me - очень сильные окислители Окисляют многие неорганические и органические вещества, например: 4Na2O2 + СН3СООН = 2Na2CO3 + 4NaOH Na2O2 + SO2 = Na2SO4 Важной реакцией является диспропорционирование пероксида Na при взаимодействии с углекислым газом: 2Na2O2 + 2СO2 = 2Na2CO3 + O2↑ На этой реакции основано использование Na2O2 в автономных дыхательных аппаратах и в замкнутых помещениях для поглощения СO2 и образования O2. Н2O2 - слабый восстановитель (в реакциях с очень сильными окислителями) Окисление пероксида водорода обычно протекает по схеме: 2Н2O-2 - 2e- → O02↑ + 2H+ Примеры реакций: 5Н2O2 + 2КМnO4 + 3H2SO4 = 5O2↑ + 2MnSO4 + K2SO4 + 8Н2O ЗН2O2 + К2Сr2O7 + 4H2SO4 = 3O2↑ + Cr2(SO4)3 + K2SO4 + 7Н2O 3Н2O2 + KClO3 = 3O2↑ + KCl + 3Н2O 3Н2O2 + 2AuCl3 = 3O2↑ + 2Au + 6HCl Глава 2. Неорганические лекарственные средства на основе водород пероксида 2.1. Магния пероксид Магния пероксид (англ. magnesium peroxide), MgO2 — перекись магния. В медицине магния пероксид применяется как антацид и как осмотическое слабительное. Магния пероксид — международное непатентованное наименование (МНН) лекарственного средства. По фармакологическому указателюмагния пероксид входит в группы «Антациды и адсорбенты» и «Антисептики и дезинфицирующие средства». По АТХ магния пероксид входит, в частности: в раздел «А02А Антациды, группу «A02AA Препараты магния» и имеет код A02AA03 в раздел «A06 Слабительные», группу «A06AD Осмотические слабительные» и имеет код A06AD03 Магния пероксид является осмотическим слабительным, действие которых основано на повышении содержания воды в каловых массах и ускорении транзита по кишечнику. Прием солевых слабительных может провоцировать развитие диареи и нарушений водно-солевого обмена. Эффект от назначения этих средств проявляется уже спустя несколько часов после приема. Отрицательными сторонами осмотических слабительных служит возможность развития серьезных побочных эффектов при длительном (на протяжении 6–12 месяцев) применении, включая психологическую зависимость и феномен привыкания. Целесообразно их назначение в режиме эпизодических приемов. В России и США лекарственные средства с действующим веществом магния пероксид не зарегистрированы. В конце 1990-х годов в России был зарегистрирован БАД Озовит, единственным компонентом которого был магния пероксид в виде порошка, расфасованный в пакетики из алюминиевой фольги по 100 г. В начале 2000-х годов регистрация закончилась. В Германии зарегистрировано лекарство Ozovit с действующим веществом магния пероксид. В ряде стран на территории бывшего СССР зарегистрировано (было зарегистрировано) два варианта лекарственного средства с торговым наименованием Магния перекись: Антацидное средство с единственным действующим веществом — магния пероксидом (порошок для приготовления суспензии для приема внутрь). Антацидное средство — порошок для для приема внутрь, представляющее собой смесь магния оскида и магния пероксида в пропорции 17:3.[11] 2.2 Перекись водорода.Hydrogen peroxide Аналоги: водорода перекись Жифрер, Водорода перекись медицинская, Оксилизин, Паркон, Пергидроль, Перекиси водород, Пероксид водорода, Пероксимед Бесцветная прозрачная жидкость без запаха. Неограниченно растворяется в воде, спирте и эфире. pH водных растворов 3,8-5,6. Тпл -0,432 °С; Ткип 150,2 °С. Рецепт Rp.: Hydrogenii peroxydi 3 % — 50 ml D. S. Антисептик для первичной хирургической обработки ран Rp.: Hydrogenii peroxydi 3 % — 100 ml D. S. Для обработки ран лица Rp.: Hydrogenii peroxydi 3 % — 50 ml D. S. Для обработки кариозной полости. Rp.: Hydrogenii peroxydi 3 % — 50 ml D. S. Для остановки луночкового кровотечения Rp.: Hydrogenii peroxydi 3 % — 50 ml D.S. Для обработки полости зуба перед пломбированием Rp.: Hydrogenii peroxydi 6 % — 500 ml D. S. Для холодной стерилизации инструментов. Фармакологическое действие: Антисептическое средство из группы антиоксидантов. При контакте перекиси водорода с поврежденной кожей или слизистыми оболочками высвобождается активный кислород, при этом происходит механическое очищение и инактивация органических веществ (протеины, кровь, гной). Антисептическое действие не является стерилизующим, при его применении происходит лишь временное уменьшение количества микроорганизмов. Обильное пенообразование способствует тромбообразованию и остановке кровотечения из мелких сосудов.[6] Способ применения Перекиси водорода 3% наносят на поврежденные участки кожи для дезинфекции ран per se (без разведения). Для полосканий растворяют 1 столовую ложку в 1 стакане воды; для апликаций, обработки поверхности ран, остановки кровотечений (капиллярных) поврежденные участки обрабатывают тампоном, который пропитан раствором перекиси водорода. Продолжительность лечения зависит от достигнутого эффекта. Показания - воспалительные заболевания слизистых оболочек; - гнойные раны; - капиллярное кровотечение из поверхностных ран; - носовые кровотечения; - для дезинфекции и дезодорирования: стоматит, ангина, тонзиллит, гинекологические заболевания. 2.3. Гидроперит. TabulettaeHydroperiti Гидроперит TabulettaeHydroperiti CO(NH2)2 H2O2 Эквимолярная смесь мочевины и водорода пероксида, содержит 33-35% Дезинфицирующее, дезодорирующее средство. Применяют при воспалительных заболеваниях слизистых оболочек, кожи, некоторых гинекологических заболеваниях, наружно и в виде промываний. Твердое вещество белого цвета, растворимое в воде. Одна таблетка гидроперита (1,5 г) соответствует 15 мл 3% раствора H2O2. При растворении таблетки в стакане воды получают 0,25% раствор H2O2.[4] 2.4. Натрия тиосульфат.Natrii thiosulfas Sodium thiosulfate Натрия тиосульфат Natrii thiosulfas Sodium thiosulfate Тиосульфа́т на́трия (антихлор, гипосульфит, сульфидотриоксосульфат натрия, натрий серноватистокислый) — Na2S2O3 или Na2SO3S, соль натрия и тиосерной кислоты, образует кристаллогидрат Na2S2O3·5H2O. Дезинтоксикационное, противовоспалительное, десенсибилизирующее, противопаразитарное средство. Применяют при аллергических заболеваниях; артрите; невралгии; отравлениях соединениями мышьяка, ртути, свинца, синильной кислотой; чесотки Применение натрия тиосульфата основано на его свойстве выделять серу. Препарат применяется в качестве противоядия при отравлениях галогенами, цианом и циановодородной кислотой. [3] Это свойство натрия тиосульфата разлагаться кислотами с выделением серы используется для идентификации препарата. При добавлении к раствору натрия тиосульфата хлороводородной кислоты наблюдается помутнение раствора вследствие выделения серы. [c.91] В сухой атмосфере выветривается, образуя белые кристаллы безводной соли, во влажном воздухе - расплывается вследствие гигроскопичности. При T 49 °С плавится в кристаллизационной воде. Легко растворим в воде (1:1), практически нерастворим в этаноле. рН водного раствора 8,0-8,4. Заключение Перекись водорода, химическая формула которой H2O2, при контакте с водой распадается до составляющих, то есть на воду и кислород, поэтому перекись водорода вполне справедливо считается экологически чистым веществом, которое не может принести никакого вреда окружающей среде. Что касается безусловной пользы перекиси водорода, то это, прежде всего, ее использование в медицинских целях. Как известно, согласно официальным рекомендациям, в медицинских целях используется перекись водорода трехпроцентная, причем назначение этого средства исключительно наружное — обработка незначительных повреждений кожи (ссадин, царапин, ран небольшого размера), остановка незначительных кровотечений, а также использование для полосканий при заболевании стоматитом. Обеззараживающий (антисептический) эффект объясняется тем, что при контакте перекиси водорода с кожей происходит высвобождение кислорода (появляется пенка), и, как следствие, рана получает возможность очиститься механическим способом — образовавшаяся кислородная пена очищает рану просто механически, вымывая микробы, грязь и даже некротические образования, которые могли уже появиться в ране. Список использованной литературы 1.Беликов В.Г. Фармацевтическая химия. 4-е изд. М.: МЕДпрессинформ, 2007. 2. Граник В. Г. Основы медицинской химии. 2-е изд. М.: Вузов. книга, 2006. 3.Дельцов, А. А. Основы фармацевтической химии (фармакопейные методы анализа лекарственных веществ). Учебное пособие / А.А. Дельцов. - М.: Научная библиотека, 2014. - 854 c. 4. Лабораторные работы по фармацевтической химии / Под ред. В.Г. Беликова. М.: Высш. шк., 2014 5. Логинова Н. В., Полозов Г. И. Введение в фармацевтическую химию. Мн.: БГУ, 2003. 6.М.Д. Машковский. Лекарственные средства. В 2-х томах. Изд.13. Харьков Торсинг, -2012. - ч. 1,2. 7.Руководство к лабораторным занятиям по аптечной технологии лекарственных форм./ Под ред. Т.С. Кондратьевой. - М.: - Медицина, 2013.-271 с. 8.Смирнов В.А. Анализ лекарственных веществ. Ч.1. Общие реакции на подлинность: учебно-методическое пособие / В.А. Смирнов. - Самара. Самар. гос. техн. ун-т. 2014. - 55 9. Солдатенков А.Т., Колядина Н.М., Шендрик И.В. Основы органической химии лекарственных веществ. – М.: Мир, 2011 10. Тюкавкина Н.А., Бауков А. Г. Биоорганическая химия. М.: ДРОФА, 2014. 11.Технология лекарственных форм в 2-х томах. Учебник для вузов. Т. 17 Под ред. Т.С. Кондратьевой, - М.: Медицина, 1991, с.496.: ил., т.2. Под ред. Л.А. Ивановой - М.: Медицина, 2013, - 544 с: ил. 12. Фармацевтическая химия / Под ред. А.П. Арзамасцева. 3-е изд. М.: ГЭОТАР–Медиа, 2014 13.Фармацевтическая химия. Неорганические лекарственные вещества: учебно-методическое пособие / Е.В. Щепетова. -- М. : КНОРУС ; Астрахань : АГУ, ИД «Астраханский университет», 2016. -- 96 c. 14.Щеголев, Александр Евгеньевич Органическая химия. Для фармацевтических и химико-биологических специальностей вузов. Учебное пособие / Щеголев Александр Евгеньевич. - М.: Лань, 2017. - 845 c. |
