|
|
|
4 Наиболее распространенными являются три аналитические классификации катионов по группам: сероводородная (сульфидная); аммиачно-фосфатная; кислотно-основная.
|
6 к 1 аналит.группе относят кат. К+, Na+ NH4+. Соединения катионов как правило характеризуется хорошей растворимостью в воде и других полярных растворителях. Именно поэтому группа не имеет группового реактива. Ионы K, Na гидролизу не подвергаются, поэтому соли этих катион. И сильных кислот имеют нейтральную реакцию раствора, а соли слабых кислот-щелочную. NaCl+K[Sb(OH)6]=Na[Sb(OH)6]+KCl,KCl+H2C2H4O6+HCl
NH4Cl+NaOH=NH3+NaCl+H2O
|
|
5
|
7 Ко 2группе относят Ag Pb Hg2, групп. Реагент HCl. Хлориды серебра и ртути(1) практич. Нераствор. В воде, хлорид свинца плохо растворим. AgNO3+HCl=AgCl+HNO3,
Pb(NO3)2+2HCl=PbCl2+2HNO3,
Hg2(NO3)2+2HCl=Hg2Cl2+2HNO3
|
8 Кат.3групп Ca,Ba,Sr, групп.реагент H2SO4
При взаимодействии с сульфатом катионы дают нераст. В воде сульфаты бария и стронция и плохо раств.сульфат кальция
CaCl+H2SO4=CaSO4+2HCl BaSO4+2HCl
SrCl2+H2SO4=SrSO4+2HCl
|
9 Катионы 4групп. Al,Zn,Sn,C, Fe Групп.реагентом явл. Щелочи, при взаимодействии с которыми образуются осадки гидроксидов,растворимые в избытке реактива Al2(SO4)3+6NaOH=2Al(OH)3+3Na2SO4 Cr2(SO4)3+6NaOH=2Cr(OH)3+3Na2SO4
|
10 Кат. 5групп. Fe,Mn,Mg,Bi,Sb, групп реагент-водный раствор
MgCl2+2NaOH=Mg(OH)2+2NaCl
MnSO4+2NaOH=Mg(OH)2+Na2SO4
|
11 Кат 6групп Co Ni Cu Cd Hg, групповой р NH4OH
HgCl2+2NH4OH=[HgNH2]Cl(тв)+NH4Cl+2H2O
2CuSO4+2NH4OH=(CuOH)2SO4(тв)+(NH4)2SO4
|
12 схемы разделения катионов: по сероводородному, по аммиачно-фосфатному, по кислотно-основному
|
13 используют метод подходящий для анализа определенной смеси анионов, разлисная их солей, ОВР
|
14 Анионы 1 группы SO4, SO3, CO3, PO4, SIO3, S2O3, C2O3, C2O4, CRO4, B4O7, групп реак BaCl2
BaCl2+Na2SO4=BaSO4+2NaCl,BaCl2+Na2SO3=BaSO3+2NaCl
BaCl2+Na2S2O3=BaS2O3+2NaCl,BaCl2+Na2HPO4=BaHPO4+2NaCl
|
15 Анион. 2групп Cl–, Br–, I–, S 2- групп.реагент AgNO3
AgCl+2NH4OH={Ag(NH3)2}Cl+2H2O AgNO3+KBr=AgBr+KNO3 AgNO3+KI=AgI+KNO3
|
16 В3 группу анионов входят ионы NO3 NO2 CH3COO эти анионы не имеют группового реагента, так как не осождаются ни нитратом серебра ни хлоридом бария
|
17 задачи количественного анализа -определение содержания или концентрации компонентов в пробе. 2 метода: гравиметрический, титриметрический. Весовым анализом метод колич. Анализа, в котором точно измеряют только массу Обьемный анализ основан на точном измерении массы веществ и обьема раствора реактива известной концентрации, реагирующего с определенным количеством анализируемого вещества.
|
18 основные атапы 1-расчет массы Н анал.проб., и обьем раствора 2-взвешивание анал.в-ва на весах 3-растворение Н 4-осаждение определяемого компонента в виде осадка
|
19 гравиметрический анализ совокупность методов колич. анализа основанных на измерении массы определяемого компонент, метод отгонки-расчет навески, взятие навески,высушиваение навески до постоянной массы, взвешивание и расчеты
Методы осаждения-расчет навески,растворение навески,осаждение определяемого компонента,фильтровавние осадка и его промывание, высушивание освадка, прокаливание осадка, взвешивание,расчекты
|
20 титримет.методом анализа называют метод количесвенного анализа,основанный на измерении обьема раствора с точно известной концентрацей реактива ,требующегося для завершении реакции с данным кол-вом определяемого вещества. Метод заключается в том,что к раствору определяемого вещества А постепенно прибавляют раствор реактива В известной концентрации.Добавление 2 реактива продолжают до того момента, пока его кол-во не станет эквивалентным кол-ву реагирующего с ним вещества А. В зависимости от способа титрования различают:прямое титрование,обратное,косвенное.
|
21 метод кислотно-основного титорования –предназначен для определения конц. Кислот, оснований, солей и основан на реакции нейтрализации.
|
22 окислительно-восстановыительным титрованием называют количественное определение веществ титрованием стандартними растворами окислителей или восстановителей. Оксидиметрия это ктод обьемного анализа, в основе которого лежат окислительно-восстановительные реакции. При поиощи титрованных растворов окислителей определяют количественное содержание восстановителей и наоборот
Оксидиметрия разделяется: перманганатометрию, йодометрию, хроматометрию, бромометрию индикаторы : метиловый-оранжевый, метиловый-красный
|
23 пермангонатометрия- метод кол-го определения веществ с применением титранта-раствора перманганата калия .перманганат калия проевляет окислительные свойства и стандартный электродный потенциал
|
25 аргентометрия-метод анализа основан на применении в качестве осадителя стандартного раствора серебра нитрата
Метод Мора основан на титровании хлоридов в нейтральной среде раствором нитрата серебрав в присутствии индикатора хромата калия. Метод предназначен для определения массовой доли соли CrO4+2Ag=Ag2CrO4 осадок кирпичного цыета Определение можно проводить только в нейтральной среде. Он основан на реукции, протекающей между Ag Cl, выполняется в присутсвии индикатора раствора хромата калия
|
24 Иодометрия-метод анализа основанный на реакциях в ходе которых выделяется или расходуется свободный йод. Его используют для определения сероводорода,тиосульфата. Раствор иода можно пригтовить из неочищенного иода, конц. Можно установить тиосульфатом натрия
2Na2S2O3+I3=Na2S4O6+2NaI
|
28 комплексонометрические методы титрования основаны на образовании прочных комплексных соединений хелатного типа иона металловс пециальными органическими комплексонами Комплексон 1 нитрилотриуксусная кислота 2- этилендиаминотетрауксусная кислота
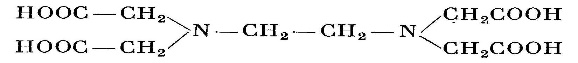
3 трилон Б
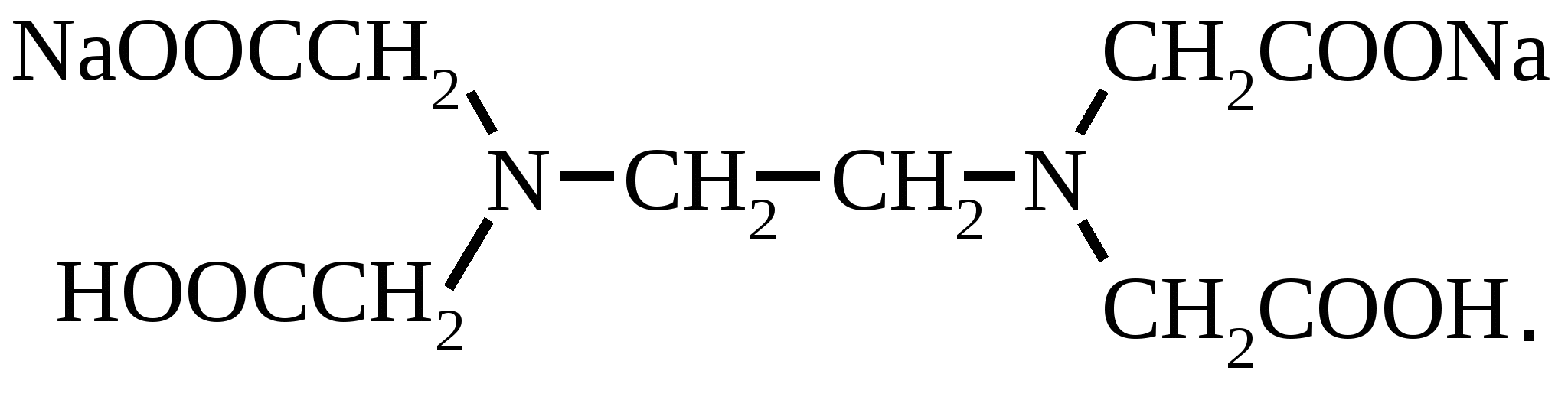
|
26 Метод фаянса – это метод прямого титрования галогенидов раствором AgNO3 в слабо кислой среде, используют адсорбционные индикаторы флюорецеин и эозин, при добавлении образуется желто-зеленый окрас
|
29 меркурометрия- титриметрический метод анализа анионов, образующих малорастворимые соединения с катионами ртути. Стандартизируют по растворам KCl NaCl. Конечную точку титрования определяют с помощью индикаторов . титрование проходит в кислой среде при интенсивном перемешивании.
|
30 сульфатометрия- метод определения катионов бария в солях бария путем титрования их стандартным раствором серной кислоты. В онове метода лежит реакция осаждения катионов бария в виде малорастворимого осадка сульфата бария
|
31 кач реакции на катионы натрия
Na3РО4 + КН2SbО4 → NaН2SbО4 + К3РО4
Na+ + Н2SbО4- → NaН2SbО4↓
|
32 калий КBr + NaHC4Н4О6 → КНС4Н4О6↓ + NaВr бел осадок
Гексанитрокобальтат натрия 2K+ + Na+ + [Co(NO2)6]3- → K2Na[Co(NO2)6] желт криставл
|
33 аммоний NH4Cl + NaOH → NaCl + NH3 + H2O реактив несслера
|
34 серебро AgCl + 2NH3 = [Ag(NH3)2]Cl(p.p)
AgNO3+NaOH=AgOH+NaNO3
2AgNO3+K2CrO4=Ag2CrO4+2KNO3
|
35 ртуть Hg2(NO3)2+2NaOH=Hg2O+2NaNO3
Hg2(NO3)2+K2Cr2O4=Hg2CrO4+2KNO3
|
37 кальций
CaCl2 + (NH4)2C2O4 → 2NH4Cl + CaC2O4
CaC2O4↓ + 2HCl → CaCl2 + Н2C2O4
|
39 барий
ВаСl2 + К2CrO4 → ВаCrO4 + КСl
2ВаCrO4 + 4НСl → 2ВаСl2 + Н2Cr2O7 + Н2О
|
40 алюминий
2Al2(SO4)3 + 2Co(NO3)2 → 2Co(AlO2)2 + 4NO2 + 6SO3 + O2
АlСl3 + 3NH4OH = Al(OH)3↓ + 3NH4Cl
|
41 хром
2Сr(ОН)4 + 3Н2О2 + 2ОН = 2СrО4 + 8Н2О
H2Cr2O7 + 4H2O2 + 2S → 2CrO(O2)2S + 5H2O
|
42 цинк
ZnCl2 + 2KOH → Zn(OH)2↓ + 2KC1
3ZnCl2 + 2К3[Fе(СN)6] → Zn3[Fe(CN)6]2↓+ 6KC1
|
43 мышьяк
Na3AsO3+I2+H2O→ Na3AsO4+ 2HI
AsH3+6AgNO3+3H2O→ H3AsO3+6Ag+HNO3
|
44 олово
SnCl2+4KOH→K2SnO2+2KCl+2H2O
SnCl2+H2S→SnS↓+2HCl
|
45 висмут
Bi(NO₃)₃ 4KI = K[BiI₄] + 3KNO₃
BiCl3+3KI→BiI3+3KCl
|
46 железо 3
FeCl3+ + 3NaOH → Fe(OH)3 + 3NaCl
FeCl3 + 3NH4SCN ↔ 3NH4Cl + Fe(SCN)3
|
47 магний
MgSO4+Na2HPO4+NH4OH→
MgNH4PO4↓+Na2SO4+H2O
|
49 сурьма
SbCl3+H2O→SbOCl+2HCl
2SbCl3+ Na2S2O3+3H2O→Sb2OS2↓+Na2SO4+6HCl
|
50 кадмий
Cd(NO3)2 + 2NH3 ˙ Н2О =Cd(ОН)2 + 2NH4NO3
Cd(NO3)2 + 2NaOH =Cd(OH)2 + 2NaNO3
|
51 кобальт
СоСl2 + NH3*H2O → СоОНСl ↓+ NH4Cl
|
52 медь
CuSO4+Na2S2O3→CuS2O3+Na2SO4
CuSO4 + 2KOH = Cu(OH)2↓ + K2SO4
|
53 никель
Ni(NO3)2 + NH3H2O — NiOHNO3 + NH4NO3,
|
54 ртуть
Hg(NO3)2+ 2КОН → HgO↓+ Н2О + 2KNO3
Hg (NО3) 2 + 2KI → HgI2↓+ 2KNO3
|
55 хлор
NaCl + AgNO3 = AgCl↓ + NaNO3
AgCl + 2 NH3 = [Ag (NH3)2] Cl
Бром
NaBr + AgNO3 = AgBr↓ + NaNO3
йод
KI + AgNO3 = AgI↓ + KNO3
|
1 Аналитическая химия — это наука о качественном и количественном составе вещества, методах его определения. Задачи:обнаружение и определения составных частей анализиремого объекта,2измерение кол-во,3определение последовательности соединения
|
2 Основными методам: Сравнение,Индексный метод,Балансовый метод,Метод цепных подстановок,Метод элиминирования,Графический метод,Факторный анализ,Экономико-математические методы,Функционально-стоимостной анализ
|
3 Ка́чественный ана́лиз — совокупность химических, физико-химических и физических методов, применяемых для обнаружения элементов, радикалов и соединений, входящих в состав анализируемого вещества или смеси веществ. Основной задачей кач.хим.анал. катионов и анионов является идентификация того или иного мона. Те док-во его присутствия или отсутствия в анализируемом объекте.различ.хим. методы кач.анал.катион.: сероводородный,аммиачно-фосфатный, кислотно-основной, карбонатный, сульфидно-основной,тиоцетамидный
|
|
|
|
|
|
|
|
|
|
|
| |
 Скачать 66.28 Kb.
Скачать 66.28 Kb.