Низкокремнеземные 2. Низкокремнеземные цеолиты
 Скачать 121.08 Kb. Скачать 121.08 Kb.
|
|
Министерство науки и высшего образования Российской Федерации Федеральное государственное бюджетное образовательное учреждение высшего образования «Уфимский государственный нефтяной технический университет» Кафедра «Технология нефти и газа» Самостоятельная работа студента № 1 на тему «Низкокремнеземные цеолиты» Выполнил: ст.гр. БТП-20-02 Гончарова Е.А. Проверил: доцент кафедры ТНГ, к.т.н. Белоусова О.Ю. Уфа 2023 СОДЕРЖАНИЕ 1. Характеристика цеолитов и их назначение 3 2. Структура цеолитов 4 3. Синтез цеолита типа Х 7 4. Области применения низкокремнеземных цеолитов 8 Список использованных источников 10 1 Характеристика цеолитов и их назначение Цеолитами называются кристаллические водные алюмосиликаты каркасной структуры, из которых, путем умеренного нагревания, вода может быть обратимо удалена без разрушения кремнеалюмокислородного каркаса; при этом в каркасе образуется система регулярных каналов и полостей, доступных для адсорбции молекул малых размеров. Цеолиты имеют строго регулярное кристаллическое строение, характерное для каждого структурного типа. Me2n ∙ Al2O3 ∙ xSiO2 ∙ mH2O где n - валентность катиона металла Me; x – мольное соотношение оксидов кремния и алюминия, называемое силикатным модулем; m - число молей воды.
Цеолиты имеют высокую адсорбционную способность, большую удельную поверхность. В кристаллических алюмосиликатах все атомы алюминия и кремния объединены в тетраэдр, который образован с участием кислородных атомов. Кристаллическая структура цеолита образована тетраэдрами 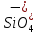 и и 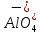 . Избыточный отрицательный заряд этих частиц компенсируется катионами Na+, K+, Ca2+. . Избыточный отрицательный заряд этих частиц компенсируется катионами Na+, K+, Ca2+.Цеолиты обладают строго регулярной структурой пор, которые в обычных условиях заполнены водой. Эта вода называется цеолитной и при нагревании до 170–250 °С выделяется, цеолиты «кипят». Отсюда произошло их название от латинских слов: цео – кипеть, лит – камень. Освобожденные от воды полости цеолита могут быть вновь заполнены молекулами воды или других веществ. Это определяет адсорбционные способности цеолитов. Однако не все вещества могут проникать в адсорбционные полости цеолитов и, следовательно, поглощаться ими. Связано это с тем, что адсорбционные полости цеолита соединяются друг с другом входами, называемыми входными окнами. Входные окна цеолитов характеризуются диаметром do. Цеолиты могут поглощать те вещества, у которых молекулы имеют критический диаметр (dкр) меньше диаметра входного окна цеолита dкр< do. В этом проявляются так называемые молекулярно-ситовые свойства цеолитов. 2 Структура цеолитов Тип А состоит из больших и малых (содалитовых) адсорбционных полостей. В состав элементарной ячейки входят одна большая и одна малая полость. Большая полость имеет практически сферическую форму диаметром 11.4 Å. Она соединена с шестью соседними большими полостями восьмичленными кислородными кольцами диаметром 4.2 Å и с восемью малыми полостями шестичленными кислородными кольцами диаметром 2.2 Å. Объем большой полости составляет Vg = 776 Å. В ней при полном заполнении помешается 24 молекулы воды. Малая полость — также сферической формы, ее диаметр 6.6 Å, объем V= 150 Å. Поскольку на каждую. большую адсорбционную полость приходится одна малая адсорбционная полость, доля объема больших полостей — 0.84. Пористость кристалла составляет 50.2%. Входы в малые адсорбционные полости цеолитов типа А настолько малы, что практически в них не проникают молекулы адсорбируемых веществ (кроме воды). Поэтому предельный адсорбционный объем кристаллита типа А, вычисленный из изотерм адсорбции паров воды (0.325 см3/г) соответствует теоретическому объему кристаллов (0.334 см3/г). Адсорбционный объем, заполняемый азотом, близок к суммарному объему больших полостей цеолитов (0.280 см3/г). Цеолиты типа А относятся к низкокремнистым формам. В них отношение SiO2/Аl2О3 равно 2. Кислотостойкость цеолитов последовательно повышается с увеличением этого показателя. Вследствие этого цеолиты типа А разрушаются в кислой среде. В цеолите NaA отношение Na2O/А12О3 теоретически равно 1, а практически колеблется от 0.85 до 0.93. В одной элементарной ячейке находятся 12 одновалентных катионов: восемь катионов натрия расположены в центре 6-членных кислородных колец, а четыре — на гранях вблизи 8-членных кислородных колец. 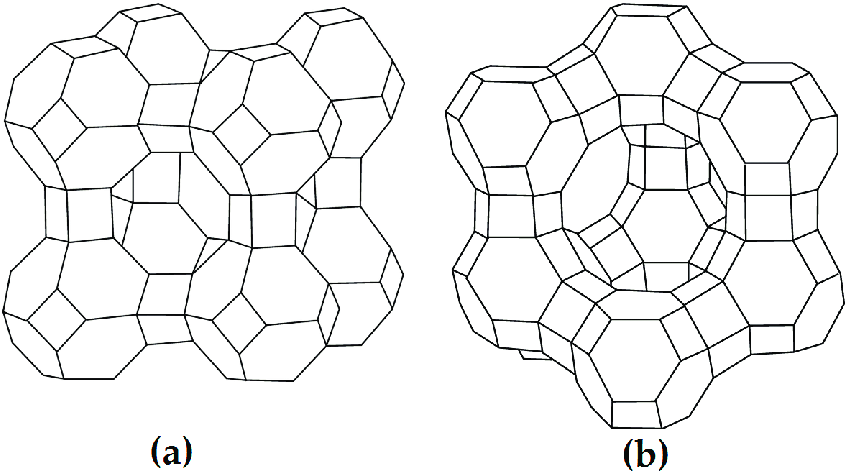 Рисунок 1 — Цеолит типа А (Na12[(AlO2)12(SiO2)12]  27 H2O) 27 H2O) Цеолиты типа Х имеют в дегидратированном виде состав Na2O  Аl2О3 Аl2О3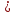 хSiO2. Мольное отношение SiO2/Аl2О3 может изменяться от 2.2 до 3.3. Каждая большая полость имеет четыре входа, образованных 12-членными кислородными кольцами диаметром 8-9 Å. Структура цеолитов такого типа более открыта и доступна для поглощаемых молекул. хSiO2. Мольное отношение SiO2/Аl2О3 может изменяться от 2.2 до 3.3. Каждая большая полость имеет четыре входа, образованных 12-членными кислородными кольцами диаметром 8-9 Å. Структура цеолитов такого типа более открыта и доступна для поглощаемых молекул. Объем большой адсорбционной полости цеолита NaX лишь незначительно отличается от соответствующей полости в цеолите NaA и равен 822 Å. Малые полости имеют тот же объем, т. е. 150 Å. Комплексы больших и малых полостей составляют элементарную ячейку. В каждой элементарной ячейке цеолита NaX содержится по восемь больших и восемь малых полостей. Элементарная ячейка содержит 192 иона Аl и Si, а также 384 иона кислорода, ее объем равен 7776 А3. Она вмещает 256 молекул Н2О. Малые полости цеолитов типа Х доступны для молекул азота и других газов. Поэтому предельный адсорбционный объем кристаллита типа X, вычисленный из адсорбционных измерений, близок к рассчитанному на основе геометрических размеров элементарных ячеек, т. е. 0.356 (NaX) или 0.362 (СаХ) см3/г. Этим объясняется большая адсорбционная способность цеолитов типа Х по сравнению с цеолитами типа А, достигаемая при относительно высоких степенях заполнения. В результате исследования состояния катионов Na и Са в гидратированном фожазите установлено, что из 43 катионов, приходящихся на элементарную ячейку этого цеолита, лишь 17 находятся в локализованном положении. Остальные катионы характеризуются большой мобильностью, постоянно мигрируют в полостях цеолитов, и такая система может рассматриваться как электролит. 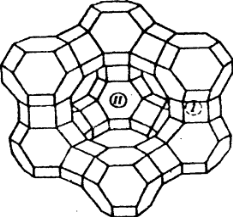 Рисунок 2 — Цеолит типа Х (Na86[(AlO2)86(SiO2)106]  264H2O) 264H2O)Цеолит типа Y является структурным аналогом природного цеолита фожазита и имеет отношение SiO2/Al2O3, равное 3,1-4. Они отличаются повышенной кислотостойкостью, термостойкостью и каталитической активностью в реакциях крекинга, изомеризации, алкилирования и в других процессах. Именно высокая реакционная способность предопределила высокий спрос на этот вид цеолитов в нефтехимии. Основной структурной единицей цеолита типа Y являются кубооктаэдр, часто называемый содалитовой ячейкой и образованной путем пространственного соединения между собой 24 тетраэдров. Объем внутреннего пространства кубооктаэдра составляет примерно 0,15 нм3 (диаметр 0,66 нм) и называется малой или β-полостью. В цеолите типа Y кубооктаэдры соединяются шестичленными кислородными кольцами с образованием гранецентрированной решетки.  Рисунок 3 — Цеолит типа Y I, I’, II и II’ – места локализации катионов. При этом образуются пространства между кубооктаэдрами и шестичленными мостиками – большие или α-полости. Элементарная ячейка, повторение которой воспроизводит гранецентрированную решетку кристалла, содержит 8 кубооктаэдров, 16 шестичленных кислородных мостиков, 8 больших и 8 малых полостей. Суммарно в элементарную ячейку входят 192 атома Si и Al и 384 атома кислорода. В решетке цеолита отрицательный заряд алюминий-кислород тетраэдра компенсируется катионами металлов, обычно катионом Na+, так как синтез цеолита ведется большей частью в щелочных растворах. 3 Синтез цеолита типа Х Способ получения синтетического цеолита типа Х, включающий смешение каолина с диоксидом кремния и добавкой, увлажнение смеси до получения однородной массы, формование гранул, термообработку, гидротермальную кристаллизацию, отмывку и сушку. К исходному каолину с мольным соотношением компонентов SiO2:Аl2О3=2,0 добавляют диоксид кремния до конечного соотношения в смеси SiO2:Аl2О3=2,85-2,95. В качестве диоксида кремния используют высокодисперсный аморфный порошок диоксида кремния в реакционноспособной форме (белая сажа). Затем к смеси добавляют порошок древесной муки, кокса или коксового активного угля с размером частиц менее 100 мкм в количестве 8,1-12 мас.%. Добавка должна полностью сгореть при термоактивации. К сухой смеси добавляют водный раствор гидроксида натрия до образования пластичной массы с влажностью 30-35% при содержании гидроксида натрия 0,5-2,5 мас.%. Пластичную массу формуют в гранулы диаметром 1,5-3 мм, гранулы сушат при 100-140oС в течение 1-3 часов. При термообработке происходит аморфизация каолина, его переход в химически активную форму и полное удаление добавки. Рентгеноаморфные гранулы заливают раствором щелочи и выдерживают при температуре около 20oС 12-18 час. При этом происходит взаимодействие компонентов гранулы с раствором, которое заканчивается образованием цеолита при последующей выдержке при 95-100oС в течение 24-36 час. Готовый цеолит отмывают от избыточной щелочи и сушат. 4 Области применения низкокремнеземных цеолитов Ввиду особых свойств, таких, как способность к обратимой адсорбции, наличие пор с входными отверстиями строго определенных размеров, большая величина внутренней поверхности, молекулярные сита можно использовать в трех направлениях: — разделение веществ в зависимости от размеров молекул; — разделение веществ в зависимости от полярности молекул; — разделение веществ с помощью ионнообменного механизма. При приведенные методики дают нам пять возможных областей применения: — сушка газа или жидкости; — очистка газа или жидкости; — разделение смесей углеводородов различного строения; — осушка воздуха; — умягчение водных потоков от катионов тяжелых металлов и поглощение радионуклидов в атомной энергетике. Во многих случаях возможно применение цеолитов вместо других адсорбентов типа активированного угля, селикагеля и алюмогеля. Свойства цеолитов и возможности их использования исследовались во многих областях науки: неорганической, органической, физической и коллоидной химии, биохимии, минералогии, геологии, химии поверхности, океанографии, кристаллографии, катализе и во всех отраслях химической технологии. В настоящее время на этих катализаторах работает около 95% установок крекинга. Внедрение цеолитных катализаторов позволило сократить капиталовложения на сумму несколько сот миллионов долларов в год. СПИСОК ИСПОЛЬЗОВАННЫХ ИСТОЧНИКОВ Технология катализаторов / Под ред. И.П. Мухленова. Л., Химия, 1979. -95с. Елесеева И.С. Становление и развитие производства синтетических цеолитов.Уфа-2003. Брек Д. Цеолитовые молекулярные сита. Пер. с англ./ Под ред. Х.М.Миначева. М., Мир, 1976.- 781 с. Сендеров Э.Э., Хитаров Н.И. Цеолиты, их синтез и условия образования в природе. М.:Химия. 2016. 395с. Кельцев, Н.В. Основы адсорбционной техники, 2-е изд., перераб. и доп. / Н.В. Кельцев. – М.: Химия, 1984. – 592 с. Новый справочник химика и технолога [Текст]: справочное издание /ред. Ю. В. Поконова. – СПб: Мир и семья. Ч.1: Сырье и продукты промышленности органических и неорганических веществ.- 2002.- 988 с. Неймарк И.Е. Синтетические минеральные адсорбенты и носители катализаторов. М: Химия. 2012. 216с. Диссертация Кульчаковской Е.В. “Кобольтовые катализаторы синтеза Фишера-Тропша на основе катионных форм цеолитов” Синтетические цеолиты. Получение, исследование и применение. Доклады I Всесоюзн. совещания, отв. ред. М. М. Дубинин. В. В. Серпинский, Изд. АН СССР, M., 1962. Соколов В. А ., Торочешников Н. С., Кельцев Н. В., Молекулярные сита и их применение, «Химия», M., 1964.3. Дорогочинский А. З., Мирский Я. В. Цеолиты и цеолитсодержащие катализаторы. – Грозный: ЧИ-книжное изд., 1974. Пеков И.В., Турчкова А.Г., Ловская Е.В., Чуканов Н.В. Цеолиты щелочных массивов. М.: Экост, 2004, 168 с. Бушуев, Ю. Г. Цеолиты. Компьютерное моделирование цеолитных материалов / Ю. Г. Бушуев; Иван. гос. хим.-технол. ун-т.-Иваново,2011. – 104с. Труды ГрозНИИ, 1978, с. 27 https://zioc.ru/files/Диссертация%20к.х.н.%20Михайлов%20СА.pdf https://naukarus.com/sintez-fiziko-himicheskie-i-kataliticheskie-svoystva-svk http://www.dslib.net/kataliz/adsorbcionnye-kislotnye-i-kataliticheskie-svojstva https://www.uspkhim.ru/php/getFT.phtml?jrnid=rc&paperid=1548&year_id=1 http://nnsorb.ru/poroshkoobraznye-tseolity-tipa-tsvm-tsvn-zsm-5-tsvk-zsm-11-knae-na https://chem21.info/page/028209084072219067203016065001216132111209251117/ https://chem21.info/info/167907/ https://bstudy.net/962130/tehnika/sintez_tseolitov https://catalogmineralov.ru/mineral/erionite.html https://tftwiki.ru/wiki/Erionite https://chem21.info/info/346769/ https://pro-kamni.ru/erionit |
