тх1. ТХ. Объекты анализа
 Скачать 147.11 Kb. Скачать 147.11 Kb.
|
|
Ацетон 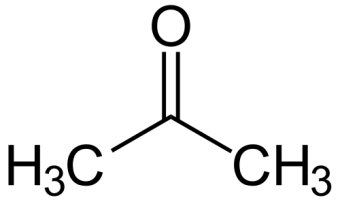 1. Ацетон представляет собой летучую бесцветную жидкость, с характерным запахом, Т. кип. 56,1 °С. Смешивается с водой и органическими растворителями, например эфиром, метанолом, этанолом, сложными эфирами. Применение: ацетон - широко применяемый растворитель органических веществ, служит сырьем для синтеза многих соединений. 2. Действие ацетона на организм характеризуется поражением ЦНС, угнетением окислительных процессов, развитием анемии. При приеме внутрь наблюдается тошнота, рвота, боли в животе, потеря сознания, цианоз кожи и слизистых, отсутствие основных рефлексов, тахикардия, сужение зрачков и отсутствием их реакции на свет, повышением АД, запах ацетона изо рта Лечение: при пероральном приеме - промывание желудка; при ингаляционном - промывание глаз водой, ингаляция кислорода. Ощелачивание мочи. Форсированный диурез. Лечение острой сердечно-сосудистой недостаточности, нефропатии, пневмонии. 3. Метаболизм ацетона: Ацетон в организме окисляется до оксида углерода (IV) и восстанавливается до изопропанола, частично в неизмененном состоянии выводится с мочой, через кожу и с выдыхаемым воздухом. Объекты анализа: -Остатки жидкости в стаканах, емкостях, флаконах с запахом ацетона, найденные на месте происшествия -Кровь, моча -Желудок с содержимым -Головной мозг, легкое -Печень, селезенка При патологоанатомическом исследовании погибшего обнаруживают полнокровие внутренних органов, единичные кровоизлияния, отек легких, темную «дегтеобразную» кровь в полостях сердца и крупных сосудах. При пероральном приеме ацетона наблюдаются участки некроза в слизистой желудка и начальных отделах кишечника, дистрофические изменения паренхиматозных органов, некротический нефроз, жировая дистрофия в печени, запах ацетона от полостей трупа, органов и содержимого желудка. 4. Изолирование ацетона проводят методом дистилляции с водяным паром. Дистилляция с водяным паром производится в специальном приборе. Исследуемый объект помещают в круглодонную колбу, заполняя последнюю не более чем на 1/3 ее объема. Колбус объектом исследования закрепляют в штативе и погружают в холодную водяную баню. Затем все части прибора соединяют встык. Объект исследования быстро подкисляют до рН 2 – 2,5, немедленно соединяют с заранее нагретым парообразователем и нагревают до кипения водяную баню и парообразователь. Для подкисления используют щавелевую или виннокаменную кислоту. Пропускание пара вместо образования его в самой колбе с объектом исследования важно потому, что при пропускании пара колбу с объектом можно нагревать (чтобы не конденсировались пары) на водяной бане. Образование пара в колбе потребовало бы нагревания при температуре выше 100° на пламени или масляной бане и могло бы повести к разложению веществ на стенках колбы выше уровня воды и даже к образованию следов синильной кислоты за счет подгорания белковых веществ. Дистилляция должна проводиться по возможности медленно, что достигается регулированием пламени горелок. Первый дистиллят, сконденсированный в холодильнике, собирают в объеме 3 мл в заранее приготовленную коническую колбу, содержащую 2 мл 2% раствора едкого натра; остальные дистилляты по 25–50 мл собирают в последующие 1–2 колбы, также подготовленные заранее. Для качественного исследования продукта перегонки с водяным паром в большинстве случаев бывает достаточно собрать 25 мл второго дистиллята. При положительных результатах реакций на то или иное вещество, имеющее токсикологическое значение, дистилляцию продолжают до тех пор, пока дистиллят не перестанет давать соответствующих качественных реакций. Дистилляты подвергают качественному исследованию, а при положительных результатах анализа в них определяют количества найденных веществ. 5. Выбрать методы идентификации и количественного определения токсиканта. 1. Реакция образования йодоформа (имеет (-) с/х значение) При наличии ацетона ощущается характерный запах йодоформа и выпадает микрокристаллический осадок желтого цвета, имеющий характерную форму кристаллов (шестиугольники и звездочки). Реакция неспецифична, положительный результат дают уксусный ангидрид, этиловый спирт. 2. Реакция с фурфуролом . При наличии фурфурола появляется красное окрашивание. Реакция неспецифична, ее дают альдегиды и кетоны. 3. Реакция с натрия нитропруссидом. При наличии ацетона сразу же появляется оранжево-красное окрашивание, которое при добавлении 10 % раствора уксусной кислоты переходит в красно-фиолетовое и вишнево-красное. Реакция не специфична для ацетона, ее дают другие альдегиды и кетоны. Количественное применение: 1. ГЖХ 2. Титрование. Оттитровывается избыток иода (по реакции образования иодоформа) раствором тиосульфата натрия, индикатор – крахмал. Формальдегид 1. газ с острым раздражающим запахом; хорошо растворим в воде; способен к полимеризации (параформальдегид); образуется при неполном сгорании метана, при окислении метилового спирта. LD формалина = 60-90 мл LDформальдегида = 10-30 г Применение: • формалин – 40% раствор формальдегида; • полимеры – параформальдегид, триоксиметилен; • в производстве фенолформальдегидных смол; • в синтезе пластмасс, каучука, лака; • в текстильной промышленности; • для дубления кожи; • консервации анатомических объектов; • протравливание зерна; • используют в синтезе гексаметилентетрамина; • обработка помещений (санация); • дезинфекция. 2. Токсичность: • при ингаляционном отравлении – раздражение верхних дыхательных путей, резкий кашель, стеснение в груди, слезотечение. • при вдыхании высоких концентраций – мгновенная смерть в результате отека и спазма голосовой щели, и в результате паралича дыхательного центра. • при пероральном отравлении – жжение в полости рта, тошнота, рвота, понос, слюнотечение. Симптомы отравления: • некротические поражения слизистой оболочки рта, пищевого канала. • при первичном воздействии на организма вызывает коагуляцию белков, оказывает дубящее, асептическое, дезодорирующее действие, образует ковалентную связь с белками, некроз клеток. • угнетение ЦНС, судороги, потеря сознания. • нефротоксическое действие; • гепатотоксическое действие Помощь при остром отравлении: промывание желудка 0,1 % раствором NH4OH. 3. Метаболизм: Формальдегид выводится из организма частично в неизменном видев. Основная часть его окисляется до более токсичных метанола и муравьиной кислоты, которые в случае выделения через легкие выделяются в виде СO2 и H2O. Объекты исследования: · желудок с содержимым, 12-перстная кишка и часть тощей кишки с содержимым, · печень, · почки, · моча · головной мозг · остатки жидкости, предположительно содержащей формальдегид 4. 1. Реакция с фуксинсернистой кислотой (реактив Шиффа) Реакция проводится в присутствии H2SO4 и при нагревании на водяной бане. Эффект реакции – сине-фиолетовое окрашивание. Раствор иногда окрашивается через 10-15 мин. Окраска может появляться под влиянием окислителей (O2 воздуха, хлор и др.), поэтому появившаяся окраска через 30 мин. не должна рассматриваться как (+) результат реакции. Эта реакция не специфична, ее дают другие альдегиды.  2. Реакция с хромотроповой кислотой Реакцию осуществляют в присутствии H2SO4 и при нагревании на водяной бане. Эффектом реакции является появление сине-фиолетовой окраски раствора. 3. Реакция с резорцином в щелочной среде Проводят реакцию при нагревании в течении 5 минут. Эффект реакции – розово-малиновое окрашивание:  4. Реакция «серебряного зеркала» Протекает в аммиачной среде при нагревании. 5. Колличественное определение формальдегида: 1. Газожидкостная хроматография. Расчёт концентрация формальдегид рекомендуется проводить по высоте или площади пика на хроматограмме, используя в качестве внутреннего стандарта н-пропиловый спирт. При расчётах используют калибровочный коэффициент, который определяет предварительно при калибровке и поверке приборов газового хроматографа. Можно использовать калибровочный график, построены с разными концентрации формальдегида по той же методике. 2. Фотоколориметрический метод. Он основан на получение окрашеного соединение с фуксинсернистой или хромотроповай кислотами с последующим расчётам концентрация формальдегиды в исследуемом объекте по калибровочному графику. 3. Йодометрическое определение формальдегида в дистилляте. Метод основан на окисления формальдегида в определённом объеме дистиллята йодом до муравьиной кислоты (в щелочной среде). К определённый объему дистиллята добавляют точно отмеренный объем титрованного раствора йода. Оставляют на 20 минут. Через 20 минут раствор подкислчют 1 М раствором серной кислоты и выделившийся йод титруют раствором тиосульфатом натрия (индикатор крахмал). Этот метод может быть использован при анализе дистиллятов, не содержащих веществ, реагирующих с йодом. 4. Удаление формальдегида из дистиллята. При обнаружении дистиллята формальдегида, перед проведением реакции на другие «летучий» яды, его удаляют из всего объема дистиллята. С этой целью к дистилляту добавляют 4 мл 10% раствора нитрата серебра и 3% раствор гидроксида натрия до щелочной реакции. Смесь нагревают с обратным холодильником в течение 3-4 минут. Затем дистиллят перегоняю. К части полученного дистиллята добавляют растворы концентрированной серной кислоты и фуксинсернистой кислоты. Сине- фиолетового окрашивание не должна наблюдаться. С полученным раствором (дистиллятом) проводит реакции на «летучие» яды. Фенол C₆H₅OH Применение: в медицинской практике – дезинфекция; в медицине как стабилизатор смеси с крезолами; прижигающее средство; используется для получения многих фармацевтических препаратов; как консервант; в промышленности для производства смолы, асфальта, пластмассы; для производства взрывчатых веществ; средство защиты растений. 2)сильный нервно-протоплазматический яд; наиболее токсична – кожная сорбция; при отравлении – некроз тканей по пути проникновения и выделения, смерть наступает через час; быстро развиваются симптомы поражения ЦНС – потеря сознания, может наступить кома, коллапс, судороги; Жжение и боль в желудке и кишечнике, рвота беловатыми хлопьевидными массами, понос, иногда с примесью крови, ощущается запах фенола изо рта и от рвотных масс. 3) Метаболизм: легко всасывается в ЖКТ, через кожу, в дыхательных путях; связывается с белками крови; метаболизируется ферментными системами печени; фенол является составной частью организма – образуется в результате брожения белковых веществ пищи и в дальнейшем конъюгирует с серной кислотой; до 80% конъюгируют с глюкуроновой и серной кислотами; 10% окисляется до гидрохинона; 10% выделяется в свободном виде 4) Реакция с бромной водой. Выпадают в осадок игольчатые кристаллы, белые хлопья (трибромфенол или дибромфенол) Индофенольная проба – реакция с окислителями. Образуется индофенол сине-фиолетового цвета. Реакция Либермана: образуется индофенол с NaNO2 + H2SO4 синее окрашивание → красное → зеленое Реакция с FeCl3 (свежеприготовленным). Образуется сине-фиолетовое окрашивание, исчезающее от добавления воды, спирта, кислоты. Реакция имеет положительное судебно-химическое значение. Метод микродиффузии. В наружную камеру помещают кровь (или мочу) и добавляют раствор H2SO4. Во внутреннюю камеру вносят 0,1 Н раствор NaOH. Закрывают на 3 часа. Затем из внутренней камеры берут 1 мл раствора и добавляют к нему реактив Фолина – Чиокальто (состав: вольфрамат натрия, молибдат натрия, фосфорная кислота). Образуется синее окрашивание. 5) Количественное определение Броматометрия (при малых количествах); Гравиметрия (при больших количествах). Получают осадок 3 – бромфенола. 3.Крезол C7H8O Применяют при синтезе различных красителей, медицинских препаратов, взрывчатых веществ, дезинфицирующих средств. 2)При смертельном отравлении крезолома слизистые оболочки рта, глотки, пищевода, желудка некротизированы, покрыты темно-серым, иногда черным налетом, складки сглажены, в паренхиматозных органах- дистрофические изменения, кровь в сосудах густая, черно-красная, в легких – пневмония ,головной мозг и мозговые оболочки отечны с точечными кровоизлияниями. 3) Пути метаболизма: Небольшое количество крезолов в организме подвергаются окислению. О-крезолы и м-крезолы образуют диокситолуолы, п-крезол превращается в 3,4-диокситолуол и п-оксибензойную кислоту. Метаболиты и крезолы выделяются из организма почками в виде конъюгантов с серной и глюкуроновой кислотами. Часть крезолов выделяется с выдыхыемым воздухом. 4) Реакция Либермана 1-2 капли раствора вносят в тигель и выпаривают досуха. К сухому остатку прибавляют каплю 1% раствора нитрита натрия в конц серной кислоте. Через несколько минут смесь подщелачивают – появляется синее окрашивание, переходящее в красное, а затем в зеленое. Реакция с реактивом Миллона. К исследуемому раствору добавляют каплю реактива Миллона . Сразу или после нагревания образуется красное окрашивание. Реакция с бензальдегидом . К исследуемому раствору добавляют 2 мл конц серной кислоты и 1-2 капли бензальдегида. При нагревании смеси появляется темно-красное окрашивание, которое при добавлении щелочи переходит в сине-фиолетовое. 5) Количественное определение Броматометрия (при малых количествах); Гравиметрия (при больших количествах). Получают осадок 3 – бромфенола. Этиленгликоль CH2-OH ı CH2-OH Этиленгликоль находит широкое применение в технике в качестве охлаждающего реагента систем охлаждения двигателей и компьютеров, антифризов и тормозных жидкостей. Используется в органическом синтезе, кожевенной, текстильной, табачной, фармацевтической, парфюмерной промышленности. Этиленгликоль токсичен при попадании внутрь- действует повреждающе на ЦНС, обменные процессы, эндотелий сосудов и почек(некронефроз). Выводится из организма очень медленно(от 14 до 50 дней). Смертельная доза – 100мл и больше. При легкой степени отравления у пациента наблюдается состояние похожее на алкогольное опьянение со следующими симптомами: · Заторможенная, несвязная речь. · Головная боль. · Нарушение координации. · Сухость во рту. · Тошнота, рвота, диарея. · Боль в области живота и поясницы. При отравлении тяжелой степени наблюдаются такие симптомы, как: · Потеря сознания. · Нарушение зрения. · Неконтролируемое опорожнение кишечника и мочеиспускание. · Судороги. · Понижение температуры тела. · Характерный запах изо рта. · Поверхностное дыхание, аритмия, нитевидный пульс. Если у пациента имеется подозрение на отравление этиленгликолем (соответствующие симптомы) необходимо принять следующие меры: · Освободить дыхательные пути и обеспечить достаточное количество кислорода. · Провести желудочный дренаж (если прошло <1 часа с момента приема). · Обеспечить обильное питье или введение жидкости внутривенно для лечения гипотонии. · Провести гемодиализ. Он эффективно удаляет этиленгликоль и гликолевую кислоту. Объекты анализа: -жидкости, содержащие этиленгликоль -желудок с содержимым -мозг, печень -почки, моча После поступления этиленгликоля в организм он действует как сосудистый и протоплазматический яд, подавляющий окислительные процессы и вызывающий дегенеративные изменения сосудов. Метаболизм этиленгликоля является сложным. Основной путь метаболизма этого препарата состоит в том, что он окисляется до альдегида гликолевой кислоты НО—СН2—СНО, который дальше окисляется до гликолевой кислоты НО—СН2—СООН, разлагающейся на оксид углерода (IV) и муравьиную кислоту. Часть этиленгликоля в организме превращается в щавелевую кислоту, которая может быть причиной повреждения почек в результате отложения оксалатов в почечных канальцах. Оксид углерода (IV), как метаболит этиленгликоля, выделяется из организма с выдыхаемымвоздухом. Остальные метаболиты и часть неизмененного этиленгликоля выделяется из организма с мочой. Изолирование по В.А. Назаренко и В.Б.Лапкиной К 10 г печени или содержимого желудка прибавляют 5 г кристаллической щавелевой кислоты, смесь растирают до получения тонкой кашицы, переносят в круглодонную колбу 1 вместимостью 100 мл и прибавляют 50 мл бензола. Колбу закрывают вертикально поставленным холодильником 3, снабженным приспособлением 2 для улавливания воды. Затем колбу устанавливают на водяную баню и нагревают. Пары бензола и увлекаемые им вода и этиленгликоль конденсируются в холодильнике и попадают в специальное приспособление. Поскольку в этом приспособлении (насадке) бензол (плотностью 0,879) находится сверху воды, он стекает в колбу. Вода и находящийся в ней этиленгликоль остаются в насадке. После окончания отгонки разбирают прибор и пипеткой из насадки отбирают необходимое для анализа количество жидкости. Качественное обнаружение: 1.Окисление этиленгликоля азотной кислотой и обнаружение щавелевой кислоты. При многократном выпаривании этиленгликоля с азотной кислотой образуется щавелевая кислота, которая с солями кальция образует кристаллы оксалата кальция, имеющие характерную форму. Эти кристаллы в ряде случаев появляются через 2—3 суток. 2. Реакция окисления периодатом калия.К 3—5 мл дистиллята прибавляют 5 капель 12 %-го раствора серной кислоты, 5 капель 5 %-го раствора периодата калия в 5 %-м растворе серной кислоты и взбалтывают. Через 5 мин прибавляют 3—5 капель раствора сернистой кислоты, а затем 4 капли раствора фуксинсернистой кислоты.При наличии этиленгликоля через 3—20 мин появляется красно-фиолетовая или розовая окраска. Количественное определение: -ГЖХ -Фотоколориметрия по реакции образования формальдегида с последующим получением окрашенного соединения с фуксинсернистой кислотой. Бензол С6Н6 Органическое химическое соединение, бесцветная жидкость со специфическим сладковатым запахом. Бензол входит в состав бензина, широко применяется в промышленности, является исходным сырьём для производства лекарств, различных пластмасс, синтетической резины, красителей. Бензол является одним из самых распространённых ксенобиотиков антропогенного происхождения. Бензол сильно ядовит. Минимальная летальная доза при пероральном приеме составляет 15 мл, средняя 50-70 мл. При непродолжительном вдыхании паров бензола не возникает немедленного отравления, поэтому до недавнего времени порядок работ с бензолом особо не регламентировался. В больших дозах бензол вызывает тошноту и головокружение, а в некоторых тяжёлых случаях отравление может повлечь смертельный исход. Первым признаком отравления бензолом нередко бывает эйфория. Пары бензола могут проникать через неповрежденную кожу. Жидкий бензол довольно сильно раздражает кожу. Если организм человека подвергается длительному воздействию бензола в малых количествах, последствия также могут быть очень серьёзными. Бензол является сильным канцерогеном. Исследования показывают связь бензола с такими заболеваниями, как апластическая анемия, острые лейкозы (миелоидный, лимфобластный), хронический миелоидный лейкоз, миелодиспластический синдром и заболевания костного мозга. Существует несколько вариантов механизма трансформации бензола в организме человека. В первом варианте происходит гидроксилирование молекулы бензола микросомальной системой окисления при участии цитохрома P450. Согласно механизму, бензол окисляется сначала до высокореакционного эпоксида, который далее преобразуется в фенол. Помимо этого происходит генерация свободных радикалов (активные формы кислорода), вследствие высокой активации Р450 по реакции: Цит Р450 + NADPH + H- + O2→ Цит Р450 + NADP+ + HOOH. HOOH → 2ОH· C6H6 + ОH·→C6H5OH Бензол является промутагеном, мутагенные свойства он приобретает только после биотрансформации, в результате которой образуются соединения с высокой реакционной способностью. Одним из таких является эпоксид бензола. Вследствие высокого углового напряжения эпоксидного цикла, происходит разрыв связей -С-О-С- и молекула становится электрофилом, она легко вступает в реакцию с нуклеофильными центрами азотистых оснований молекул нуклеиновых кислот, в особенности ДНК. Механизм взаимодействия эпоксидного цикла, с нуклеофильными центрами — аминогруппами азотистых оснований (реакция арилирования) протекает, как реакция нуклеофильного замещения SN2. В результате образуются довольно прочные ковалентно-связанные ДНК-аддукты, наиболее часто такие дериваты наблюдаются у гуанина (так, как молекула гуанина имеет максимальное количество нуклеофильных центров), например, N7-фенилгуанин. Образовавшиеся ДНК-аддукты могут приводить к изменению нативной структуры ДНК, тем самым нарушается правильное протекание процессов транскрипции и репликации. Что является источником генетических мутаций. Накопление эпоксида в гепатоцитах (клетках печени) ведёт к необратимым последствиям: увеличению арилирования ДНК, а вместе с тем и к увеличению экспрессии (сверхэкспрессия) мутантных белков, являющихся продуктами генетической мутации; торможению апоптоза; трансформации клеток и даже гибели. Помимо яркой выраженной генотоксичности и мутагенности, бензол обладает сильной миелотоксичностью и канцерогенной активностью, особенно этот эффект проявляется в клетках миелоидной ткани (клетки данной ткани очень чувствительны к подобному роду воздействиям ксенобиотиков). Острое отравлениеПри очень высоких концентрациях — почти мгновенная потеря сознания и смерть в течение нескольких минут. Окраска лица синюшная, слизистые оболочки часто вишнёво-красные. При меньших концентрациях — возбуждение, подобное алкогольному, затем сонливость, общая слабость, головокружение, тошнота, рвота, головная боль, потеря сознания. Наблюдаются также мышечные подёргивания, которые могут переходить в тонические судороги. Зрачки часто расширены, не реагируют на свет. Дыхание сначала учащено, затем замедлено. Температура тела резко снижается. Пульс учащенный, малого наполнения. Кровяное давление понижено. Известны случаи сильной сердечной аритмии. После тяжёлых отравлений, которые не приводят непосредственно к смерти, иногда наблюдаются длительные расстройства здоровья: плевриты, катары верхних дыхательных путей, заболевания роговицы и сетчатки, поражения печени, сердечные расстройства и т. д. Описан случай вазомоторного невроза с отёком лица и конечностей, расстройствами чувствительности и судорогами через короткое время после острого отравления парами бензола. Иногда смерть наступает спустя некоторое время после отравления. Хроническое отравлениеВ тяжёлых случаях наблюдаются: головные боли, чрезвычайная утомляемость, одышка, головокружение, слабость, нервность, сонливость или бессонница, расстройство пищеварения, тошнота, иногда рвота, отсутствие аппетита, учащение мочеиспускания, менструаций, нередко развиваются упорные кровотечения из слизистой оболочки рта, особенно дёсен, и носа, длящиеся часами и даже сутками. Иногда упорные кровотечения наблюдаются после удаления зуба. Многочисленные мелкие геморрагии (кровоизлияния) в коже. Кровь в испражнениях, маточные кровотечения, кровоизлияния в сетчатку. Обычно именно кровотечения, а часто и сопутствующая им лихорадка (температура до 40° и выше) приводят отравленных в больницу. В подобных случаях прогноз всегда серьёзен. Причиной смерти иногда являются вторичные инфекции: известны случаи гангренозного воспаления надкостницы и некроза челюсти, тяжёлых язвенных воспалений дёсен, общего сепсиса с септическим эндометритом. Иногда при тяжёлых отравлениях развиваются симптомы нервных заболеваний: повышение сухожильных рефлексов, двусторонний клонус, положительный симптом Бабинского, расстройство глубокой чувствительности, псевдотабетические расстройства с парестезиями, атаксией, параплегией и двигательными нарушениями (признаки поражения задних столбов спинного мозга и пирамидных путей). Явления отравления могут сохраняться и даже прогрессировать через месяцы и годы после прекращения работы с бензолом. Первая помощь при отравлении и лечениеПри остром отравлении бензолом (парами бензола) пострадавшего необходимо в первую очередь вынести на свежий воздух, в случае остановки дыхания проводят искусственное дыхание до нормализованного, в качестве стимуляторов дыхания применяют кислород и лобелин. Применение адреналина в качестве аналептика категорически запрещено! При возникновении рвоты внутривенно 40% раствор глюкозы, в случае нарушения кровообращения — инъекцию раствора кофеина. Если отравление произошло перорально и бензол попал в желудок, необходимо промыть его с помощью растительного масла (хорошо абсорбирует бензол), процедуру следует проводить с осторожностью, так как возможна аспирация. При лёгких отравлениях больному показан покой. При возбуждённых состояниях необходимы седативные средства. При возникновении анемии проводят переливания крови, витамин B12, фолиевая кислота, при лейкопении — витамин B6, пентоксил. В случае снижения иммунитета (иммунодефицитное состояние) — иммуностимуляторы. Ключевыми реакциями, используемыми для дериватизации бензола являются следующие: 1. Электрофильное замещение водорода в бензоле и его производных. 2. Нуклеофильное замещение в бензоле и его производных. 3. Радикальные процессы. 1. Броматометричексий метод. Метод обратного титрования в кислой среде. Индикатор крахмал.  2. Йодометрический. Способ прямого титрования в гидрокарбонатной среде. Индикатор крахмал. 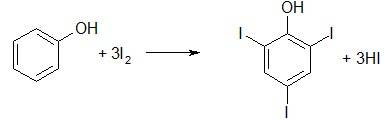 Для нейтрализации выделяющейся йодоводородной кислоты используют гидрокарбонат натрия. 3.Йодохлорметрический. Способ по избытку. Индикатор крахмал: 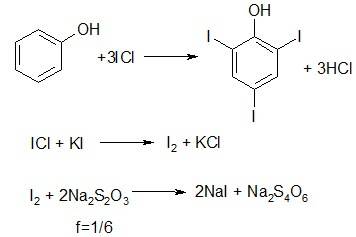 4. Фотоэлектроколориметрический. Основан на образовании окрашенного соединения при взаимодействии фенола с 4-аминоантипирином. Количество определяют по калибровочному графику. Толуол C₆H₅-CH₃ Применяется как растворитель для многих органических веществ и полимеров, входит в состав различных товарных растворителей для лаков и красок Симптомы острого отравления: эйфория, спутанность сознания, усталость, головная боль, тошнота, нарушение координации и зрения, потеря самоконтроля и через несколько дней после воздействия стойкая нервозность, бессонница, мышечная слабость, истощение, потеря памяти. Симптомы хронического отравления: Развивается почечный канальцевый ацидоз, поражение центральной нервной системы характеризуется раздражимостью, бессонницей, головными болями, тремором и парестезией. Также часто наблюдаются анорексия и тошнота. Метаболизм. Толуол попадает в организм главным образом через дыхательные пути и, в меньшей степени, через кожу. Он проникает через альвеолярный барьер при смеси кровь/воздух в соотношении от 11,2 до 15,6 в Соотношение содержания толуола в тканях и крови составляет 1:3, за исключением богатых жиром тканей, где пропорция имеет вид 80:100. Затем в микросомах печени происходит окисление боковых цепочек толуола (микросомная монооксигенация). Наиболее важным продуктом этого преобразования, которому подвергается приблизительно 68% поглощенного толуола, является гиппуровая кислота (ГК), которая выделяется почками в мочу главным образом в проксимальных канальцах. Небольшие количества о-крезола (0.1 %) и п-крезола (1 %), которые являются результатом окисления ароматических ядер, могут также быть обнаружены в моче, на что указано в главе "Биологический мониторинг" данной Энциклопедии. Период полувыделения из организма ГК очень короток и составляет от 1 до 2 часов. Уровень толуола в выдыхаемом воздухе имеет порядок 18 В печени одна и та же ферментативная система окисляет толуол, стирол и бензол. Поэтому эти три вещества замедляют метаболизацию друг друга, конкурируя между собой. Так например, если крысы получают большие дозы толуола и бензола, в их тканях и моче отмечается сокращение концентрации метаболитов бензола, и, соответственно, увеличивается содержание бензола в выдыхаемом воздухе. В случае трихлорэтилена, замедления не происходит, поскольку эти два вещества окисляются разными ферментами. Одновременное воздействия приведет к уменьшению содержания ГК и появлению трихлор- соединений в моче. Абсорбция толуола будет выше при нагрузке, чем в спокойном состоянии. При нагрузке 50 ватт концентрация в артериальной крови и в альвеолярном воздухе оказалась в два раза выше, чем в состоянии покоя. Химические свойстваДля толуола характерны реакции электрофильного замещения в ароматическом кольце и замещения в метильной группе по радикальному механизму. Электрофильное замещение в ароматическом кольце идёт преимущественно в орто- и пара-положениях относительно метильной группы. Кроме реакций замещения, толуол вступает в реакции присоединения (гидрирование), озонолиза. Некоторые окислители (щелочной раствор перманганата калия, разбавленная азотная кислота) окисляют метильную группу до карбоксильной. Температура самовоспламенения 535 °C. Температура вспышки 4 °C. При взаимодействии толуола с сильными окислителями образуется бензойная кислота: Взаимодействие с перманганатом калия в кислой среде: 5C6H5CH3 + 6KMnO4 + 9H2SO4 → → 5C6H5COOH + 6MnSO4 + 3K2SO4 + 14H2O Взаимодействие с перманганатом калия в нейтральной среде C6H5CH3 + 2KMnO4 → C6H5COOK + 2MnO2 + KOH + H2O Взаимодействие с галогенами на свету C6H5CH3 + X2 →hν C6H5CH2X + HX Количественное определение: Газохроматографический метод Нитробензол   1. Применяется как растворитель и мягкий окислитель. В основном используется как прекурсор для производства анилина. Производные нитробензола используются в качестве взрывчатых веществ и как компоненты ракетных топлив. В парфюмерии — в качестве душистых или фиксирующих запах веществ, в том числе — искусственных мускусов. Сам нитробензол ранее выпускали под названием «горько-миндального» или «мирабанового» масла. Некоторые производные нитробензола используются в составе лаков и красок. Нитробензол (нитробензоин) — в медицине предложен для наружного употребления исключительно против чесотки, но, ввиду чрезвычайной ядовитости, Н. не вошел во врачебную практику. 2. Нитробензол токсичен: относится ко второму классу опасности и в больших концентрациях может вызывать гемолиз. Впитывается через кожу, оказывает сильное действие на ЦНС, нарушает обмен веществ, вызывает заболевания печени, окисляет гемоглобин в метгемоглобин. При острой интоксикации необходимо вынести пострадавшего из помещения, сменить одежду в случае ее пропитывания Нитробензолом, обмыть кожу теплой водой с мылом. Пострадавшему дают вдыхать средства, возбуждающие сердечно-сосудистую систему и дыхание (кислород и карбоген). В условиях стационара проводят обхменное переливание крови, при необходимости делают искусственное дыхание, назначают сердечные и сосудистые средства, в случае судорог — противосудорожные препараты. При хроническом отравлении, протекающем с явлениями поражения ц. н. с., рекомендуются солянохвойные ванны, циркулярный душ, препараты кальция, при поражении печени— симптоматические средства. 3. Попадает в организм через органы дыхания, хорошо всасывается через кожу. Отравления как острые, так и хронические возникают при нарушении технологического процесса, а также правил техники безопасности. Употребление алкогольных напитков усиливает чувствительность к Н.При отравлении Нитробензолом на вскрытии обнаруживают, что внутренние органы и кровь окрашены в темно-бурый цвет. В ряде случаев от трупа исходит свойственный Н. ароматический запах горького миндаля. В жидкой крови определяют большие количества метгемоглобина. При гистологическом исследовании выявляют выраженные дистрофические изменения в печени и почках, отложения гемосидерина в селезенке; в головном мозге обнаруживают признаки нарушения кровообращения, периваскулярный и перицеллюлярный отек. Профилактика отравлений Н. заключается в герметизации оборудования, а также контроле за содержанием Н. в воздушной среде (проводят отбор проб воздуха в нит-рационную смесь с последующихм фотометрическим определением Н. в эфирно-ацетоновой среде). Обязательна защита кожи (использование спецодежды, перчаток, мазей и т. д.). К работе с Нитробензолом не допускаются лица с заболеваниями нервной системы, печени и почек, с анемией, беременные женщины. Работающие с Нитробензолом подвергаются периодическим медосмотрам. 4. В качестве изолирующего агента для извлечения нитробензола из биологического материала использован толуол. 5. Качественный анализ: Перевод в динитробензол (чувствительность 0, 5 мг в дистилляте). Фиолетовое окрашивание ; Восстановление до анилина ( П. О. 0, 4 мг в объеме дистилляте ). Количественное определение: колориметрия и полярометрия. Анилин  По состоянию на 2002 год, в мире основная часть производимого анилина используется для производства метилдиизоцианатов, используемых затем для производства полиуретанов. Анилин также используется при производстве искусственных каучуков, гербицидов и красителей (фиолетового красителя мовеина). В России он в основном применяется в качестве полупродукта в производстве красителей, взрывчатых веществ и лекарственных средств (сульфаниламидные препараты), но в связи с ожидаемым ростом производства полиуретанов возможно значительное изменение картины в среднесрочной перспективе. 2. При лёгком отравлении анилином наблюдаются слабость, головокружение, головная боль, синюшность губ, ушных раковин и ногтей. При отравлениях средней тяжести также наблюдаются тошнота, рвота, иногда, шатающаяся походка, учащение пульса. Тяжёлые случаи отравления аминобензолом крайне редки. При хроническом отравлении анилином (анилизм) возникают токсический гепатит, а также нервно-психические нарушения, расстройство сна, снижение памяти и т. д. При отравлении анилином необходимо прежде всего удаление пострадавшего из очага отравления, обмывание тёплой (но не горячей!) водой. Также применяют введение антидотов (метиленовая синь), сердечно-сосудистые средства или вдыхание карбогена. Пострадавшему надо обеспечить покой. 3. Анилин — высокотоксичное вещество. В больших концентрациях фениламин оказывает негативное воздействие на центральную нервную систему. Кровеносный яд, вызывает кислородное голодание организма за счёт образования в крови метгемоглобина, гемолиза и дегенеративных изменений эритроцитов. В организм анилин проникает при дыхании, в виде паров, а также через кожу и слизистые оболочки. Всасывание через кожу усиливается при нагреве воздуха или приёме алкоголя. Патологоанатомическая картина резко синюшное окрашивание кожи и серо-фиолетовый цвет трупных пятен. Многочисленные кровоизлияния во внутренних органах, слизистая оболочка желудка, набухшая, гипереми-рованная. Вены в паралитическом состоянии, переполнены темной кровью без сгустков. Канальцы почек закупорены гемоглобином. Дегенеративные изменения в паренхиматозных органах, главным образом в почках. 4. Изолирование производится перегонкой с водяным паром. Наименьшие количества анилина, которые можно изолировать этим путем из биоматериала, составляют 4—5 мг на 100 г объекта исследования. 5. Анилин, изолированный из биологического объекта перегонкой с водяным паром, хорошо обнаруживается реакцией с облученным раствором нитропруссида натрия в полученном дистилляте. Методика реакции сводится к прибавлению к 1 мл дистиллята нескольких капель 2°/о раствора карбоната натрия (до щелочной реакции на лакмус) и 1 мл приготовленного описанным выше способом 1% раствора нитропруссида натрия. В присутствии анилина в количестве более 50 у в- 1 мл через несколько секунд появляется синее окрашивание. С помощью этой реакции можно обнаружить 20 у анилина в 1 мл дистиллята. При такой концентрации анилина окраска наступает через 5—10 минут. При меньшей концентрации анилина в дистилляте окраска может также появиться, но через больший промежуток времени. Реакция с бихроматом калия. .Образование триброманилина. Образование азокрасителя. .Образование индофенола Для количественного определения анилина наиболее часто используются общеизвестный броматометрический метод и метод диазотирования и образования азокраски. Описаны также различные модификации колориметрического определения анилина по образованию индофенола и объемный метод, основанный на взаимодействии анилина с роданидом аммония в присутствии сульфата меди. |
