лекция переваривание углеводов. Обмен липидов Термин липиды
 Скачать 277.36 Kb. Скачать 277.36 Kb.
|
|
Обмен липидов Термин «липиды» объединяет вещества, обладающие общим физическим свойством — гидрофобностью, то есть нерастворимостью в воде. Липиды разделяют на классы, в которые объединяют молекулы, имеющие сходное химическое строение и общие биологические свойства. Основную массу липидов в организме составляют жиры — триацилглицеролы, служащие формой депонирования энергии. Жиры располагаются преимущественно в подкожной жировой ткани и выполняют также функции теплоизоляционной и механической защиты. Фосфолипиды — большой класс липидов, получивший своё название из-за остатка фосфорной кислоты, придающего им свойства амфифильности. Благодаря этому свойству фосфолипиды формируют бислойную структуру мембран, в которую погружены белки. Клетки или отделы клеток, окружённые мембранами, отличаются по составу и набору молекул от окружающей среды, поэтому химические процессы в клетке разделены и ориентированы в пространстве, что необходимо для регуляции метаболизма. Стероиды, представленные в животном мире холестеролом и его производными, выполняют разнообразные функции. Холестерол — важный компонент мембран и регулятор свойств гидрофобного слоя. Производные холестерола (жёлчные кислоты) необходимы для переваривания жиров. Стероидные гормоны, синтезируемые из холестерола, участвуют в регуляции энергетического, водно-солевого обменов, половых функций. Кроме стероидных гормонов, многие производные липидов выполняют регуляторные функции и действуют, как и гормоны, в очень низких концентрациях. Например, тромбоцитактивирующий фактор — фосфолипид особой структуры — оказывает сильное влияние на агрегацию тромбоцитов в концентрации 10-12 М; эйкозаноиды, производные ненасыщенных жирных кислот (арахидоновой кислоты), вырабатываемые почти всеми типами клеток, вызывают разнообразные биологические эффекты в концентрациях не более 10-9 М. В тканях организма количество разных классов липидов существенно различается. В жировой ткани жиры составляют до 75 % сухого веса. В нервной ткани липидов содержится до 50 % сухого веса, основные из них фосфолипиды и сфингомиелины (30 %), холестерол (10 %), ганглиозиды и цереброзиды (7 %). В печени общее количество липидов в норме не превышает 10-13 %. Переваривание и всасывание Триацилглицериды (триацилглицеролы) (ТАГ) или просто жиры поступают в организм с пищей животного и растительного происхождения. В большом количестве они содержатся в сале, растительном и сливочном масле, мясе, куриных яйцах, печени. В ротовой полости и желудке переваривание не идет из-за отсутствия ферментов. В 12-перстную кишку тонкого отдела кишечника с соком поджелудочной железы поступает липаза в виде неактивной формы – пролипазы. С желчью туда же поступают желчные кислоты, под действием которых липаза активируется. Желчные кислоты ориентируются на каплях жира, что приводит к уменьшению поверхностного натяжения и дроблению их на более мелкие (желчь эмульгирует жиры). Высвобождающиеся жирные кислоты (ЖК) усиливают эмульгирование жиров. Желчные кислоты образуют комплекс с ЖК и моноацилглицеридами, который легко проникают в клетки слизистой оболочки кишечника. В толще слизистой желчные кислоты отщепляются от ЖК и с портальным кровотоком поступают обратно в печень, где вновь включаются в состав желчи. Основная часть всосавшихся в тонком кишечнике липидов принимает участие в ресинтезе триацилглицеридов. Для этого в эндоплазматическом ретикулуме энтероцитов работают специальные ферменты Из кишечника ЖК транспортируются по лимфе и крови к органам и тканям. Поскольку эти вещества гидрофобны, то они переносятся по крови в комплексе с белками, образуя липопротеиды (хиломикроны, липопротеиды низкой плотности (ЛПНП), липопротеиды очень низкой плотности, (ЛПОНП), липопротеиды высокой плотности (ЛПВП)). Катаболизм липидов Катаболизм липидов - совокупность всех катаболических процессов липидов, включающая несколько стадий: Липолиз Окисление жирных кислот Окисление кетоновых тел Перекисное окисление липидов Липолиз Липолиз или мобилизация жира – катаболический процесс, гормонзависимый распад ТАГ (триацилглицеролы) в жировой ткани или резервных ТАГ в самой клетке. Синтезируясь во время и сразу после приема пищи (липогенез) и запасаясь в жировой ткани, ТАГ являются формой хранения насыщенных и мононенасыщенных жирных кислот. Липолиз идет в жировых клетках постоянно и обычно существует равновесие между синтезом и распадом ТАГ. Даже в состоянии покоя организма печень, сердце, скелетные мышцы и другие ткани (кроме эритроцитов и нейроцитов) более 50% энергии получают из окисления жирных кислот, поступающих из жировой ткани благодаря липолизу. По мере уменьшения резервов глюкозы клетки все больше энергии получают из окисления жирных кислот. Таким образом, насыщенные жирные кислоты выполняют роль своеобразного резерва энергии в организме. Мобилизация триацилглицеролов и окисление жирных кислот активируется при нормальных физиологических стрессовых ситуациях – эмоциональный стресс, мышечная работа, голодание, при патологических состояниях – сахарный диабет I типа, другие гормональные заболевания (гиперкортицизм, гипертиреоз). В результате стимулированного липолиза в адипоцитах образуются свободный глицерол и жирные кислоты. Глицерол с кровью доставляется в печень и почки, здесь фосфорилируется и окисляется в метаболит гликолиза диоксиацетонфосфат. В зависимости от условий ДАФ может включаться в реакции глюконеогенеза (при голодании, мышечной нагрузке) или окисляться в реакциях гликолиза. Жирные кислоты транспортируются в крови в комплексе с альбуминами плазмы: при физической нагрузке – в мышцы, в обычных условиях и при голодании – в мышцы и большинство тканей, однако при этом около 30% жирных кислот захватывается печенью. При голодании и физической нагрузке после проникновения в клетки жирные кислоты вступают на путь β-окисления. Окисление высших жирных кислот (-окисление) Во многих тканях окисление жирных кислот (ЖК) — важный источник энергии. Это ткани с высокой активностью ферментов ЦТК и дыхательной цепи - клетки красных скелетных мышц, сердечная мышца, почки. Эритроциты, в которых отсутствуют митохондрии, не могут окислять жирные кислоты. Жирные кислоты не служат источником энергии для мозга и других нервных тканей, так как жирные кислоты не проходят через гематоэнцефалический барьер, как и другие гидрофобные вещества. В экспериментах показано, что скорость обмена жирных кислот в нервной ткани существенно меньше, чем в других тканях. Большинство тканей, кроме нервной, эритроцитов (в которых отсутствуют митохондрии), используют жирные кислоты как источник энергии. Жирные кислоты, проникающие из крови в клетку вовлекаются в процесс -окисления. Он протекает в митохондриях и начинается с активации, т.е. присоединения КоА (коэнзим А) к ЖК с образованием ацил-КоА (ацил коэнзим А), (активированная жирная кислота). RCOOH + HSKoA + АТФ = RCO-SКoA + АМФ + РРi ЖК коэнзим А ацил-КоА остаток фосфорной кислоты Мембрана митохондрий непроницаема для ЖК даже в активированной форме, поэтому ацил-КоА соединяется со специальным переносчиком карнитином. Образуется ацилкарнитин, который проникает в митохондрии, где вновь распадается на карнитин и ацил-КоА. Процесс -окисления включает 4 стадии. Рис.1. Схема процесса -окисления 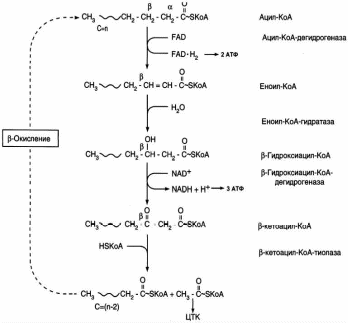 дегидрирование ацил-КоА до дегидроацил-КоА с участием ФАД-зависимой дегидрогеназы; гидратация - присоединение к дегидроацил-КоА воды в -положении с образованием гидрооксиацил-КоА при участии гидратазы; дегидрирование гидрооксиацил-КоА до b-кетоацил-КоА при участии НАД-зависимой дегидрогеназы; расщепление тиосвязи при участии тиолазы с образованием ацил-КоА и ацетил-КоА. В реакциях дегидрирования на 1 и 3 стадиях образуются восстановленные коферменты, которые передают атомы водорода на ЭТЦ, где синтезируется АТФ. Каждая ЖК при очередном цикле распадается на ацил- и ацетил-КоА, при этом цепь укорачивается на два углеродных атома. Ацетил-КоА поступает в ЦТК, а ацил-КоА (укороченный на 2 углеродных атома) вновь проходит все 4 стадии. Это повторяется до тех пор, пока в последнем цикле не останется жирная кислота из 4 атомов углерода, при окислении которой образуются 2 молекулы ацетил-КоА, а не 1, как в предыдущих. Из ЖК образуется ацетил-КоА в два раза меньше, чем количество атомов углерода в ней. Общий энергетический баланс окисления моля жирной кислоты будет зависеть от длины углеводородной цепи. Рассчитать можно по формуле: [ (n/2-1)*5+n/2*12] -1 где n – число атомов углерода в молекуле жирной кислоты n/2-1 –количество циклов -окисления; 5 – количество молей АТФ, образующееся за 1 цикл -окисления n/2 - количество молей ацетил-КоА; 12 - количество АТФ, образующееся при окислении 1 моля ацетил-КоА в цикле Кребса 1 – количество АТФ, используемое на активацию жирной кислоты. Кетоновые тела Печень обладает способностью ферментативным путем превращать ацетил-КоА в свободную ацетоуксусную кислоту (при конденсации 2-х молекул ацетил-КоА) и эфир b-оксимасляной кислоты. Они доставляются кровью к периферическим органам и тканям, где включаются в ЦТК (энергетический материал). При длительном голодании кетоновые тела становятся основным источником энергии для скелетных мышц, сердца и почек (печень не может использовать кетоновые тела в качестве энергетического материала). Таким образом, глюкоза сохраняется для окисления в мозге и эритроцитах. Уже через 2-3 дня после начала голодания концентрация кетоновых тел в крови достаточна для того, чтобы они проходили в клетки мозга и окислялись, снижая его потребности в глюкозе. В норме кетоновых тел содержится немного. Увеличение этого показателя наблюдается при голодании и сахарном диабете и называется кетоз. В крови – кетонемия, в моче – кетонурия. Анаболизм липидов Биосинтез жирных кислот Реакции синтеза жирных кислот катализируются ферментным комплексом – синтазой жирных кислот или пальмитатсинтазой. Конечным продуктом синтеза является пальмитиновая кислота (С16:0), из которой образуются другие насыщенные и мононенасыщенные кислоты. Протекает в цитоплазме клеток и включает следующие реакции: карбоксилировние ацетил-КоА до малонил-КоА (фермент карбоксилаза, кофермент – биотин (витамин Н));  Реакция образование малонил-КоА из ацетил-КоА. 2. соединение ацетил-КоА и малонил-КоА с ацилпереносящими белками (АПБ); 3. конденсация ацетил-КоА и малонил-КоА с образованием комплекса ацетоацетил-ацилпереносящий белок (ацетоацетил -АПБ); 4. восстановление кетоновых групп до спиртовых (кофермент - НАДФН); 5. отщепление воды (дегидратация) с образованием ненасыщенной связи; 6. восстановление (насыщение двойной связи), при этом образуется бутирил-КоА (кофермент - НАДФН). Бутирил-КоА вступает в новый цикл, где удлиняется на 2 атома углерода. Циклы повторяются до получения необходимой длины цепи.  Этапы синтеза пальмитиновой кислоты Синтез нейтральных липидов (ТАГ) Триацилглицеролы синтезируются на основе глицерофосфата (производное глицерола) и ацил-КоА (активированная жирная кислота). Вначале присоединяется два ацила, а затем под действием фосфатазытеряется остаток фосфата и присоединяется третий ацил. Биосинтез стероидов Холестерол синтезируется на основе ацетил-КоА. Около 80% в печени, 10 % в клетках кишечника и 5% в клетках кожи. Около 93% стероида входит в состав мембран и 7% находится в жидкостях организма. Холестерол увеличивает микровязкость мембран и снижает их проницаемость для Н2О и водорастворимых веществ. В крови он представлен в виде свободного холестерола, входящего в оболочку липопротеинов, и его эфиров, которые вместе с ТАГ составляют внутреннее содержимое этих частиц. Холестерол является предшественником всех стероидов животного организма: жёлчных кислот; стероидных гормонов: кортикостероидов, образующихся в корковом слое надпочечников, андрогенов — в семенниках и эстрогенов — в яичниках; витамина D3, синтезирующегося в коже под действием УФ-излучения. Синтез и утилизация кетоновых тел Под термином «кетоновые тела» подразумевают следующие соединения: ацетоуксусная кислота (ацетоацетат), β-гидроксимасляная кислота (β-гидроксибутират), ацетон. Синтез их происходит в митохондриях печени из ацетил-КоА.  Рис.2. Реакции синтеза кетоновых тел. Синтез кетоновых тел в организме усиливается при ускоренном катаболизме жирных кислот (голодание, сахарный диабет). В этих условиях в печени имеется дефицит оксалоацетата, образующегося преимущественно в реакциях углеводного обмена. Поэтому затрудняется взаимодействие ацетил-КоА с оксалоацетатом и все последующие реакции цикла трикарбоновых кислот Кребса. Ацетоуксусная и β-гидроксимасляная кислоты, которые относятся к кетоновым телам, являются сильными кислотами. Поэтому накопление их в крови приводит к сдвигу рН в кислую сторону (метаболический ацидоз). Кетоновые тела как источник энергии используют миокард, лёгкие, почки, скелетные мышцы, даже головной мозг (при длительном голодании). Утилизация кетоновых тел осуществляется следующим образом:  Рис. 3. Реакции утилизации кетоновых тел. Образующийся ацетил-КоА окисляется в цикле Кребса. Энергетический баланс окисления ацетоацетата до конечных продуктов составляет 23 молекулы АТФ, полного окисления β-гидроксибутирата - 26 молекул АТФ. Печень не использует кетоновые тела в качестве энергетического материала. Углеводы и их обмен. Углеводы– это органические соединения с общей эмпирической формулой Сn(Н2О)n. Углеводы бывают простыми и сложными. По количеству мономеров все углеводы делят на: моно-, ди-, олиго- и полисахариды К простым углеводам относят моносахариды, наиболее важные из них: глюкоза - важнейшний субстрат для получения энергии в организме рибоза (входит в состав РНК),дезоксирибоза (входит в состав ДНК) По количеству атомов углерода моносахариды делятся на триозы, тетрозы, пентозы, гексозы и т.д. К сложным углеводам относят дисахариды, олигосахариды и полисахариды: Дисахариды содержат 2 остатка моносахаридов (глюкоза, галактоза, фруктоза). Все они потребляются с пищей для получения глюкозы. Олигосахариды содержат от 2 до 10 остатков моносахаридов. Полисахариды содержат 10 и более остатков моносахаридов. В зависимости от набора моносахаридов полисахариды подразделяются на гомополисахариды (содержат одинаковые моносахариды) и гетерополисахариды (содержат различные моносахариды) К полисахаридам относятся крахмал, гликоген и целлюлоза. Крахмал - запасной углевод для клеток растений, гликоген - для клеток животных, целлюлоза - входит в состав клеточных стенок растений. Функции углеводов Моносахариды – углеводы, которые не гидролизуются до более простых углеводов. Моносахариды: выполняют энергетическую функцию (образование АТФ). выполняют пластическую функцию (участвуют в образовании ди-, олиго-, полисахаридов, аминокислот, липидов, нуклеотидов). выполняют детоксикационную функцию (производные глюкозы, глюкурониды, участвуют в обезвреживании токсичных метаболитов и ксенобиотиков). являются фрагментами гликолипидов (цереброзиды). Дисахариды – углеводы, которые гидролизуются на 2 моносахарида. У человека образуется только 1 дисахарид - лактоза. Лактоза синтезируется при лактации в молочных железах и содержится в молоке. Она: является источником глюкозы и галактозы для новорожденных; участвует в формировании нормальной микрофлоры у новорожденных. Олигосахариды – углеводы, которые гидролизуются на 3 - 10 моносахаридов. Олигосахариды являются фрагментами гликопротеинов (ферменты, белки-транспортёры, белки-рецепторы, гормоны), гликолипидов (глобозиды, ганглиозиды). Они образуют на поверхности клетки гликокаликс. Полисахариды – углеводы, которые гидролизуются на 10 и более моносахаридов. Гомополисахариды выполняют запасающую функцию (гликоген – форма хранения глюкозы). Гетерополисахариды (ГАГ) являются структурным компонентом межклеточного вещества (хондроитинсульфаты, гиалуроновая кислота), участвуют в пролиферации и дифференцировке клеток, препятствуют свертыванию крови (гепарин). Переваривание углеводов (ферментативный гидролиз). Перевариваниеэто процесс гидролиза веществ до их ассимилируемых форм. Переваривание бывает: 1). Внутриклеточное (в лизосомах); 2). Внеклеточное (в ЖКТ): а) полостное (дистантное); б) пристеночное (контактное). Переваривание углеводов в ротовой полости (полостное) В ротовой полости пища измельчается при пережёвывании и смачивается слюной. Слюна состоит на 99% из воды и обычно имеет рН 6,8. В слюне присутствует эндогликозидаза α-амилаза (α-1,4-гликозидаза),расщепляющая в крахмале внутренние α-1,4-гликозидные связи с образованием крупных фрагментов — декстринов и небольшого количества мальтозы и изомальтозы. Необходим ион Cl- . Переваривание углеводов в желудке (полостное) Действие амилазы слюны прекращается в кислой среде (рН <4) содержимого желудка, однако, внутри пищевого комка активность амилазы может некоторое время сохраняться. Желудочный сок не содержит ферментов, расщепляющих углеводы, в нем возможен лишь незначительный кислотный гидролиз гликозидных связей. Переваривание углеводов в тонком кишечнике (полостное и пристеночное) В двенадцатиперстной кишке кислое содержимое желудка нейтрализуется соком поджелудочной железы (рН 7,5—8,0 за счет бикарбонатов). С соком поджелудочной железы в кишечник поступает панкреатическая α-амилаза. Эта эндогликозидаза гидролизует внутренние α-1,4-гликозидные связи в крахмале и декстринах с образованием мальтозы (2 остатка глюкозы, связанные α-1,4-гликозидной связью), изомальтозы (2 остатка глюкозы, связанные α-1,6-гликозидной связью) и олигосахаридов, содержащих 3—8 остатков глюкозы, связанных α-1,4- и α-1,6-гликозидными связями. Переваривание мальтозы, изомальтозы и олигосахаридов происходит под действием специфических ферментов - экзогликозидаз, образующих ферментативные комплексы. Эти комплексы находятся на поверхности эпителиальных клеток тонкого кишечника и осуществляют пристеночное пищеварение (Сахаразо-изомальтазный комплекс,Гликоамилазный комплекс,β-Гликозидазный комплекс (лактаза) гидролизует β-1,4-гликозидные связи в лактозе, Трегалаза (гидролизует α-1,1-гликозидные связи между глюкозами в трегалозе — дисахариде грибов)). Моносахариды всасываются эпителиальными клетками тощей и подвздошной кишок. Транспорт моносахаридов в клетки слизистой оболочки кишечника может осуществляться путём диффузии (рибоза, ксилоза, арабиноза), облегчённой диффузии с помощью белков переносчиков (фруктоза, галактоза, глюкоза), и путем вторично-активного транспорта (галактоза, глюкоза). Вторично-активный транспорт галактозы и глюкозы из просвета кишечника в энтероцит осуществляется симпортом с Na+ . Через белок-переносчик Na+ двигается по градиенту своей концентрации и переносит с собой моносахариды против их градиента концентраций. Из крови в клетки глюкоза поступает путём облегчённой диффузии с помощью белков-переносчиков - ГЛЮТов. Метаболизм моносахаридов в клетке После всасывания в кишечнике глюкоза и другие моносахариды поступают в воротную вену и далее в печень. Моносахариды в печени превращаются в глюкозу или продукты её метаболизма. Часть глюкозы в печени депонируется в виде гликогена, часть идет на синтез новых веществ, а часть через кровоток, направляется в другие органы и ткани. При этом печень поддерживает концентрацию глюкозы в крови на уровне 3,3-5,5 ммоль/л. Метаболизм гликогена Многие ткани в качестве резервной формы глюкозы синтезируют гликоген. Синтез и распад гликогена в печени поддерживают гомеостаз глюкозы в крови. Гликоген— разветвлённый гомополисахарид глюкозы с массой >107 Да (50000 остатков глюкозы), в котором остатки глюкозы соединены в линейных участках α-1,4-гликозидной связью, точках ветвления, примерно через каждые 10 остатков глюкозы, мономеры соединены α-1,6-гликозидными связями. Гликоген, водонерастворим, хранится в цитозоле клетки в форме гранул. Гликоген депонируется главным образом в печени (до 5%) и скелетных мышцах (до 1%). Разветвлённая структура гликогена способствует работе ферментов, отщепляющих или присоединяющих мономеры. Синтез гликогена (гликогеногенез) Гликоген синтезируется с затратой энергии в период пищеварения (через 1—2 ч после приёма углеводной пищи). 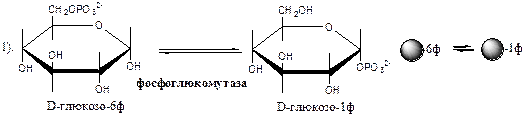 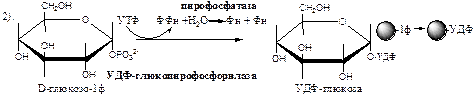 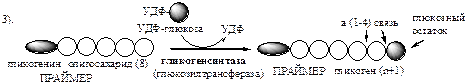 Синтез гликогена осуществляется путём удлинения уже имеющейся молекулы полисахарида, называемой «затравка», или «праймер». В состав праймера может входить белок гликогенин, в котором к Тир присоединен олигосахарид (примерно из 8 остатков глюкозы). Глюкозные остатки переносятся гликогенсинтазой на нередуцирующий конец олигосахарида и связываются α-1,4-гликозидными связями. 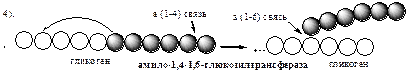 При удлинении линейного участка примерно до 11 глюкозных остатков, фермент ветвления переносит её концевой блок, содержащий 6—7 остатков, на внутренний остаток глюкозы этой или другой цепи с образованием α-1,6-гликозидной связи. Новая точка ветвления образуется на расстоянии не менее 4 остатков от любой уже существующей точки ветвления. Распад гликогена (гликогенолиз) Распад гликогена происходит путем последовательного отщепления глюкозо-1-ф в ответ на повышение потребности организма в глюкозе. Реакцию катализирует гликогенфосфорилаза:  Удаление ветвления осуществляет деветвящий фермент. Он обладает трансферазной и гликозидазной активностями. 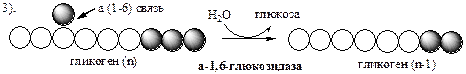 Регуляция метаболизма гликогена в печени 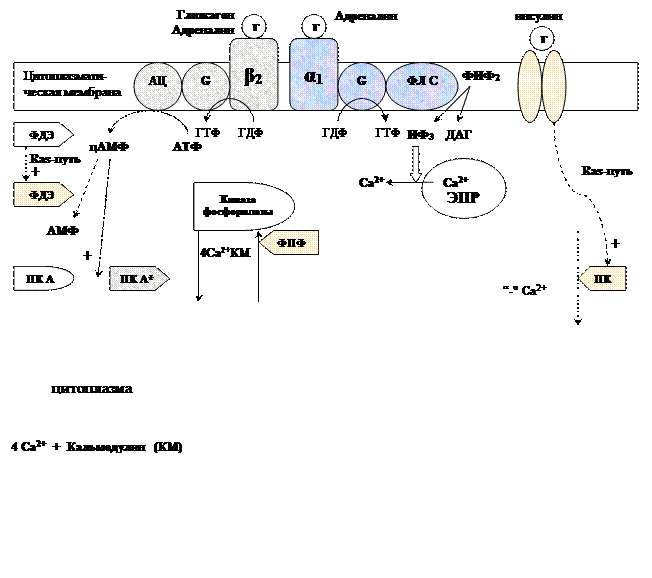 Регуляция метаболизма гликогена в мышцах 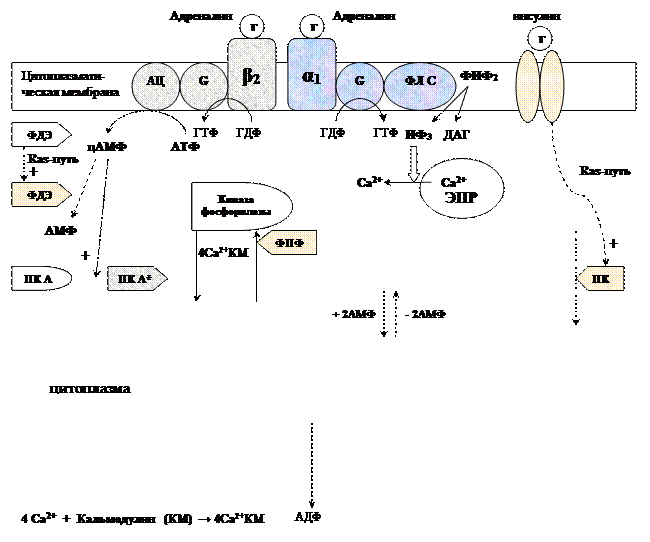 Метаболизм гликогена контролируется гормонами (в печени - инсулином, глюкагоном, адреналином; в мышцах - инсулином и адреналином), которые регулируют фосфорилирование /дефосфорилирование 2 ключевых ферментов гликогенсинтазы и гликогенфосфорилазы. Инсулин стимулирует синтез гликогена, а адреналин и глюкагон – его распад. В печени существует и аллостерическая регуляция гликогенфосфорилазы: ее ингибирует АТФ (аденозинтрифосфат) и глюкозо-6фосфат, а активирует АМФ (аденозинмонофосфат). Катаболизм глюкозы. Гликолиз. Основные пути катаболизма глюкозы Катаболизм глюкозы в клетке может проходить как в аэробных, так и в анаэробных условиях, его основная функция - это синтез АТФ. Аэробное окисление глюкозы В аэробных условиях глюкоза окисляется до СО2 и Н2 О. Суммарное уравнение: С6 Н12 О6 + 6О2 → 6СО2 + 6Н2 О + 2880 кДж/моль. Этот процесс включает несколько стадий: 1. Аэробный гликолиз. В нем происходит окисления 1моля глюкозы до 2 молей ПВК (пировиноградная кислота, пируват) с образованием 2 молей АТФ (сначала 2 АТФ затрачиваются, затем 4 образуются) и 2 молей НАДН2; 2. Превращение 2 ПВК в 2 ацетил-КоА с выделением 2 СО2 и образованием 2 НАДН2; 3. ЦТК.В нем происходит окисление 2 ацетил-КоА с выделением 4 СО2, образованием 2 ГТФ (2 АТФ), 6 НАДН2 и 2 ФАДН2; 4. Цепь окислительного фосфорилирования.В ней происходит окисления 10 (8) НАДН2 , 2 (4) ФАДН2 с участием 6 О2 , при этом выделяется 6 Н2О и синтезируется 34 (32) АТФ. В результате аэробного окисления глюкозы образуется 38 (36) АТФ, из них: 4 АТФ в реакциях субстратного фосфорилирования, 34 (32) АТФ в реакциях окислительного фосфорилирования. Анаэробное окисление глюкозы Катаболизм глюкозы без О2 идет в анаэробном гликолизе и ПФШ (пентозофосфатный шунт) (ПФП – пентозофосфатный путь). В ходе анаэробного гликолизапроисходит окисления 1 глюкозы до 2 молекул молочной кислоты (лактат) с образованием 2 АТФ (сначала 2 АТФ затрачиваются, затем 4 образуются). В анаэробных условиях гликолиз является единственным источником энергии. Суммарное уравнение: С6 Н12 О6 + 2Н3 РО4 + 2АДФ → 2С3 Н6 О3 + 2АТФ + 2Н2 О. В ходе ПФПиз глюкозы образуются пентозы и НАДФН2. В ходе ПФШиз глюкозы образуются только НАДФН2. ГЛИКОЛИЗ Гликолиз – главный путь катаболизма глюкозы (а также фруктозы и галактозы). Все его реакции протекают в цитозоле. Аэробный гликолиз- это процесс окисления глюкозы до ПВК (пируват), протекающий в присутствии О2. Анаэробный гликолиз– это процесс окисления глюкозы до лактата молочная кислота), протекающий в отсутствии О2. Анаэробный гликолиз отличается от аэробного только наличием последней 11 реакции, первые 10 реакций у них общие. Этапы гликолиза В любом гликолизе можно выделить 2 этапа: 1 этап подготовительный, в нем затрачивается 2 АТФ. Глюкоза фосфорилируется и расщепляется на 2 фосфотриозы; 2 этап, сопряжён с синтезом АТФ. На этом этапе фосфотриозы превращаются в ПВК. Энергия этого этапа используется для синтеза 4 АТФ и восстановления 2НАДН2, которые в аэробных условиях идут на синтез 6 АТФ, а в анаэробных условиях восстанавливают ПВК до лактата. Энергетический баланс гликолиза Таким образом, энергетический баланс аэробного гликолиза: 8АТФ = -2АТФ + 4АТФ + 6АТФ (из 2НАДН2) Энергетический баланс анаэробного гликолиза: 2АТФ = -2АТФ + 4АТФ Общие реакции аэробного и анаэробного гликолиза 1. Гексокиназа (гексокиназа II, АТФ: гексозо-6-фосфотрансфераза) в мышцах фосфорилирует в основном глюкозу, меньше – фруктозу и галактозу.Ингибитор глюкозо-6-ф, АТФ. Активатор адреналин. Индуктор инсулин. Глюкокиназа(гексокиназа IV, АТФ: глюкозо-6-фосфотрансфераза) фосфорилирует глюкозу. Активна в печени, почках. Не ингибируется глюкозо-6-ф. Индуктор инсулин. Гексокиназы осуществляют фосфорилирование гексоз. 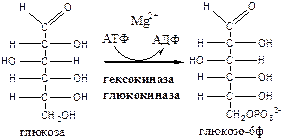 2.Фосфогексозоизомераза(глюкозо-6ф-фруктозо-6ф-изомераза) осуществляет альдо-кетоизомеризацию открытых форм гексоз. 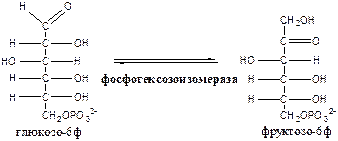 3.Фосфофруктокиназа 1(АТФ: фруктозо-6ф-1-фосфотрансфераза) осуществляет фосфорилирование фруктозы-6ф. Реакция необратима и самая медленная из всех реакций гликолиза, определяет скорость всего гликолиза. Активируется: АМФ, фруктозо-2,6-дифосфат (мощный активатор, образуется с участием фосфофруктокиназы 2 из фруктозо-6-фосфат), фруктозо-6-ф, Фн (фосфор неорганический). Ингибируется: глюкагоном, АТФ, НАДН2 , цитратом, жирными кислотами, кетоновыми телами. Индуктор реакции инсулин. 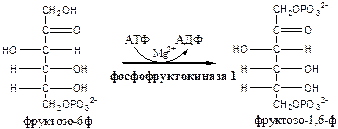 4.Альдолаза А(фруктозо-1,6-ф: ДАФ-лиаза). Альдолазы действуют на открытые формы гексоз, имеют 4 субъединицы, образуют несколько изоформ. В большинстве тканей содержится Альдолаза А. В печени и почках – Альдолаза В. 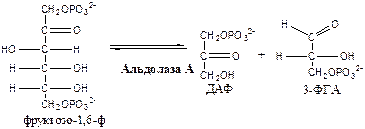 ⃰ - ДАФ – диоксиацетонфосфат, 3-ФГА – 3 фосфоглицериновый альдегид 5. Фосфотриозоизомераза(ДАФ-ФГА-изомераза). 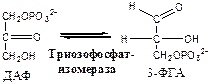 6.3-ФГА дегидрогеназа(3-ФГА: НАД+ оксидоредуктаза (фосфорилирующая)) состоит из 4 субъединиц. Катализирует образование макроэргической связи в 1,3-ФГК и восстановление НАДН2 , которые используются в аэробных условиях для синтеза 8 (6) молекул АТФ. 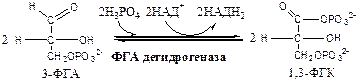 ⃰ - 1,3 ФГК – 1,3 фосфоглицериновая кислота 7.Фосфоглицераткиназа(АТФ: 3ФГК-1-фосфотрансфераза). Осуществляет субстратное фосфорилирование АДФ с образованием АТФ. 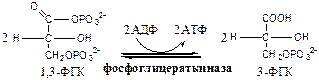 В следующих реакциях низкоэнергетический фосфоэфир переходит в высокоэнергетический фосфат. 8.Фосфоглицератмутаза(3-ФГК-2-ФГК-изомераза) осуществляет перенос фосфатного остатка в ФГК из положения 3 положение 2. 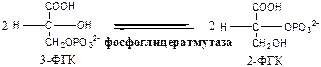 9.Енолаза(2-ФГК: гидро-лиаза) отщепляет от 2-ФГК молекулу воды и образует высокоэнергетическую связь у фосфора. Образуется фосфоэнолпируват (ФЭП) Ингибируется ионами F-. 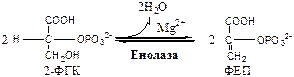 10.Пируваткиназа(АТФ: ПВК-2-фосфотрансфераза) осуществляет субстратное фосфорилирование АДФ с образованием АТФ. Активируется фруктозо-1,6-дифосфатом, глюкозой. Ингибируется АТФ, НАДН2 , глюкагоном, адреналином, аланином, жирными кислотами, Ацетил-КоА. Индуктор: инсулин, фруктоза. 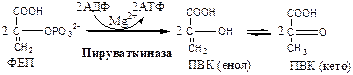 Образующаяся енольная форма ПВК (пировиноградная кислота, пируват) затем неферментативно переходит в более термодинамически стабильную кетоформу. Данная реакция является последней для аэробного гликолиза. Дальнейший катаболизм 2 ПВК и использование 2 НАДН2 зависит от наличия О2 . Реакция анаэробного гликолиза В анаэробных условиях ПВК, подобно О2 в дыхательной цепи, обеспечивает регенерацию НАД+ из НАДН2 , что необходимо для продолжения реакций гликолиза. ПВК при этом превращается в молочную кислоту. Реакция протекает в цитоплазме с участием лактатдегидрогеназы (ЛДГ). 11.Лактатдегидрогеназа(лактат: НАД+ оксидоредуктаза). Стоит из 4 субъединиц, имеет 5 изоформ. 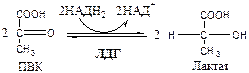 Лактат не является конечным продуктом метаболизма, удаляемым из организма. Из анаэробной ткани лактат переноситься кровью в печень, где превращаясь в глюкозу (Цикл Кори), или в аэробные ткани (миокард), где превращается в ПВК и окисляется до СО2 и Н2 О. Катаболизм ПВК (пирувата) в митохондриях В аэробных условиях ПВК и водороды с НАДН2 транспортируются в матрикс митохондрий. ПВК самостоятельно не проходит через внутреннюю мембрану митохондрий, перенос ее через мембрану осуществляется вторично-активным транспортом симпортом с Н+. В митохондриях происходит окислительное декарбоксилирование пирувата с образованием ацетилКоА (ацетилкоэнзим А, НSCoA) и восстановленным НАД+ (НАДН+). Реакция катализируется сложным пируватдегидрогеназным комплексом (ПДК). АцетилКоА окисляется в цикле Кребса, протоны с восстановленного НАД+ передаются в дыхательную цепь (см. лекцию №5). 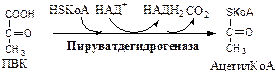 Энергетический баланс данной реакции 3 молекулы АТФ. Пластическое значение катаболизма глюкозы При катаболизме глюкоза может выполнять пластические функции. Метаболиты гликолиза используются для синтеза новых соединений. Так, фруктозо-6ф и 3-ФГА участвуют в образовании рибозо-5-ф (компонент нуклеотидов); 3-фосфоглицерат может включаться в синтез аминокислот, таких как серии, глицин, цистеин. В печени и жировой ткани Ацетил-КоА используется при биосинтезе жирных кислот, холестерина, а ДАФ для синтеза глицерол-3ф. Анаболизм глюкозы. Глюконеогенез (ГНГ) Глюконеогенез– синтез глюкозы из веществ неуглеводной природы. Его основной функцией является поддержание уровня глюкозы в крови в период длительного голодания и интенсивных физических нагрузок. Основными субстратами глюконеогенеза являются лактат, глицерол, аминокислоты. Глюконеогенез является обратным процессом гликолиза, который протекает в цитоплазме и матриксе митохондрий. Необратимые реакции гликолиза (1, 3 и 10), катализируемые гексокиназами, фруктокиназами и пируваткиназами обходятся с участием 4 специфических ферментов глюконеогенеза: пируваткарбоксилазы, фосфоенолпируват-карбоксикиназы, фруктозо-1,6-фосфатазы и глюкозо-6-фосфатазы. Кроме того, в глюконеогенезе участвуют ферменты ЦТК, например, малат ДГ. Реакции глюконеогенеза представлены на схеме ниже. Ключевые (необратимые) реакции глюконеогенеза: 1. Пируваткарбоксилаза(ПВК: СО2 -синтетаза (АТФ→АДФ+Фн)) содержит биотин (вит. Н), находится в митохондриях, превращает ПВК в ЩУК (щавелевоуксусная кислота). Индуктор: глюкагон, адреналин, кортизол. Репрессор: инсулин. Ингибитор: АМФ, активатор АцетилКоА. Образующийся ЩУК проходит внутреннюю мембрану митохондрий в своей восстановленной (в виде малата) или аминоформе (в виде аспартата). 2. Фосфоенолпируваткарбоксикиназа(ГТФ: ЩУК-2-фосфотрансфераза (декарбоксилирующая)) находится в цитоплазме, превращает ЩУК в ФЕП. Индуктор: глюкагон, адреналин, кортизол. Репрессор: инсулин. 3. Фруктозо-1,6-фосфотаза(Фруктозо-1,6дф: фосфогидролаза) дефосфорилирует фруктозо-1,6дф. Индуктор: глюкагон, адреналин, кортизол. Репрессор: инсулин. Ингибирует АМФ, фруктозо-2,6дф. Активатор: цитрат, жирные кислоты. 4. Глюкозо-6-фосфотаза(Глюкозо-6ф: фосфогидролаза) дефосфорилирует глюкозо-6ф. Индуктор: глюкагон, адреналин, кортизол. Репрессор: инсулин. Энергетический баланс глюконеогенеза . На образование 1 глюкозы из 2 лактата требуется 6 АТФ: 2 АТФ для пируваткарбоксилазы, 2 ГТФ для ФЕПкарбоксикиназы, 2 АТФ для фосфоглицераткиназы. Обще уравнение глюконеогенеза: 2 лактат + 4 АТФ + 2 ГТФ + 4 Н2 О → 1 глюкоза + 4 АДФ + 2 ГДФ + 6 Фн Регуляция глюконеогенеза Активация глюконеогенеза, сопровождается ингибированием гликолиза и наоборот. Регуляция обмена глюкозы происходит с участием гормонов и метаболитов, которые изменяют активность и количество регуляторных ферментов гликолиза и глюконеогенеза. Инсулин индуцирует синтез ключевых ферментов гликолиза и репрессирует синтез ключевых ферментов глюконеогенеза. Глюкагон, кортизол и адреналин индуцирует синтез ключевых ферментов глюконеогенеза. 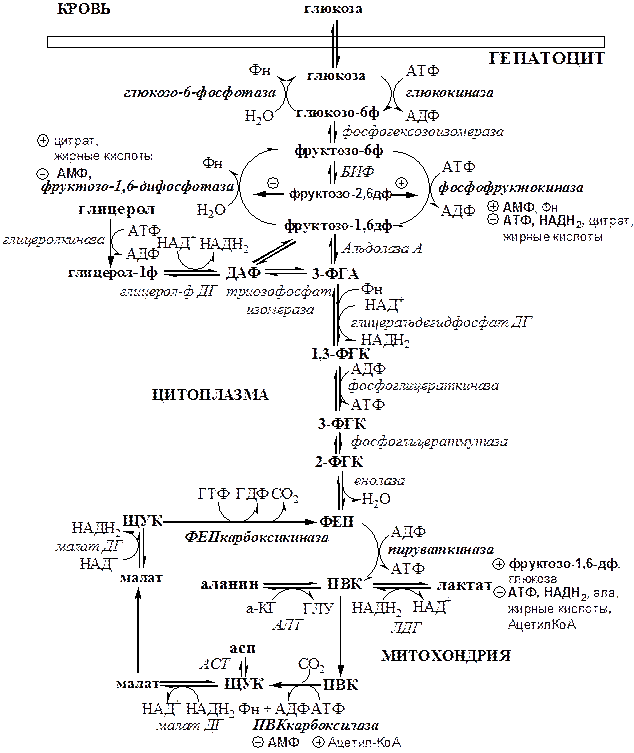 Рис. Схема глюконеогенеза Тканевые особенности глюконеогенеза. В большинстве тканей глюконеогенеза нет. Наибольшая активность глюконеогенеза отмечается в печени, меньше в почках и слизистой оболочке кишечника, в них может синтезироваться до 80-100г глюкозы в сутки. В этих органах глюконеогенез идет до конца с образованием свободной глюкозы, которая может выходить из клеток, поддерживая гомеостаз глюкозы в крови. В норме гомеостаз глюкозы в крови обеспечивается глюконеогенезом печени до 80%, почек до 20%. Небольшая активность глюконеогенеза наблюдается в мышечных тканях, однако из-за отсутствия у них последних ферментов глюконеогенеза, вместо свободной глюкозы образуются только ее производные, которые не способны покинуть клетку. Таким образом, углеводы синтезируются в мышечных тканях только для собственных нужд. Биологическое значение глюконеогенеза. Необходимость поддержание постоянного уровня глюкозы в крови связана с тем что, для многих тканей глюкоза является основным (нервная ткань), а для некоторых единственным (эритроциты) источником энергии. Потребность в синтезе глюкозы объясняется тем что, гликогенолиз печени может самостоятельно обеспечивать гомеостаз глюкозы в крови только в течение 8-12 часов, далее запас гликогена в течение суток почти полностью истощается. В условиях длительного голодания (больше суток) глюконеогенез является единственным источником глюкозы в организме. Пентозофосфатный шунт (ПФШ) Пентозофосфатный шунт (путь, цикл) является альтернативным путем окисления глюкозы. Наиболее активен этот процесс в жировой ткани, печени, коре надпочечников, эритроцитах, фагоцитирующих лейкоцитах, лактирующей молочной железе, семенниках. Протекает он в цитозоле без участия кислорода и состоит из 2 стадий окислительной и неокислительной. В окислительной стадии происходит восстановление НАДФН2 , который используется: 1) для регенерации глутатиона в антиоксидантной системе; 2) для синтеза жирных кислот; 3) в оксигеназных реакциях с участием цитохрома Р450 при обезвреживании ксенобиотиков, метаболитов, синтезе холестерина, стероидных гормонов и т.д. В неокислительной стадии образуются различные пентозы. Рибозо-5ф может использоваться для синтеза пуриновых и пиримидиновых нуклеотидов. Тканевые особенности функционирования ПФШ (пути, цикла). В зависимости от потребности ткани, пентозофосфатный процесс может протекать в виде метаболического цикла, пути или шунта начальных реакций гликолиза: 1. При ПФЦ или ПФШ в качестве продукта образуется только НАДФН2 . Пентозы в этом случае не являются конечным продуктом, они превращаются в фосфогексозы, которые замыкают цикл, или уходят в гликолиз, завершая шунт. В жировой ткани, эритроцитах. 2. Продуктом ПФП являются НАДФН2 и пентозы. В печени, костном мозге. 3. В тканях, которые не испытывают потребность в НАДФН2 , функционирует только неокислительная стадия ПФП, причем ее реакции идут в обратную сторону начиная с фруктозы-6ф до фосфопентоз (в мышцах). Реакции окислительной стадии Окислительная стадия ПФШ (пути, цикла) состоит из 3 необратимых реакций: 1). Глюкозо-6ф дегидрогеназа(глюкозо-6ф: НАДФ+ оксидоредуктаза). Ингибитор НАДФН2 . Индуктор инсулин. 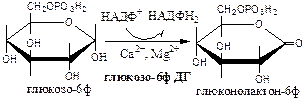 2). Глюконолактонгидратаза(6-фосфоглюконат: гидролиаза). 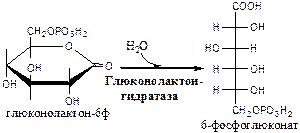 3). 6-фосфоглюконат дегидрогеназа(6-фосфоглюконат: НАДФ+оксидоредуктаза (декарбоксилирующая)). Индуктор инсулин. 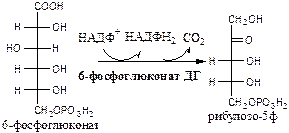 Схема ПФШ (пути, цикла) На схеме неокислительная стадия начинается с эпимераз и изомераз, которые изомеризуют рибулозо-5ф. Все реакции неокислительной стадии обратимы. 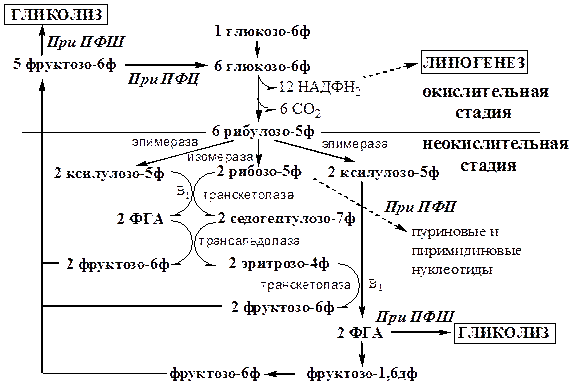 Общее уравнение ПФЦ: 6 глюкозо-6ф + 12 НАДФ+ → 6 СО2 + 12 НАДФН2 + 5 глюкозо-6ф Общее уравнение ПФШ: 3 глюкозо-6ф + 6 НАДФ+ → 3 СО2 + 6 НАДФН2 + 2 фруктозо-6ф + ФГА Общие уравнения ПФП: 1) глюкозо-6ф + 2 НАДФ+ → СО2 + 2 НАДФН2 + рибозо-5ф 2) 2 фруктозо-6ф + ФГА → 3 рибозо-5ф Регуляция обмена углеводов К основным гормонам, поддерживающим нормальный уровень глюкозы в крови (3,3-5,5 мМоль/л), относят инсулин (снижает) и глюкагон (повышает). На уровень глюкозы влияют также гормоны адаптации – адреналин, глюкокортикоиды и другие гормоны: тиреоидные, СДГ, АКТГ и т.д (центральный уровень регуляции). Глюкозо-лактатный цикл (цикл Кори). Глюкозо-аланиновый цикл (межорганный уровень регуляции). 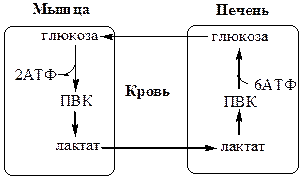 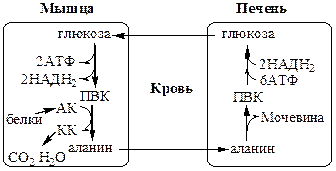 Глюкозо-лактатный цикл не требует наличие кислорода, функционирует всегда, обеспечивает: 1) утилизацию лактата, образующегося в анаэробных условиях (скелетные мышцы, эритроциты), что предотвращает лактоацидоз; 2) синтез глюкозы (печень). Глюкозо-аланиновый циклфункционирует в мышцах при голодании. При дефиците глюкозы, АТФ синтезируется за счет распада белков и катаболизма аминокислот в аэробных условиях, при этом глюкозо-аланиновый цикл обеспечивает: 1) удаление азота из мышц в нетоксичной форме; 2) синтез глюкозы (печень). На клеточном (метаболическом) уровне избыток глюкозы стимулирует гликогенез (синтез гликогена), липогенез (синтез жирных кислот) и синтез аминокислот, дефицит глюкозы - глюконеогенез. Дефицит АТФ стимулирует катаболизм глюкозы, а избыток АТФ - ингибирует. В норме уровень глюкозы в крови натощак составляет 3,3 – 5,5 ммоль/л. Гипергликемия– повышение уровня глюкозы в крови выше 6,1 ммоль/л. Гипогликемияснижение уровня глюкозы в крови ниже 3,3 ммоль/л. |
