Биохимия. Биохимия. Нужно для вопросов. Обмен веществ и энергии
 Скачать 1.61 Mb. Скачать 1.61 Mb.
|
|
| Источники | Энтеральный обмен в ЖКТ и внутритканевой распад | Кровь | Органы и ткани (межуточный обмен) | Митохондрии человека |
| 1. Углеводы (крахмал, гликоген, моно- и дисахариды и др.) | Моносахариды (в основном глюкоза) | Глюкоза | Низкомолекулярные жирные кислоты и их производные; ацетил-КоА | Тканевое дыхание: освобождение атома водорода в составе переносчиков; разделение его на Н+ и е–, перенос е– на О2 с образованием иона О2–: 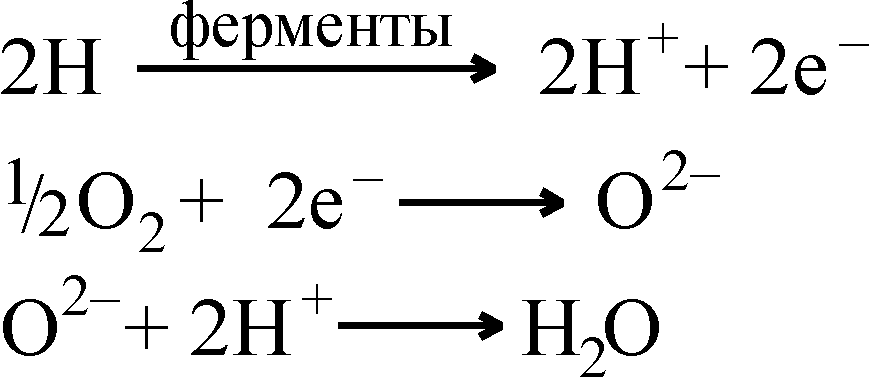 Высвобождаемая поэтапно (частями) энергия движущегося е– в результате процесса фосфорилирования АДФ аккумулируется в АТФ |
| 2. Липиды (триацилглицерины и др.) | Глицерин и высокомолекулярные жирные кислоты (ВМЖК) | Специфический жир после энтерального и продукты гидролиза липидов после тканевого обменов | Низкомолекулярные жирные кислоты и их производные; ацетил-КоА | |
| 3. Белки | Аминокислоты | Аминокислоты | Низкомолекулярные жирные кислоты; щавелевоуксусная, -кетоглутаровая кислоты; ацетил-КоА |
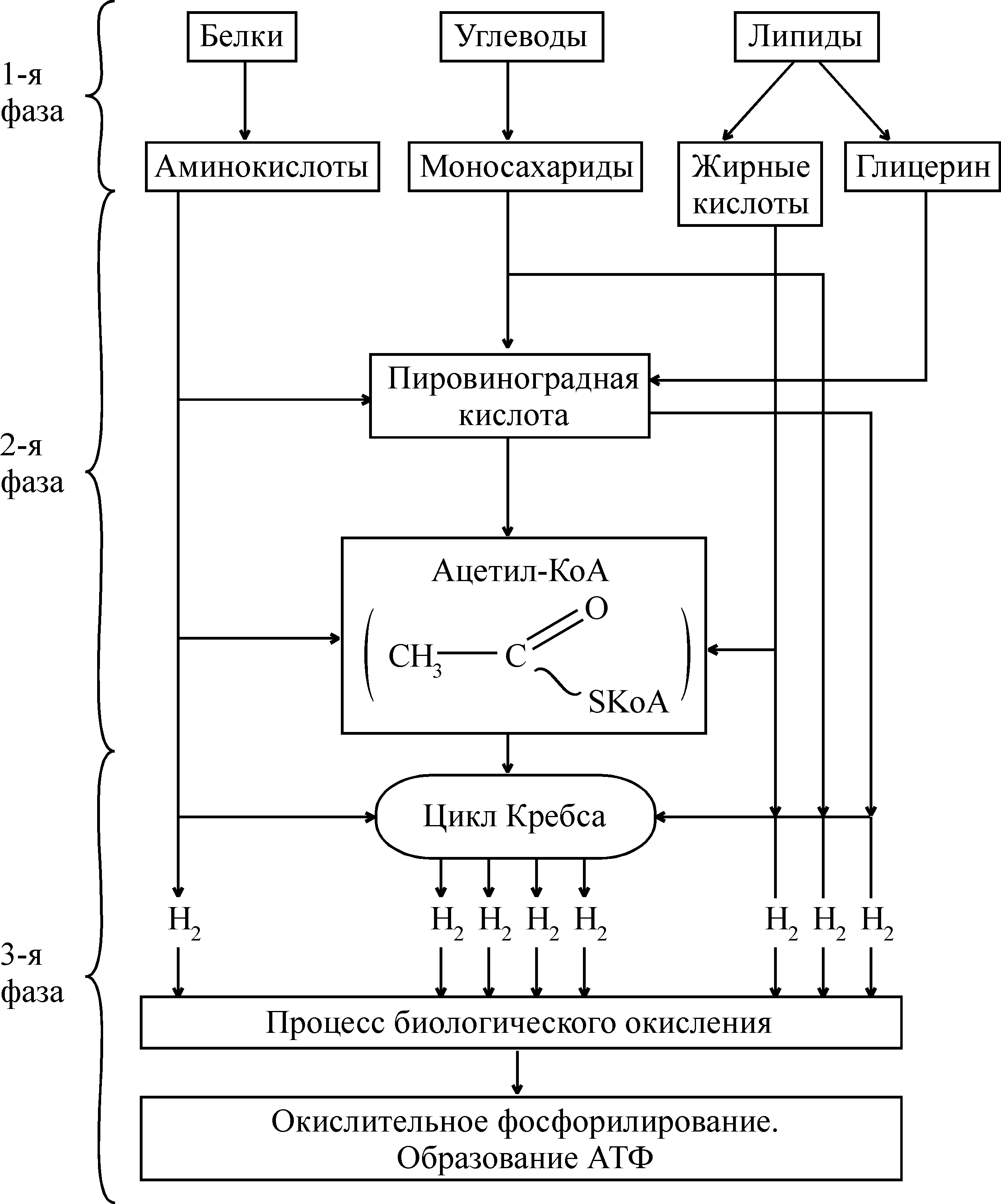
Рис.1 Этапы (фазы) освобождения энергии в организме.
Универсализация «топлива» в организме
Первая подготовительная фаза. Происходит перевод высокомолекулярных биополимеров, поступающих с пищей или находящихся внутри клеток, в удобную для извлечения энергии форму – мономеры. Осуществляется этот этап в желудочно-кишечном тракте (ЖКТ) или внутри клеток организма с помощью гидролаз. Внутри клетки гидролиз проходит с участием ферментов цитоплазмы и лизосом. Так, углеводы (полисахариды, олигосахариды) распадаются до моносахаридов, триацилглицерины – до глицерина и высших жирных кислот, белки – до аминокислот. На этом этапе освобождается незначительное количество энергии, примерно до 1% энергии субстратов, но и она рассеивается в форме тепла.
На втором этапе мономеры распадаются в клетках тканей и органов на более простые соединения, которые могут быть одинаковыми у разных мономеров. Так, при окислении моносахаридов, триацилглицеринов и некоторых аминокислот образуются, хотя и различными путями, жирные кислоты от C2 до C6; их примерно 10 разновидностей. Например, пировиноградная, лимонная, изолимонная, -кетоглутаровая, янтарная, яблочная, щавелевоуксусная и др. кислоты (см. цикл Кребса ). Одним из ключевых промежуточных продуктов распада мономеров является уксусная кислота, связанная с коферментом ацетилирования (ацетилкоэнзим А).
На втором этапе высвобождается примерно 25–30% энергии исходных веществ. Часть этой энергии аккумулируется в фосфатных связях АТФ (субстратное фосфорилирование), а часть рассеивается в виде тепла. Превращение мономеров протекает в гиалоплазме, а заключительные реакции – в митохондриях.
Третья фаза – окончательный распад веществ до CO2 и H2O с участием кислорода и с полным освобождением энергии. Освободившийся водород в составе своих переносчиков под действием ферментов тканевого дыхания разделяется на H+ и е–. Электрон, переходя на более низкую орбиталь кислорода, активирует его и, соединяясь с протонами, образует воду, а выделившаяся свободная энергия аккумулируется в молекулах АТФ, в образовании которой участвует АДФ, фосфат и фермент АТФ-синтетаза. Примерно 70–80% всей энергии химических связей веществ освобождается в этой фазе. Эта энергия окисления субстратов сосредоточивается в фосфатных связях АТФ, часть ее выделяется в виде тепла. Все реакции этой фазы локализованы в митохондриях.
Биологическое окисление. Тканевое дыхание
Биологическое окисление имеет огромное значение для живых организмов. Большая часть энергии, необходимой для жизнедеятельности, получается в результате окислительно-восстановительных реакций.
Окисление веществ может осуществляться следующим образом: а) отщеплением водорода от окисляемого субстрата (процесс дегидрирования); б) отдачей субстратом электрона; в) присоединением кислорода к субстрату. В живых клетках встречаются все перечисленные типы окислительных реакций, катализируемые соответствующими ферментами – оксидоредуктазами. Процесс окисления не протекает изолированно, он сопряжен с реакцией восстановления – одновременно происходят реакции присоединения водорода или электрона, т.е. осуществляются окислительно-восстановительные реакции.
В настоящее время под окислением понимают все химические реакции, при которых происходит отдача электронов, сопровождающаяся увеличением положительных валентностей, но одновременно с окислением одного вещества должно происходить и восстановление, т.е. присоединение электронов к другому веществу.
Таким образом, биологическое окисление и восстановление – это соответствующие реакции переноса электронов, происходящие в живых организмах, а тканевое дыхание – такой вид биологического окисления, при котором акцептором электрона является молекулярный кислород.
Современные представления о биологическом
окислении и тканевом дыхании
Тканевым, или клеточным дыханием называют распад органических веществ в живой ткани, сопровождающийся потреблением кислорода и выделением воды и диоксида углерода. Тканевое дыхание – это последовательность реакций, с помощью которых организм использует энергию связей органических молекул для синтеза АТФ из АДФ и фосфата, а система ферментов, обеспечивающих этот процесс, называется дыхательной цепью. Тканевое дыхание начинается реакциями дегидрирования (отщепления водорода от органических веществ с помощью ферментов дегидрогеназ) и заканчивается переносом е– на кислород.
В настоящем разделе будет рассматриваться лишь та часть энергетического обмена, которая завершается синтезом АТФ. Что касается вопросов использования энергии АТФ, то они рассматриваются в большинстве других разделов биохимии.
Дыхательная цепь. В процессе окисления от субстратов отщепляются протоны и электроны (см. обмен углеводов, липидов, белков). Они поступают на коферменты ферментов дегидрогеназ, которые относятся к классу оксидоредуктаз и локализованы во внутренней мембране митохондрий. Передвигаясь от одного переносчика электронов к другому, электроны опускаются на все более низкие энергетические уровни, отдавая порциями свою энергию. В последнем звене дыхательной цепи они восстанавливают молекулярный кислород, с последующим образованием воды. Освобожденная при переносе электронов по дыхательной цепи энергия запасается в пирофосфатных связях АТФ.
В клетках животных и человека сопряжение энергии окислительно-восстановительных реакций с синтезом АТФ происходит в клеточных органеллах митохондриях, главная функция которых состоит в преобразовании энергии, в энергопродукции. Поэтому их образно называют силовыми энергетическими станциями клеток. Митохондрии имеют две замкнутые изолированные друг от друга мембраны: внутреннюю и наружную, разделенные межмембранным пространством. Их можно представить как мешок в мешке. Внутренняя мембрана причудливо изгибается, образуя складки – кристы, а пространство между кристами заполнено матриксом. Ферменты дыхательной цепи встроены во внутреннюю мембрану митохондрий.
Окисление органических молекул в клетке, сопряженное с освобождением энергии, осуществляется дегидрированием – переносом электронов и протонов атомов водорода на молекулярный кислород:
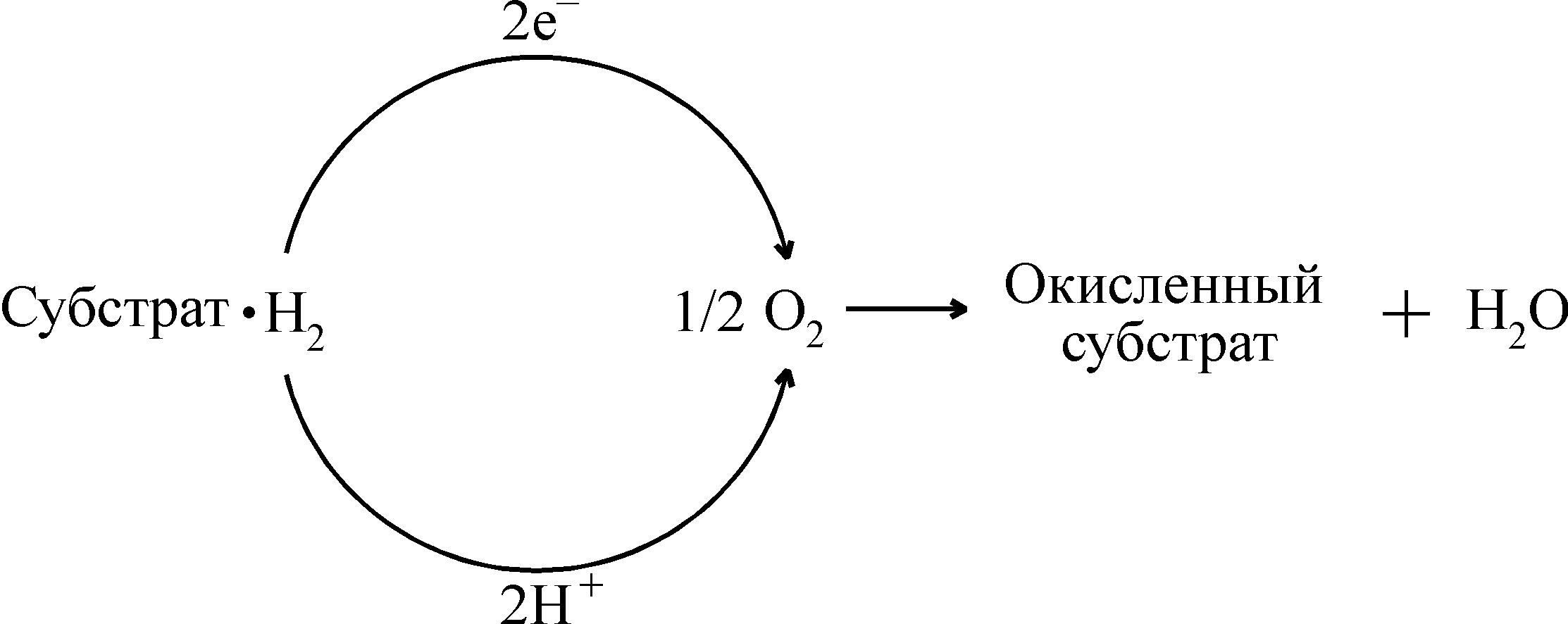
Эти реакции катализируют главным образом 3 класса окислительно-восстановительных ферментов:
1. Пиридинзависимые дегидрогеназы.
2. Флавинзависимые дегидрогеназы.
3. Цитохромы.
Для удобства изучения этот процесс можно разбить на несколько этапов.
Первый этап тканевого дыхания начинается с процесса дегидрирования, т.е. отщепления атомов водорода от соответствующего субстрата. Этот процесс осуществляется так называемыми пиридинзависимыми (для одних субстратов) и – для других – флавинзависимыми дегидрогеназами. Дегидрогеназы – это сложные ферменты, состоящие из белковой части и небелкового компонента.
Пиридинзависимые дегидрогеназы получили такое название в связи с тем, что в структуру их небелкового компонента входит производное пиридина – никотинамид. Поэтому их еще называют никотинамидными дегидрогеназами. Эти дегидрогеназы в качестве коферментов содержат:
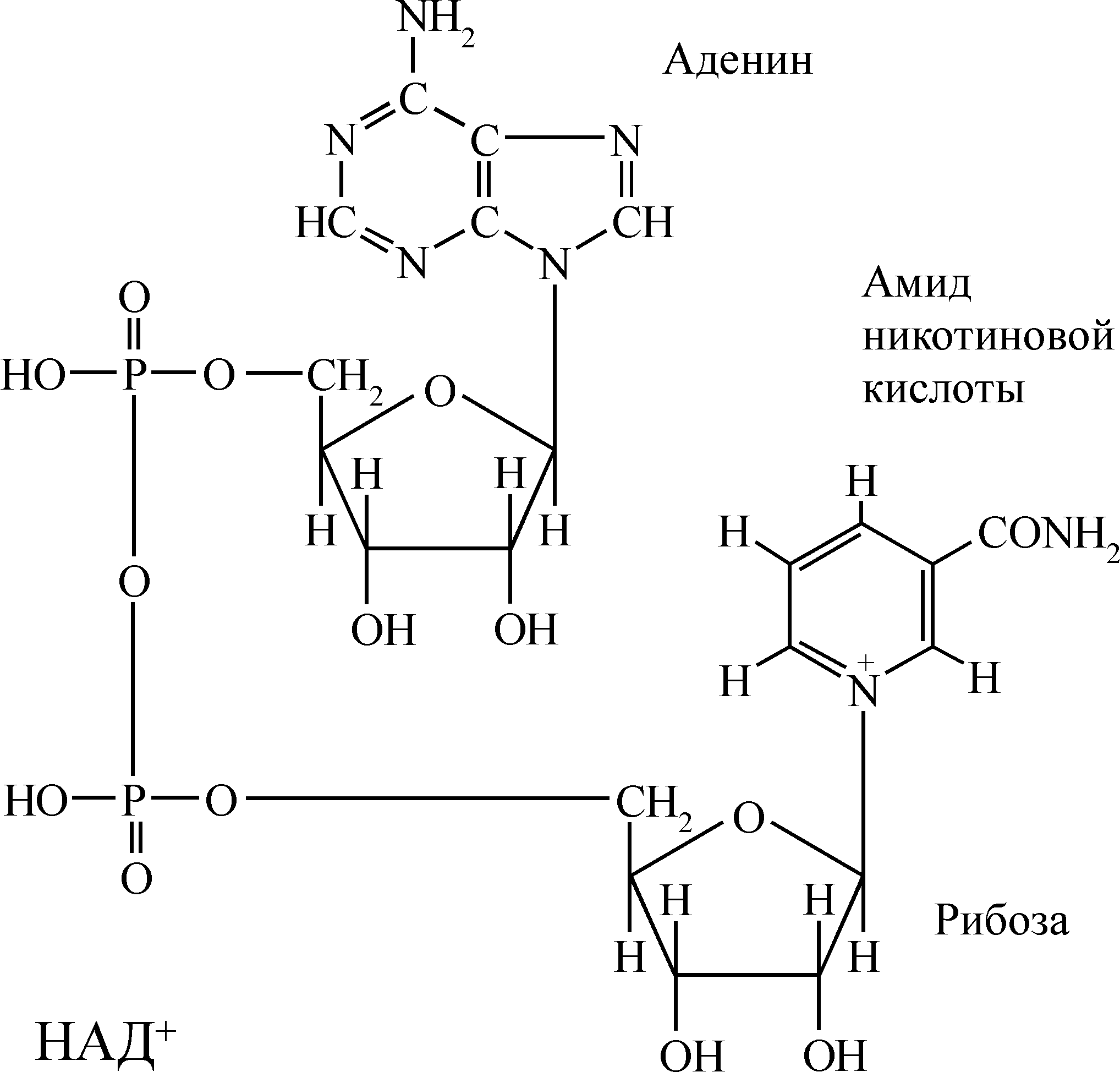
1) Никотинамидадениндинуклеотид – сокращенно НАД+, построенный из двух нуклеотидов: адениловой кислоты и второго нуклеотида, у которого место пуринового или пиримидинового основания занимает никотинамид (витамин РР). Эти нуклеотиды соединены через остатки фосфатов.
2) Никотинамидадениндинуклеотидфосфат – сокращенно НАДФ+ – это НАД+, у которого во 21-положении рибозы адениловой кислоты имеется дополнительная фосфатная группа.
Пиридинзависимые дегидрогеназы относятся к сложным ферментам, у которых НАД+ или НАДФ+ являются коферментами, непрочно связанными с апоферментом и поэтому могут в клетке находиться отдельно от белковой части фермента, выполняя функцию переносчиков атомов водорода (протонов и электронов). Эти дегидрогеназы являются универсальными акцепторами водорода для многих субстратов: спиртов, альдегидов, кето- и гидроксикислот, дикарбоновых кислот, аминов и др. Отнимая от субстратов атомы водорода, они сами восстанавливаются, а субстраты окисляются. Специфичность действия этой группы дегидрогеназ обусловлена белковой частью фермента, поскольку коферменты по своему строению сходны.
Дегидрирование – начальную стадию биологического окисления с участием пиридинзависимых дегидрогеназ на примере молочной кислоты можно представить так:
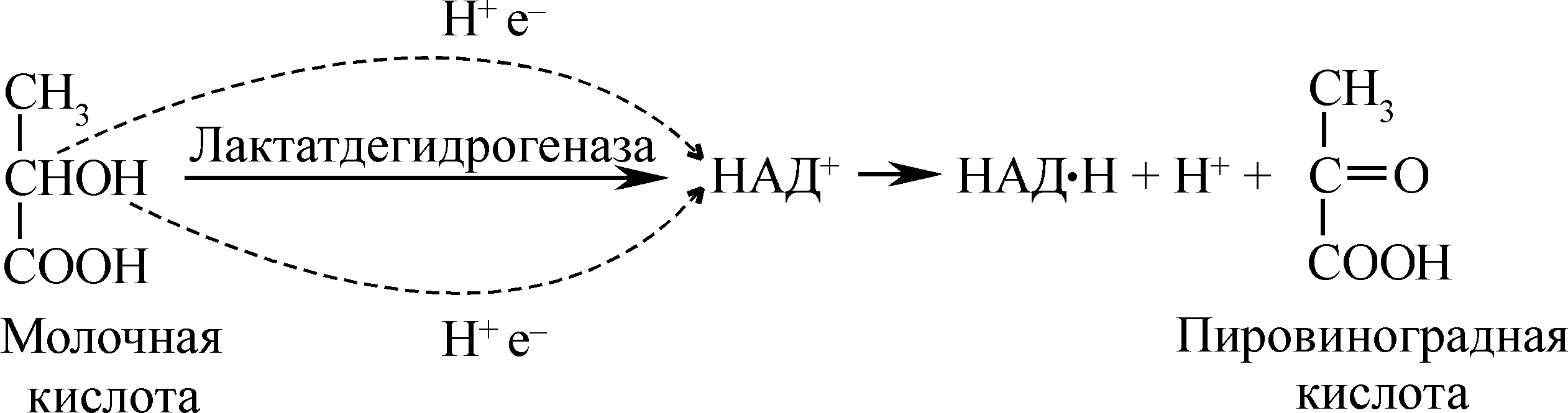
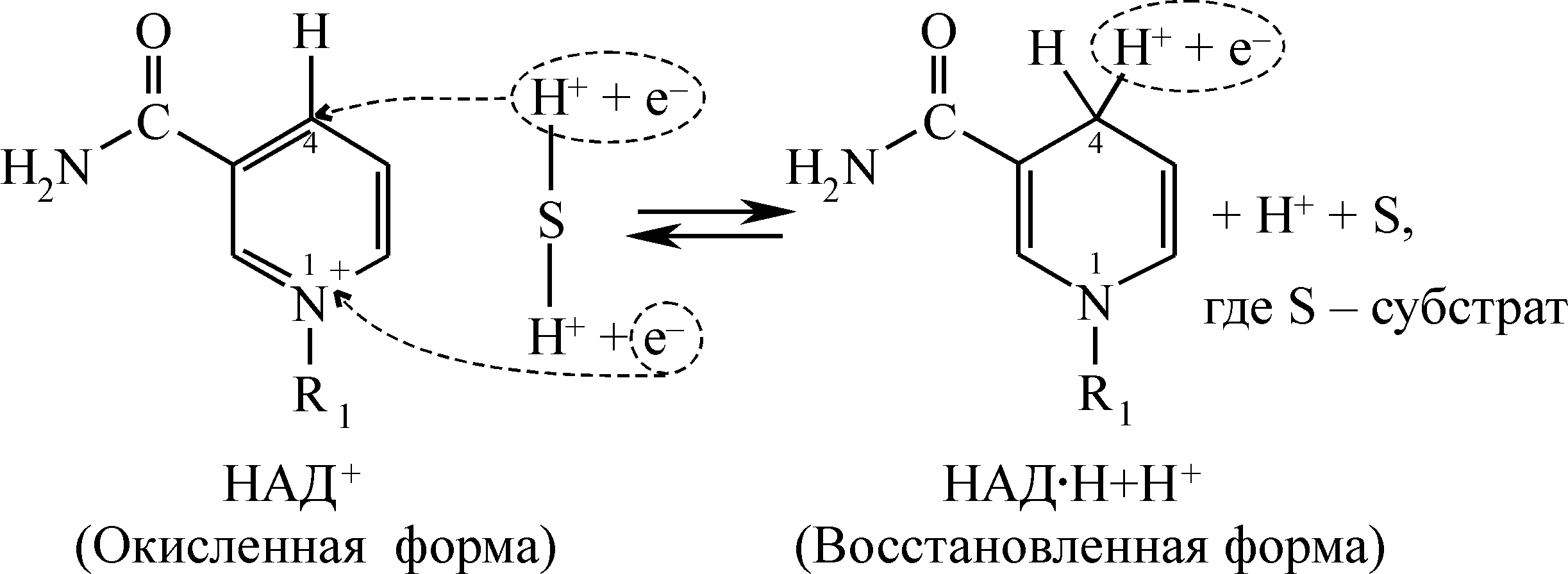
Способность НАД+ и НАДФ+ выполнять функцию промежуточного переносчика водорода связана с наличием в их структуре амида никотиновой кислоты: один из атомов водорода (H+ и е- ), отдаваемых субстратом, присоединяется к углероду никотинамидного кольца в положении 4. Электрон второго атома водорода (H+, е-) присоединяется на внешний энергетический уровень электроположительного атома азота в положении 1-м, нейтрализуя его положительный заряд, а протон (H+) переходит в раствор, подкисляя его. В процессе присоединения электронов и протонов изменяется структура пиридинового гетероцикла. Кольцо никотинамида, которое в окисленной форме имело три двойные связи, восстанавливается и имеет две двойные связи:
Флавинзависимые дегидрогеназы. Флавинзависимых дегидрогеназ, имеющих в структуре небелкового компонента флавиновое (аллоксазиновое) кольцо – витамин В2, очень много. Одни из них выполняют функцию первичных акцепторов водорода при дегидрировании определенных субстратов (янтарная кислота, ацилпроизводные жирных кислот и др.). Они способны отщеплять и принимать водороды от субстратов; при этом исключается действие пиридинзависимых дегидрогеназ. Другие – оксидазы - передают атомы водорода полученные при дегидрировании субстратов, сразу на молекулярный кислород с образованием пероксида водорода.
Имеются флавиновые ферменты, которые являются промежуточными переносчиками водорода от НАДH+H+, образовавшегося, как было показано, на первом этапе дыхательной цепи при действии никотинамидных дегидрогеназ, на соединения следующего этапа дыхательной цепи (убихинон). Они получили названия НАДН2-дегидрогеназ (водород забирают от НАДH+H+) или флавопротеинов-1 (ФП1). Эти флавопротеины представлены сложными олигомерными белковыми образованиями, содержащими в своем составе простетическую группу флавинового производного, атомы металлов, чаще всего в форме белков с железосерными центрами (Fe-S-белки). В этих белках железо находится не в составе гема, а присоединено координационными связями к атомам серы в цистеиновых остатках белка.
Строение и функции флавиновых ферментов (флавопротеинов) представлены ниже.
Первичные дегидрогеназы размещаются на внутренней поверхности внутренней мембраны митохондрий, а их активные центры обращены в матрикс.
Второй этап тканевого дыхания состоит в переносе по дыхательной цепи двух атомов водорода от восстановленной формы НАДH+H+ на флавопротеины (флавиновые ферменты) – промежуточные переносчики атомов водорода.
Флавиновые ферменты – это сложные протеины, содержащие в качестве простетической группы одно из двух производных витамина В2 (рибофлавина, состоящего из трициклического изоаллоксазина, образованного конденсацией трех колец: бензольного, пиразинового и пиримидинового, соответственно, I, II, III – на рисунке и спирта рибитола) – флавинмононуклеотида (ФМН) или флавинадениндинуклеотида (ФАД):

Отщепившиеся от восстановленных форм НАДH+H+, электроны и протоны (атомы водорода) присоединяются к изоаллоксазиновому кольцу рибофлавина, к атомам азота в 1-м и 10-м положениях; при этом происходит перемещение в конденсированных кольцах двойных сопряженных связей:
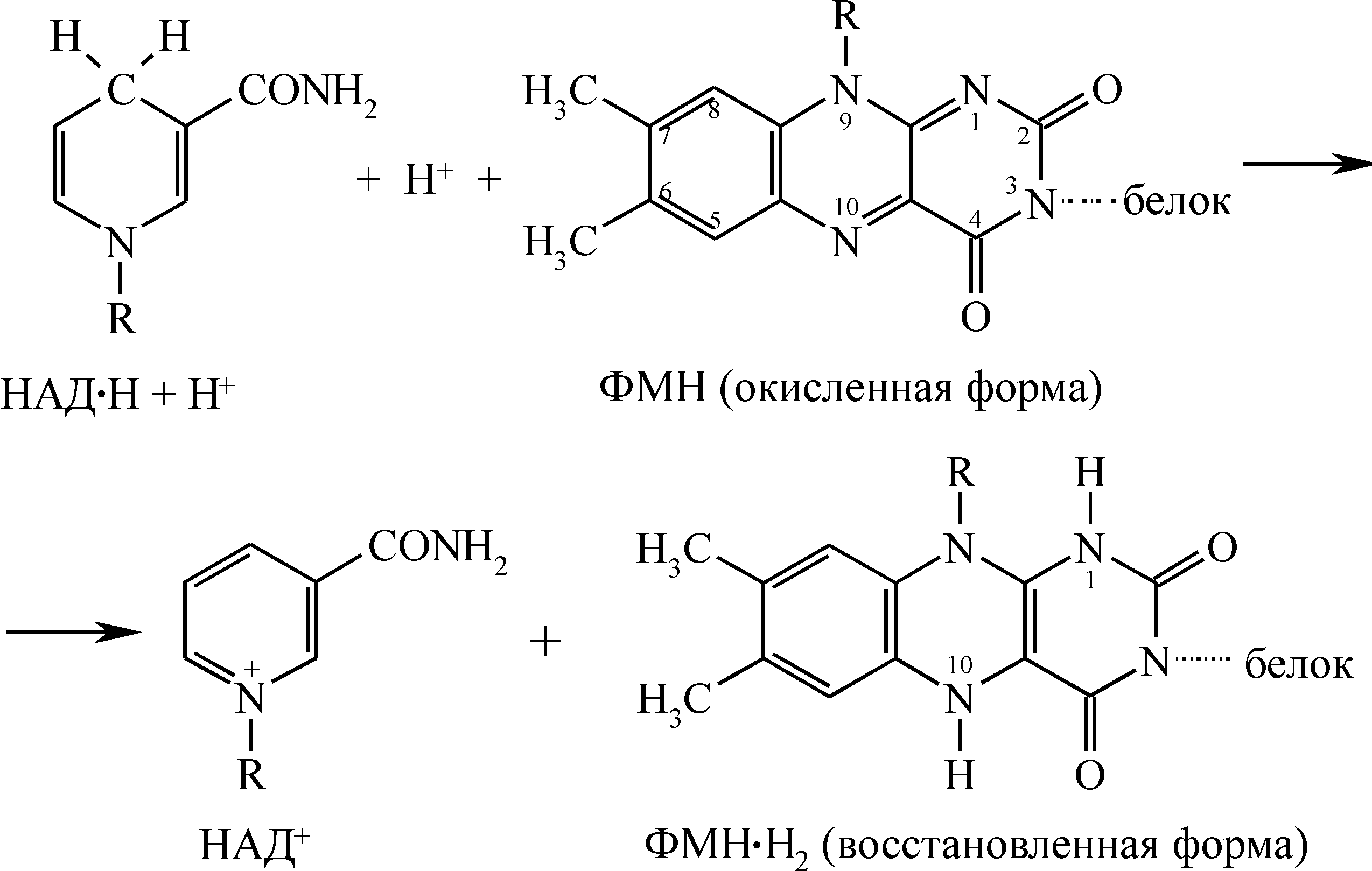
Общую реакцию второго этапа биологического окисления можно изобразить так:
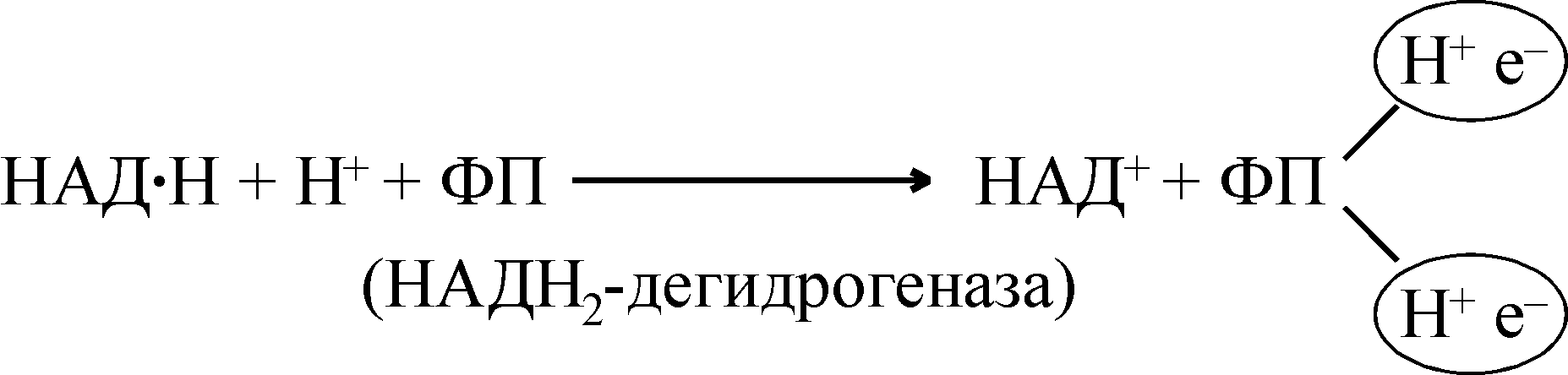
При этом восстановленная форма никотинамидных коферментов окисляется и может снова включаться в дыхательную цепь.
Третий этап – перенос электронов и протонов от восстановленных флавопротеинов на убихинон, который еще называют коферментом Q (сокращенно КоQ) – от первой буквы слова quinone.
Убихинон – это липидорастворимый хинон, содержащий длинную боковую ненасыщенную цепь (см. ниже). Он присутствует практически во всех клетках. Отсюда и его название «убихинон» – в переводе означает «вездесущий хинон». Его молекула способна к обратимому связыванию атомов водорода, сопровождающемуся переходом из окисленной формы в восстановленную (убихинон – КоQH2). На стадии образования КоQH2 сливаются два потока атомов водорода, вводимых в дыхательную цепь НАД-зависимыми и ФАД-зависимыми дегидрогеназами.
Боковая углеводородная цепочка придает молекуле убихинона высокую гидрофобность. Это способствует ее быстрой диффузии в липидных фазах внутренней митохондриальной мембраны.
Убихинон может участвовать в одно- или двухэлектронном переносе. При одноэлектронном переносе он образует относительно стойкий семихинон, при двухэлектронном – гидрохинон. Убихинон может мигрировать в липидной фазе мембраны, представляя собой лабильный субстрат для ферментов, встроенных в мембрану (закрепленных). Он является производным бензохинона с длинной боковой цепью, которая в большинстве тканей млекопитающих состоит из 10 изопреноидных единиц. По химической структуре убихинон представляет собой 2,3-диметокси-5-метил-1,4-бензохинон с изопреноидной цепью R в 6-м положении:
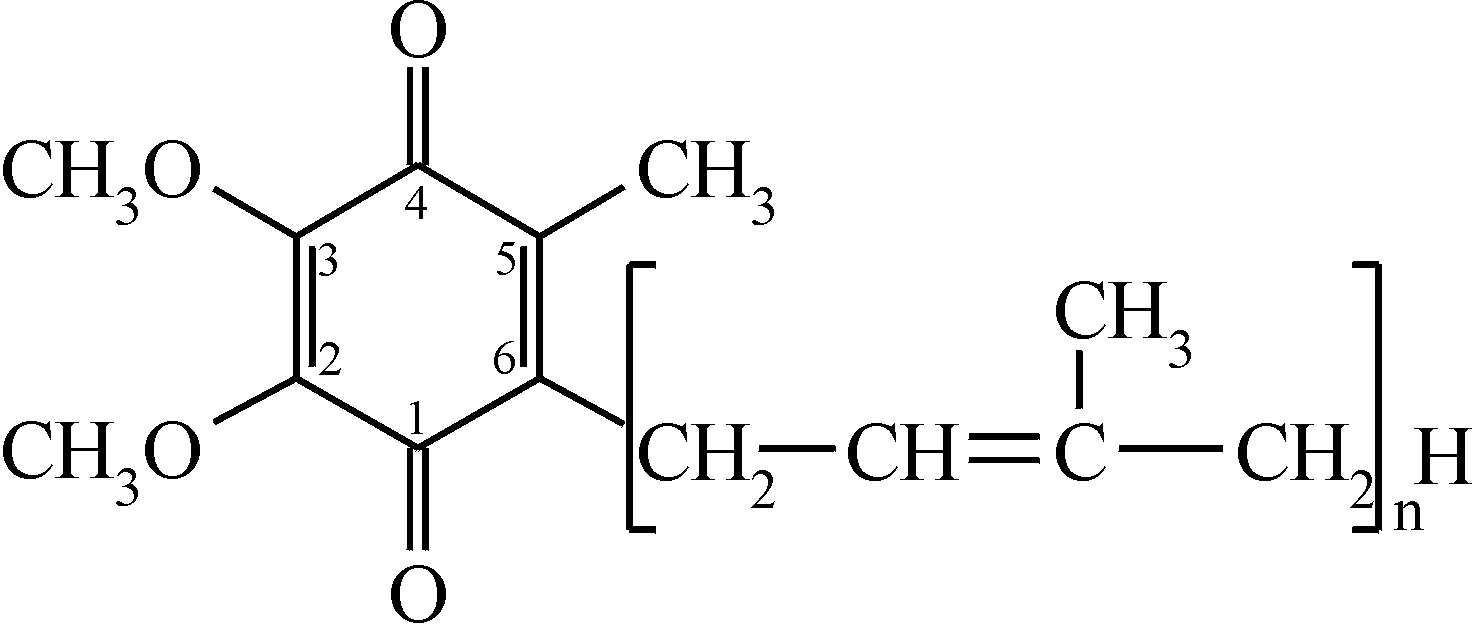
К настоящему времени выяснена основная роль убихинона, который, растворяясь в липидах гидрофобной части мембран митохондрий, осуществляет перенос электронов и протонов, диффундируя от внутренней поверхности внутренней мембраны к наружной поверхности. Общую реакцию третьего этапа можно изобразить так:

При этом восстановленная форма флавопротеина окисляется и может вновь включаться в дыхательную цепь.
Затем в дыхательной цепи пути электронов и протонов расходятся (четвертый этап). Электроны атомов водорода от восстановленой формы КоQH2 поступают на так называемую цитохромную систему, а протоны освобождаются во внешнюю среду. Цитохромная система состоит из ряда ферментов, небелковая часть которых (простетическая группа) представлена железопорфиринами, близкими по структуре к гему. Известно около 20 различных цитохромов.. Их делят на группы, основываясь на различных структурах гемовой простетической группы. Выделяют четыре типа гемов, их обозначают латинскими буквами a, b, c, d. При обозначении цитохромов с хорошо установленной структурой при букве ставят числовой индекс, который указывает на принадлежность цитохрома к определенной группе. В процессах тканевого дыхания наиболее важную роль играют цитохромы b, c1, c, a, a3. Цитохромы отличаются друг от друга строением белковой части, природой боковых цепей порфиринов и способом присоединения гема к белкам.
Атом железа в геме цитохромов может менять валентность, присоединяя или отдавая электрон:
Fe3+ + e– Fe2+
Fe2+ – e– Fe3+
Поэтому цитохромы участвуют в транспорте электронов в клетке аэробных организмов.
Установлено, что звено цитохромов располагается между КоQH2 и кислородом; при этом в дыхательную цепь цитохромы включаются в определенной последовательности в зависимости от окислительно-восстановительного потенциала, в основном в таком порядке: b, c1, c, a, a3.
Комплекс цитохромов b и c1 осуществляет перенос электронов от атомов водорода восстановленного КоQH2 на цитохром с. Электроны последовательно проходят через атомы железа цитохромов b и c1, а затем поступают на цитохром c, протоны при этом освобождаются во внешнюю среду. Цитохром c представляет собой железосодержащий белок с небольшой молекулярной массой (12000), состоящий из одной полипептидной цепи и порфириновой группы с атомом железа. Аналогично убихинону цитохром с – подвижный переносчик электронов. Находится он вблизи наружной поверхности внутренней мембраны митохондрий и, очевидно, может выходить в межмембранное пространство. Он выполняет как бы челночные движения между цитохромами b и с1 и комплексом цитохромов a и a3, диффундируя вдоль поверхности мембраны.
Комплекс цитохромов a и a3 действует как цитохромоксидаза (ЦХО), поэтому ее обозначают как aa3. ЦХО помимо гема содержит ионы меди, которые тоже участвуют в переносе электронов, меняя валентность:
Cu2+ + e– Cu+
Cu+ – e– Cu2+
Пятый этап связан с передачей электронов от цитохромоксидазы на молекулярный кислород. ЦХО – единственный из цитохромов, который может это осуществлять, поэтому получил такое название. Электроны последовательно присоединяются к ионам железа цитохромов a и a3, затем к иону меди и, наконец, попадают на кислород. В результате этого образуется активный ионизированный кислород (O2-), который, реагируя затем с двумя протонами водорода из матрикса, образует воду, так как ЦХO находится вблизи внутренней поверхности мембраны с активным центром, направленным в матрикс, куда поступает молекулярный кислород.
Поэтапно вышесказанное (четвертый и пятый этапы) можно записать следующим образом:

В организме человека за сутки образуется 300-400 мл эндогенной метаболической воды.
Каждый компонент дыхательной цепи во внутренней мембране митохондрий встроен между своим восстановителем и окислителем. В результате этого создаются условия для потока электронов от субстрата через последовательно расположенные переносчики электронов к молекулярному кислороду. Направление переноса протонов и электронов определяет окислительно-восстановительный потенциал.
При переходе от одного переносчика к другому электрон постепенно, небольшими порциями теряет потенциал. Падение потенциала связано с изменением свободной энергии. По мере падения потенциала выделившаяся свободная энергия трансформируется в химическую форму, удобную для использования клеткой.
Процесс присоединения молекулы фосфорной кислоты к молекуле АДФ является реакцией фосфорилирования. А так как энергия для этой реакции поставляется окислительно-восстановительными реакциями, сопряженными с дыхательной цепью, то этот процесс образования АТФ принято называть окислительным фосфорилированием.
Суммарно процесс биологического окисления, сопряженного с процессом фосфорилирования, можно записать так:
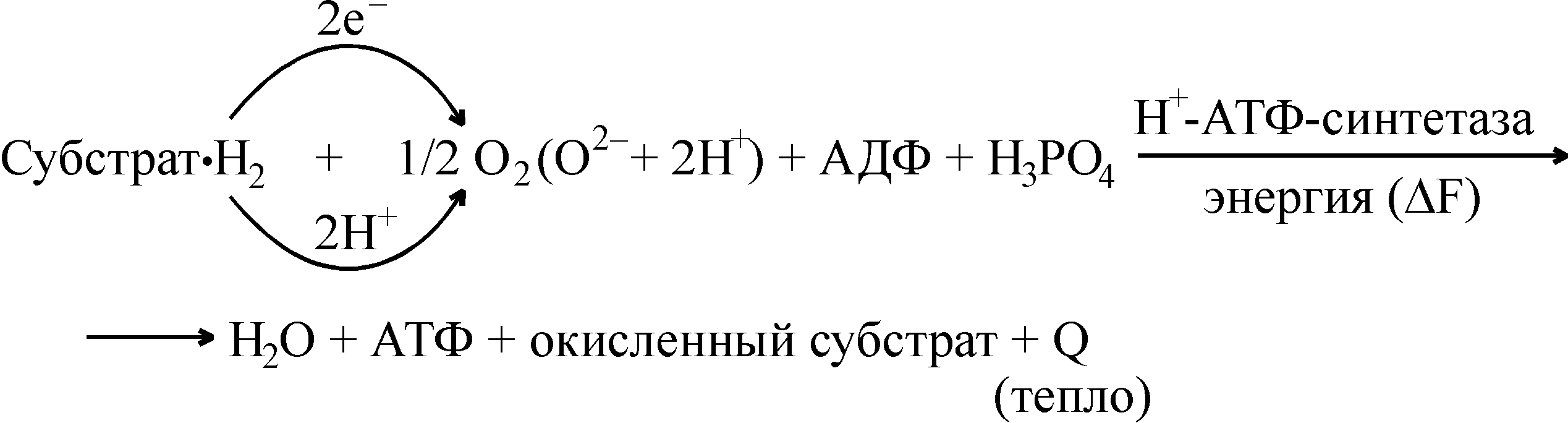
В процессе перехода электронов через систему дыхательной цепи происходит постепенное освобождение свободной энергии (она запасается в химических связях АТФ при поэтапном прохождении электронов), и к кислороду электроны переносятся уже энергетично обедненными, поэтому образование воды в организме не сопровождается взрывом, как это имеет место при образовании гремучего газа. Биологический смысл постепенного ступенчатого окисления в дыхательной цепи состоит в высвобождении свободной энергии частями («каскадообразно»), и только в таком случае она может быть в полной мере использована организмом. Если бы окисление совершалось сразу путем непосредственного взаимодействия между молекулами водорода субстрата и молекулярным кислородом, то оно сопровождалось бы одномоментным выделением большого количества энергии, значительная часть которой терялась бы в виде тепла.
Таким образом, дыхательная цепь – это каскад, при помощи которого клетка получает свободную энергию, извлекаемую из клеточного топлива, в удобном для использования виде (АТФ).
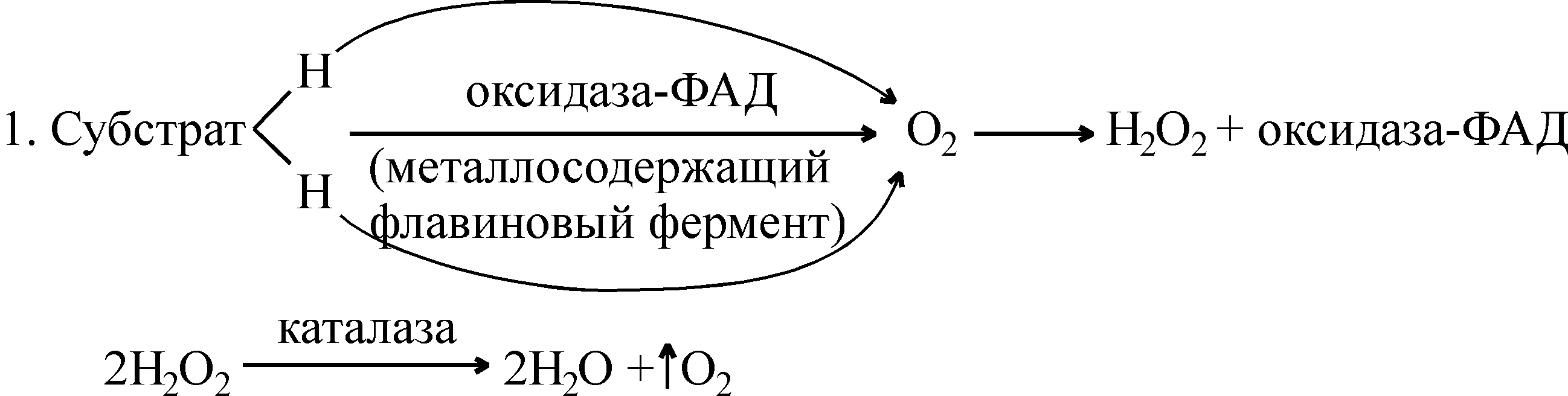
В организмах существует короткий путь аэробного окисления органических веществ без участия цитохромной системы. В этом случае водороды окисляемого субстрата сразу акцептируются особыми металлосодержащими флавиновыми ферментами (оксидазами) и переносятся прямо на молекулярный кислород с образованием пероксида водорода.
Образовавшийся пероксид водорода является сильным ядом для клетки. Обезвреживание пероксида водорода осуществляется с помощью гемсодержащих ферментов: каталазы и пероксидазы. Каталаза присутствует во всех клетках и тканях организма, особенно богаты ею печень, эритроциты, почки. Каталаза – очень активный фермент: одна молекула ее разлагает до 40000 молекул H2O2 в 1 с. Пероксидаза в животных тканях – малоактивный фермент по сравнению с каталазой. Растительные клетки, наоборот, богаты пероксидазой. Для каталазы субстратом и донором водорода служат молекулы пероксида водорода, а для пероксидазы – органический субстрат. Схематически сказанное можно представить так:
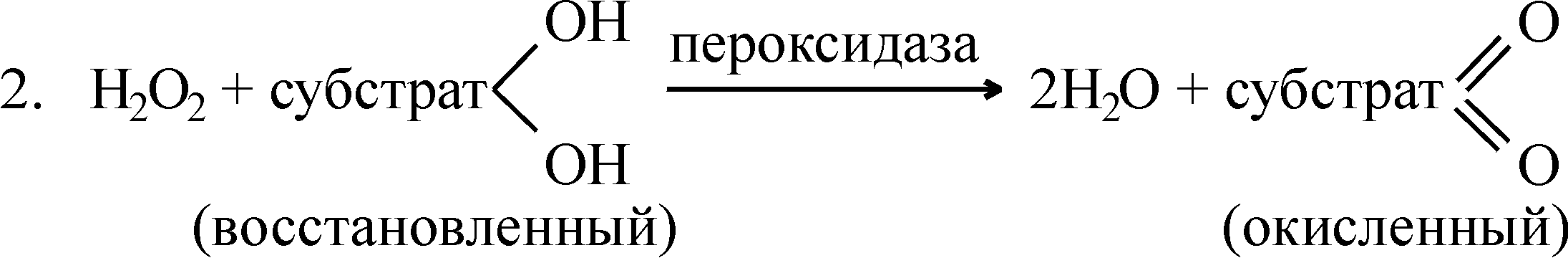
В процессе клеточного дыхания кроме воды образуется и CO2, процессы образования которого будут рассмотрены в других разделах биохимии.
Окислительное фосфорилирование
В процессе биологического окисления около 50% энергии резервируется клетками тканей в качестве макроэргических соединений, преимущественно АТФ. Синтез АТФ из АДФ и фосфорной кислоты, который происходит с использованием энергии, освобождающейся при окислении веществ в живых клетках, и сопряжен с переносом электронов по дыхательной цепи, называется окислительным фосфорилированием.
Основное количество АТФ синтезируется в процессе фосфорилирования, которое сопряжено с клеточным дыханием. Установлено, что на каждом этапе переноса электронов от одного переносчика на другой они переходят с одного энергетического уровня на другой (более низкий), в результате чего происходит высвобождение определенного количества энергии. Однако имеется 3 этапа, когда освобождаемой энергии достаточно для синтеза АТФ.
На основании данных термодинамики были предсказаны три участка (пункта) дыхательной цепи, в которых прпоисходит синтез АТФ. Опыты с применением специфических ингибиторов определенных ферментов дыхательной цепи подтвердили эти данные. Так, ротенон (инсектицид – токсическое вещество, вырабатываемое одним из видов растений и употребляемое индейцами как яд) блокирует перенос электронов на участке от НАДН+Н+ до КоQ, при этом все компоненты дыхательной цепи переходят в окисленное состояние, т.е. снижается скорость транспорта электронов. Амитал (барбитурат натрия) препятствует восстановлению КоQ. Антибиотик антимицин «А» блокирует перенос электронов от цитохрома b на цитохром c1, а цианиды, азид натрия, сероводород связываются с цитохромоксидазой и препятствуют переходу электронов с ЦХО на молекулярный кислород.
Из приведенной схемы следует, что первая молекула АТФ синтезируется во время переноса электронов и протонов на участке «никотинамидные коферменты – флавопротеины – KoQ», вторая – при переносе электронов от цитохрома b на цитохром с1 и третья на участке переноса электронов от цитохромоксидазы на молекулярный кислород. Отсюда при переносе двух атомов водорода в дыхательной цепи образуется три молекулы АТФ.
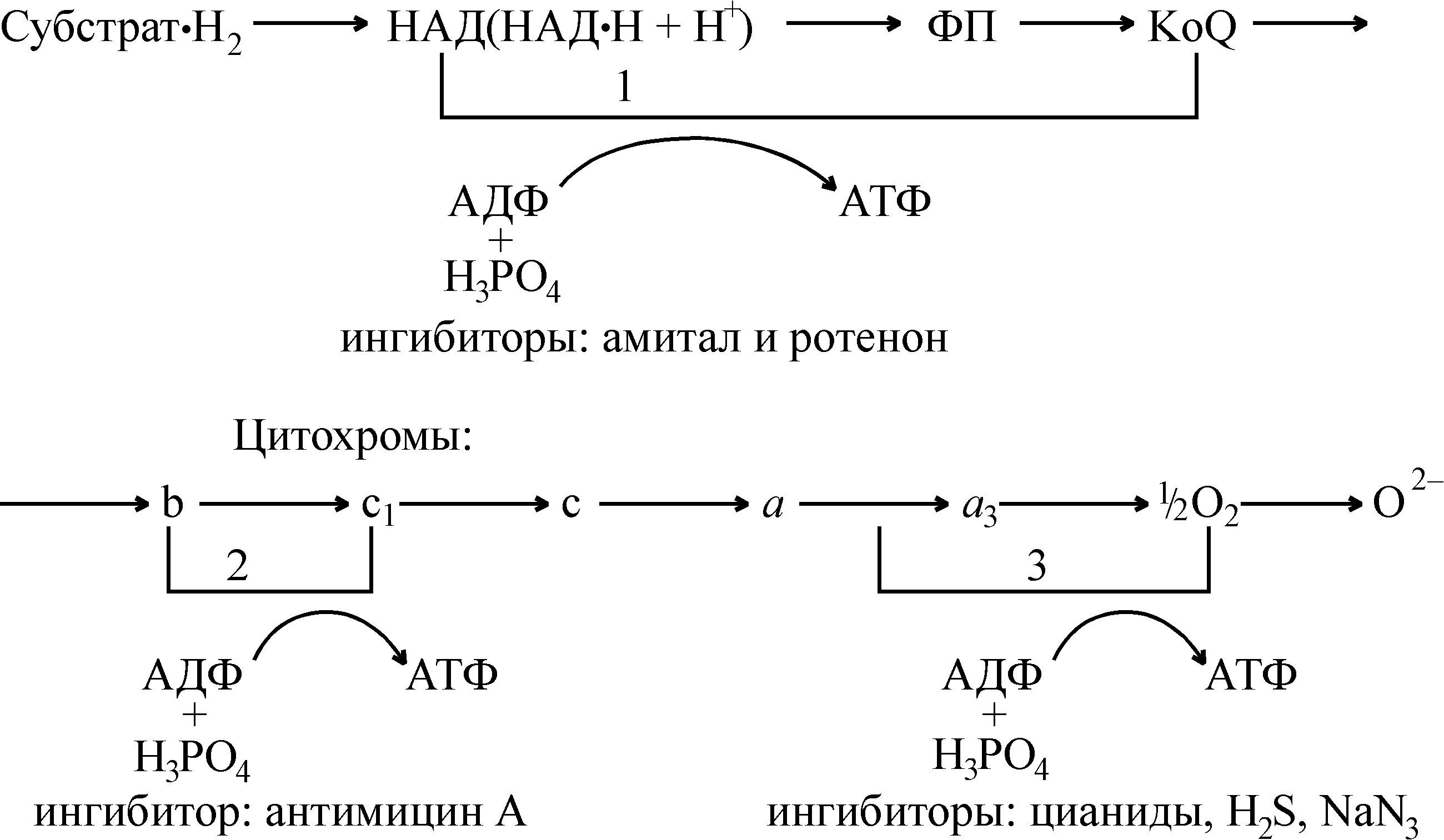
Рис.2 Локализация трех пунктов сопряжения дыхания и
фосфорилирования в дыхательной цепи
Следовательно, в дыхательной цепи есть 3 участка, в которых перенос электронов сопровождается большим снижением свободной энергии. Это те участки, где высвобождающаяся энергия запасается, т.е. используется для синтеза АТФ(рис.2).
Митохондрии и их роль в окислительном фосфорилировании
Митохондрии – это особые органеллы клеток, внутриклеточные центры аэробного дыхания. Они выделены из многих животных и растительных тканей, некоторых микроорганизмов и, как правило, представляют собой овальные тельца размером в длину 1–4 мкм, в поперечнике 0,3–0,7 мкм. Однако в разных клетках размеры и форма их могут быть существенно различными – от нитей до палочек, петель и сфер. В клетке в зависимости от ее типа и функций может находиться от нескольких десятков до нескольких тысяч митохондрий. Во многих клетках митохондрии распределены равномерно, однако наблюдается тенденция к локализации их в наиболее активных зонах клетки. В некоторых тканях митохондрии располагаются таким образом, чтобы обеспечить доставку АТФ к структурам, использующим энергию.
Структура митохондрий изучена методом электронной микроскопии. Они имеют две мембран – наружную и внутреннюю. Наружные мембраны митохондрий по своему химическому составу и другим свойствам довольно близки к другим внутриклеточным мембранам, тогда как внутренние мембраны резко от них отличаются. Внутренняя мембрана образует многочисленные выступы – так называемые кристы (лат. crista – гребень), общая поверхность их огромна. Так, в митохондриях печени суммарная поверхность внутренних мембран в расчете на 1 г белка равна 40 м2. Внутримитохондриальное пространство, ограниченное внутренней мембраной заполнено матриксом – гелеобразной полужидкой массой. Внутренняя мембрана отделена от наружной водным межмембранным пространством. Один из возможных упрощенных вариантов структуры митохондрий изображен на рис. 3. Митохондриальные мембраны представляют собой липопротеиновые структуры толщиной 5–7 нм.
Внутренняя и наружная мембраны существенно отличаются по составу, свойствам и функциям.
Наружная мембрана гладкая, хорошо проницаема для веществ, имеющих молекулярную массу до 10000. Для нее характерно высокое отношение количества фосфолипидов к белкам (примерно 1:1). В наружной мембране содержится ряд ферментов, участвующих в удлинении молекул насыщенных жирных кислот, монооксидазы и др.
В
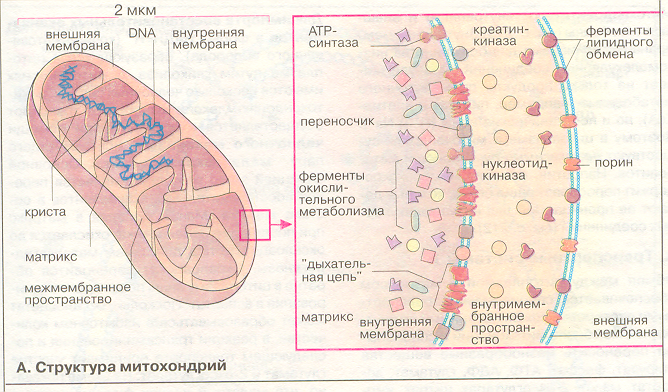
нутренняя мембрана митохондрий покрыта со стороны матрикса грибовидны
Рис.3 Структура митохондрий
ми выростами, которые в основном образованы H+-АТФ-синтетазой. Внутренняя мембрана непроницаема для большинства веществ. Она непроницаема для НАД+, НАДФ+, НАДH+H+, а также различных ионов, H+, OH-, К+, C1- и др. Проникают только вода и нейтральные молекулы с молекулярной массой меньше 150. Отношение фосфолипидов к белкам примерно 1:3. Внутренняя мембрана митохондрий во всех клетках выполняет одинаковую функцию: сопряжение окисления с синтезом АТФ, т.е. является сопрягающей мембраной. Она содержит ферменты дыхательной цепи и синтеза АТФ, различные ферменты, обеспечивающие транслокацию, в частности, осуществляющие перенос АДФ из цитозоля через внутреннюю мембрану в матрикс и обратный выход АТФ (АДФ-АТФ-транслоказа). Матрикс митохондрий содержит систему ферментов цикла Кребса, окисления жирных кислот, НАД- и ФАД-зависимые дегидрогеназы и др.
Механизм сопряжения дыхания
и фосфорилирования в митохондриях
В современном понимании окислительным фосфорилированием называется процесс образования АТФ при переносе электронов и протонов по дыхательной цепи согласно уравнению:
В настоящее время наиболее серьезное экспериментальное обоснование получила теория хемиосмотического сопряжения, разработанная английским биохимиком П. Митчеллом. Многое для ее доказательства сделано русским ученым В.П. Скулачевым.
Главную роль в хемиосмотической теории занимает внутренняя (сопрягающая) мембрана митохондрий, ее замкнутость и целостность, при нарушении которых синтез АТФ прекращается. Было обращено внимание на то, что окислительно-восстановительные ферменты и коферменты, составляющие дыхательную цепь, располагаются в определенной последовательности, векторно, образуя поперек внутренней мембраны петли, перекресты (рис. 4). Основным проявлением векторности в дыхательной цепи является переброс ионов H+ с внутренней поверхности мембраны (со стороны матрикса) на наружную. Обратный же переход H+ невозможен, так как внутренняя мембрана для них непроницаема.
Большинство ферментов дыхательной цепи довольно прочно закреплены в липидно-белковой конструкции мембраны и не имеет контактов с ее внутренней и наружной сторонами. Первое же звено дыхательной цепи, связанное с НАД+- или ФАД-дегидрогеназами, находится на внутренней поверхности мембраны, имеет выход в матрикс, куда направлены их активные центры, к которым поступают из матрикса субстраты для их дегидрирования. Атом водорода от НАДH+H+ захватывается снаружи флавопротеином, который расположен поперек внутренней мембраны. При этом электроны отдаются на железосерный белок, а H+ выталкиваются наружу. Электроны передаются дальше по цепи. Последнее звено – цитохромоксидаза также локализуется близко к внутренней поверхности мембраны, ее активный центр направлен в матрикс, куда и поступает молекулярный кислород.

Рис.4 Схема образования протонного потенциала в ходе дыхания (показаны предполагаемые участки перекреста ): 1 – матрикс, 2 -внутренняя мембрана митохондрий, 3 – межмембранное пространство, 4 – наружная мембрана, 5 – H+-АТФ-синтетаза, 6 – АДФ-АТФ-транслоказа, 7 – схематично показан круговорот ионов H+, протонный цикл.
Липидрастворимый кофермент Q (убихинон), легко диффундирующий с внутренней стороны мембраны (от матрикса) к наружной, и, передающий электроны далее по дыхательной цепи, является также переносчиком протонов из матрикса на наружную поверхность внутренней мембраны – в межмембранное пространство.
По мнению Митчелла, энергия переноса электронов и протонов по дыхательной цепи первоначально сосредоточивается в виде протонного потенциала или электрохимического градиента ионов H+, который создается перекачиванием ионов H+ через мембрану (в определенных пунктах дыхательной цепи) с внутренней поверхности внутренней мембраны (со стороны матрикса) на ее наружную поверхность – в межмембранное пространство. Иными словами, между водными фазами, разделенными внутренней мембраной, создается разность концентраций H+ (градиент концентрации H+) с более кислым значением pH снаружи. Одновременно поверхности мембраны заряжаются: наружная – положительно, за счет увеличения H+, а внутренняя – отрицательно за счет убывания концентрации H+ и избытка OH-, т.е. создается градиент электрического потенциала. Следовательно, цепь переноса электронов работает как протонный насос, перекачивая протоны из матрикса на наружную сторону мембраны.
Образовавшийся электрохимический потенциал заставляет протоны при их избытке на наружной стороне мембраны двигаться (по градиенту концентрации) в обратном направлении – во внутрь (в матрикс). Однако мембрана непроницаема для них, за исключением специальных участков – протонных каналов, имеющихся в ферментативном комплексе H+-АТФ-синтетазы, расположенной поперек внутренней мембраны, контактирующих как с межмембранным пространством, так и с матриксом. Обратная диффузия H+ в матрикс приводит к выравниванию разности концентраций H+ и происходит разрядка внутренней мембраны (исчезает электрический потенциал). Одновременно в активном центре фермента H+-АТФ-синтетазы происходит процесс окислительного фосфорилирования АДФ активным неорганическим фосфатом с образованием АТФ, т.е. энергия электрохимического потенциала трансформируется в химическую энергию макроэргической связи АТФ. Возникающая разность потенциалов в 0,25 В вполне достаточна для образования одной молекулы АТФ.
При сопряжении тканевого дыхания с фосфорилированием создается непрерывный круговорот ионов H+ (зарядка и разрядка внутренней мембраны), так называемый протонный цикл (рис. 4). Энергия протонного потенциала накапливается в молекуле АТФ – этом универсальном биологическом аккумуляторе энергии. Возврат H+ другими путями, минуя протонные каналы комплекса H+-АТФ-синтетазы, в том числе при участии веществ, легко проникающих в мембрану и отдающих свой H+ (разобщающих окисление с фосфорилированием), приводит к тому, что энергия выделяется в виде тепла. Таким образом, можно предполагать, что тканевое дыхание заряжает митохондриальную мембрану, а окислительное фосфорилирование разряжает ее, используя энергию мембранного потенциала для синтеза АТФ. При этом тканевое дыхание совершает осмотическую работу (концентрируя протоны в межмембранном пространстве митохондрий) и электрическую (создает разность электрических потенциалов), которая используется H+-АТФ-синтетазой на химическую работу, т.е. синтез АТФ. Сочетание этих двух функций дыхания и фосфорилирования дало основание назвать гипотезу хемиосмотической или протондвижущей, поскольку движущей силой фосфорилирования является протонный потенциал.
Синтезируемый в митохондриях АТФ клетка использует как химическое топливо при различных энерготратах. Поэтому митохондриальный АТФ необходимо доставить в ту часть клетки, где он необходим.
