контрольная_1. Обобщающее занятие по темам 28 Вопросы к проверочной самостоятельной работе 1 Тема Элементы химической термодинамики
 Скачать 43.7 Kb. Скачать 43.7 Kb.
|
|
«Утверждаю» Заведующий кафедрой общей и биологической химии ____________К.С.Эльбекьян Обобщающее занятие по темам 2-8 Вопросы к проверочной самостоятельной работе № 1 Тема 1. Элементы химической термодинамики 1. Основные понятия химической термодинамики: система, параметры системы, состояние системы, термодинамический процесс (определения и классификации). Внутренняя энергия, работа, теплота, связь между ними. 2. I начало термодинамики: определение, математическое выражение для изолированных и закрытых систем. Биологическое значение 1 начала термодинамики. 3. Закон Гесса: формулировка, математическое выражение. Следствия из закона Гесса. Значение для термохимических расчетов. 4. Энтальпия реакции, процессы экзо- и эндотермические; стандартные энтальпии образования простых и сложных веществ. Энтальпия сгорания. 5. Энтропия: определение, смысловое значение, факторы, влияющие на ее величину. Повозрастная динамика изменения энтропии организма. 6. II закон термодинамики: сущность, формулировка, математическое выражение для изолированных систем. 7. Энергия Гиббса как обобщенная термодинамическая функция, ее применение для прогнозирования возможности и предела самопроизвольного протекания процессов, роль энтальпийного и энтропийного факторов. 8. Особенности живых организмов как открытых систем: стационарное состояние, принцип И. Пригожина, поддержание состояния гомеостаза. 9. Особенности биохимических процессов в организме: принцип энергетического сопряжения, многостадийность, обратимость. Понятие информации. Закон адаптации. 10. Вычислить стандартную энергию Гиббса реакции гидратации сывороточного альбумина при 250С, для которой H0 6,08 кДж/моль, S0 5,85 Дж/(мольК). Оценить вклад энтальпийного и энтропийного фактора. 11. Рассчитать тепловой эффект реакции окисления глюкозы: С6Н12О6(г) + 6О2(г) = 6Н2О(ж) + 6СО2(г); Н0 = ? Н0обр.[C6H12O6(т)] = –1260 кДж/моль; Н0обр.[CO2(г)] = –393,5 кДж/моль; Н0обр.[H2O(ж)] = –285,8 кДж/моль. 12. Вычислить стандартную энтальпию реакции: С6Н6 (ж) + 3Н2 (г) = С6Н12(ж), используя значения стандартных энтальпий сгорания веществ. ∆Hосг(С6Н6) = -3910,28 кДж/моль ∆Носг(Н2) = -286 кДж/моль ∆Носг(С6Н12) = -3920 кДж/моль 13. В организме человека реакция окисления этилового спирта протекает в две стадии. Первая – окисление этилового спирта до уксусного альдегида: С2Н5ОН(ж)+ ½ О2(г) = СН3СНО(р-р)+Н2О(ж); ∆Но = -256 кДж/моль. Вторая – окисление уксусного альдегида до уксусной кислоты: СН3СНО(р-р)+ ½ О2(г) = СН3СООН(р-р), ∆Но = -237 кДж/моль. Рассчитать ∆Но реакции окисления этанола до уксусной кислоты. 14. Рассчитать, какое количество теплоты поглотится при растворении в воде 23,8 г бромида калия, если Нораств. = 17 кДж/моль. Тема 2. Химическая кинетика и катализ 1. Основные понятия химической кинетики: -реакции гомогенные, гетерогенные, математическое выражение скорости гомогенных и гетерогенных реакций, скорость средняя и истинная, единицы измерения, примеры; -реакции простые и сложные: последовательные, параллельные, последовательно-параллельные, циклические, примеры. Опишите как влияют на скорость гомогенных реакций следующие факторы: природа, концентрация реагентов, температура, катализаторы. Приведите примеры. 2. Закон действующих масс, кинетические уравнения реакций, физический смысл константы скорости реакции. Напишите кинетические уравнения для реакций: а)2СО(г)+О2(г) → 2СО2(г); б) Н2(г)+S(тв.) → H2S(тв.) Понятие о молекулярности и порядке реакции. Примеры. Биологическая роль. 3. Теория активных соударений. Природа энергии активации. Переходное состояние. Ответ пояснить, используя энергетический профиль экзотермической реакции. 4. Влияние температуры на скорость реакции, особенности для биохимических процессов. Правило Вант-Гоффа. Энергия активации, ее значение, факторы, влияющие на величину энергии активации, источники активации реагирующих частиц. Уравнение Аррениуса, значение для характеристики скорости протекания химических реакций. 5. Катализ, катализаторы, ингибиторы, общие принципы катализа: -суть механизма гомогенного катализа, примеры; -особенности механизма гетерогенного катализа, примеры. 6. Химическая природа ферментов и их биологическая роль. Особенности ферментативного катализа: активность, специфичность, размер. Зависимость скорости ферментативной реакции от температуры, рН-среды, концентрации фермента (пояснить графиками). 7. Зависимость скорости ферментативной реакции от концентрации субстрата. Уравнение Михаэлиса – Ментен, его анализ и значение для кинетики ферментативных реакций. 8. Химическое равновесие и его смещение, принцип Ле–Шателье и его аналог в природе – принцип адаптивных перестроек. 9. Закон действующих масс для обратимых процессов. Константа химического равновесия, способы ее выражения, факторы, влияющие на ее величину, связь с изобарно-изотермическим потенциалом (G), значение для характеристики обратимых процессов. 10. Вычислить, во сколько раз возрастет скорость реакции при повышении температуры с 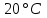 до до 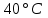 , если температурный коэффициент скорости реакции равен 3. Дайте формулировку и математическое выражение соответствующего правила. , если температурный коэффициент скорости реакции равен 3. Дайте формулировку и математическое выражение соответствующего правила. 11. Используя соответствующее правило, вычислить, на сколько нужно повысить температуру, чтобы скорость реакции возросла в 80 раз? Температурный коэффициент скорости принять равным 3. 12. Во сколькораз увеличится скорость химической реакции при повышении температуры от 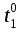 100C до 100C до  800С, если температурный коэффициент скорости равен 2? Дайте формулировку и математическое выражение соответствующего правила. 800С, если температурный коэффициент скорости равен 2? Дайте формулировку и математическое выражение соответствующего правила. 13. Во сколько раз возрастет скорость реакции при повышении температуры с 20 до 100 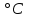 , если температурный коэффициент скорости реакции равен 2,3. , если температурный коэффициент скорости реакции равен 2,3.14. Температурный коэффициент скорости реакции равен 3,1. Во сколько раз увеличится скорость реакции, если повысить температуру на 30 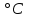 ? ?Тема 3. Коллигативные свойства растворов. 1. Осмотическое давление 0,1 М  при 0 при 0 равно равно  Па. Определить кажущуюся степень диссоциации соли в данном растворе. Пояснить, почему сильные электролиты дают кажущееся значение степени диссоциации. Па. Определить кажущуюся степень диссоциации соли в данном растворе. Пояснить, почему сильные электролиты дают кажущееся значение степени диссоциации.2. Осмотическое давление, закон Ват-Гоффа ( формулировка, математическое выражение).Осмотическое давление раствора неэлектролита при 17 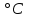  Па. Определить осмотическое давление этого же раствора при 57 Па. Определить осмотическое давление этого же раствора при 57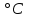 3. Ионная сила раствора (определение, математическое выражение). Рассчитать ионную силу 0,1 моль/л раствора 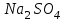 . . 4. Над каким из растворов при одинаковых молярных концентрациях давление пара растворителя будет наибольшим: а) NaCl; б) фруктоза (C6H12O6); в) Al2(SO4)3. Ответ обоснуйте. Напишите математическое выражение соответствующего закона. 5. Дайте определение понятиям: осмос, экзоосмос, эндоосмос. Каковы их последствия. Что произойдет с эритроцитами при 310 К в 2-% растворе глюкозы (ρ=1,006 г/мл)? Тема 4. Теория кислот и оснований. Водородный показатель. Значение рН 1.Дайте определение кислотам и основаниям Бренстеда. Укажите типы кислот и оснований, приведите примеры. Для написанных вами кислот и оснований укажите сопряженные протолитические пары. Амфолиты. Примеры. 2.Дайте определение водородному показателю, выведите его, исходя из ионного произведения воды. 3.Рассчитать рН растворов, если: а) [Н+] = 10-3 ; б) [Н+] = 10-9. Указать характер среды. Дайте определение водородному и гидроксильному показателям. Напишите их математические выражения. 4.Константа диссоциации бензойной кислоты 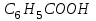 равна равна 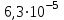 . Вычислить при какой концентрации степень диссоциации . Вычислить при какой концентрации степень диссоциации 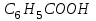 будет равна 3%. будет равна 3%.5. Найти степень диссоциации по первой ступени сероводородной кислоты в 0,1 М растворе, если константа диссоциации для этой ступени равна 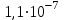 . . 6.Вычислить концентрацию ионов водорода [ 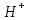 ] в 0,2 М растворе муравьиной кислоты, если степень диссоциации ее равна 3%. ] в 0,2 М растворе муравьиной кислоты, если степень диссоциации ее равна 3%.Тема 5. Буферные системы крови. Кислотно-основное состояние организма. Дайте определения понятиям «буферная система», «буферное действие». Классификация буферных систем. Назовите буферные системы организма. Напишите механизм буферного действия одной из них (по выбору). Выведите рН буферных систем на примере гидрокарбонатного буфера (уравнение Гендерсона-Гассельбаха). Объясните, от каких факторов зависит рН буферного раствора. Дайте определения количественным характеристикам буферных растворов: буферная емкость, зона буферного действия. Приведите их математические выражения. От каких факторов зависит буферная емкость? Какова особенность буферной емкости крови? Приведите сравнительную характеристику буферных систем, функционирующих в цельной крови и плазме. Приведите состав гидрокарбонатной буферной системы и покажите механизм ее действия. Уравнение расчета рН для этой системы. Состав, механизм действия и биологическая роль фосфатной буферной системы. Уравнение для расчета рН фосфатной буферной системы. Гемоглобиновая и оксигемоглобиновая буферные системы крови, механизм действия, биологическая роль. Напишите уравнение Гендерсона-Гассельбаха для определения рН крови. Нарушение кислотно-основного равновесия: ацидоз, виды и причины возникновения. Нарушение кислотно- основного равновесия: алкалоз, виды и причины возникновения. Щелочной резерв, определение и количественная оценка. У больного жалобы на усиление количества выделяемой мочи (полиурия). Обследование показало увеличение сахара крови, количества кетоновых тел, рН крови имеет значение 7,3. Охарактеризовать кислотно-основное состояние крови и назвать симптомы какого заболевания названы. Щелочной резерв крови, рН крови в норме и при патологии. Вследствие диареи произошло падение рН крови до 7,29. Охарактеризовать кислотно-основное равновесие крови больного. Чем вызван сдвиг рН? Что является причиной падения значения рН крови при недостатке кислорода в крови и тканях новорожденного? Охарактеризовать кислотно-основное равновесие крови больного. При менингите у детей (менингит – воспаление мозговых оболочек разной этиологии) и при истерии у взрослых, наблюдается частое дыхание, головокружение, в конечном счете, может произойти потеря сознания. Как изменяется при этом кислотно-основное состояние организма? Как смещается рН крови? На титрование 5 мл ацетатного буфера затрачено 3 мл раствора NaOH(Cf) =0,1 моль/л. Рассчитать буферную емкость системы, если рНо = 3, а после титрования рН = 7,5. Тема 6. Комплексные соединения. Лигандообменные равновесия и процессы Современные представления о строении комплексных соединений. Ответ поясните на примере комплексного соединения катионного, анионного и нейтрального типа. Дайте определения понятиям лиганд, дентатность лиганда. Приведите по два примера лигандов с разной дентатностью. Назовите лиганды. Металло-лигандный гомеостаз и причины его нарушения. Объясните с позиции теории жестких и мягких кислот и оснований (ЖМКО) токсичность ионов тяжелых металлов. Понятие о константе нестойкости и константе устойчивости комплексного соединения, их использование в лигандообменных равновесиях. Приведите примеры, конкурирующих процессов, приводящих к разрушению комплексного соединения. Особенности строения металлоферментов и биокомплексных соединений (на примере гемоглобина, витамина В12). Опишите физико-химические основы хелатотерапии. Приведите 2-3 примера препаратов, применяемых в хелатотерапии, напишите формулы и назовите их. Изложите основные теоретические положения трилонометрического титрования: титрант, индикатор, уравнения реакций, лежащих в основе метода, возможности использования в санитарно-гигиенической практике и медико-биологических исследованиях. Напишите структурные формулы ЭДТА и Трилона Б. Определите дентатность соединений как лигандов. Укажите области использования в медицине и в санитарной практике. Константы нестойкости комплексных ионов [Co(NH3)6]3+, [Fe(CN)6]4-, [Fe(CN)6]3- соответственно равны 6,2∙10-36, 1,0∙10-37, 1,0∙10-44. Какой из этих ионов является более прочным? Для этого иона напишите суммарное уравнение вторичной диссоциации и выражение константы нестойкости. Рассчитать жесткость воды (в ммоль/л), если на титрование исследуемого образца объемом 5 мл пошло 1,5 мл раствора Трилона Б (молярная концентрацияCf = 0,05 моль/л. Указать вид жесткости воды. Тема 7. Гетерогенные процессы 1.Условия образования и растворения осадков в гетерогенных процессах. 2.В какой последовательности будут осаждаться малорастворимые электролиты AgCI, AgBr, AgI, если к раствору, содержащему ионы CI-,Br-, I- постепенно добавлять AgNO3 (Ks(AgCI)=1,8.10-10, (Ks(AgBr)=5,0.10-13, Ks(AgI)=8,3.10-17)? Ответ поясните. Уакажите вид конкурирующего процесса. 3.Гетерогенные процессы в жизнедеятельности: реакции, лежащие в основе образования неорганического вещества костной ткани. Регуляция образования костной ткани с помощью витаминов, гормонов и рН среды. 4.Патологические гетерогенные процессы: явление изоморфизма, реакции, лежащие в основе образования конкрементов. Химические реакции, лежащие в основе разрушения костной ткани. 5. Метод осаждения: принцип метода, титрант, выбор индикатора. Напишите уравнения соответствующих реакций. Применение метода в санитарно-гигиенической практике и медицине. 6.Химический состав зубной эмали и её разрушение при нарушении кислотно-щелочного и гетерогенного равновесий в полости рта. 7. Условия существования гетерогенных равновесий. Константа гетерогенного равновесия. Взаимосвязь между растворимостью (S) и константой растворимости (Ks). Покажите на примере AgCI и Ag2CrO4 8. Осадительное титрование (аргентометрия). Принцип выбора индикатора. Реакции, лежащие в основе данного метода. 9. Рассчитайте содержание хлорид – ионов, молярную концентрацию эквивалента, титр (Cf,Т) в сыворотке крови, если на титрование 2 мл сыворотки затрачено 0,5 мл раствора AgNO3(Cf) =0,05 моль/л. Указать метод определения, вид титранта. 10.Константы растворимости Ks (Ag2SO4)=1,8 .10 -5 и Ks (CaSO4)=2,4. 10-5 величины одного порядка. Одинаковы ли молярные растворимости этих солей? Ответ обосновать с помощью расчетных формул. Обсуждение на заседании кафедры «__»_________20____ протокол №___ |
