|
|
Химия.. Теория переходного состояния (активированного комплекса)
19. Теория активированного комплекса. Энергия активации. Уравнение Аррениуса. Энергетическая диаграмма реакции.
Теория переходного состояния (активированного комплекса)
В попытках устранить недостатки теории активных столкновений ученые предложили новую теорию химической кинетики. Это сделали практически одновременно в 1935 году, более чем через полвека после открытий Аррениуса, Г.Эйринг (США) с одной стороны, а также М.Поляни и М.Г.Эванс (Великобритания) - с другой. Они предположили, что химическая реакция между началом и завершением претерпевает некое «переходное состояние», как его назвали Эванс и Поляни, при котором образуется неустойчивый «активированный комплекс» (термин Эйринга). Энергия активации как раз и требуется для достижения этого состояния, при котором вероятность успешного завершения реакции весьма велика. Поэтому энергия активации и может быть меньшей, чем энергия разрыва исходных химических связей.
Суть теории переходного состояния (активированного комплекса):
1)частицы реагентов при взаимодействии теряют свою кинетическую энергию, которая превращается в потенциальную, и для того чтобы реакция свершилась, необходимо преодолеть некий барьер потенциальной энергии;
2) разница между потенциальной энергией частиц и упомянутым энергетическим барьером и есть энергия активации;
3) переходное состояние находится в равновесии с реагентами;
4) в тех реакциях, где энергия активации существенно ниже энергии разрыва химических связей, процессы образования новых связей и разрушения старых связей могут полностью или частично совпадать по времени.

| Энергия активации
Энергия активации, разность между значениями средней энергии частиц (молекул, радикалов, ионов и др.), вступающих в элементарный акт химической реакции, и средней энергии всех частиц, находящихся в реагирующей системе. Для различных химических реакций Э. а. изменяется в широких пределах — от нескольких до 10 дж./ моль. Для одной и той же химической реакции значение Э. а. зависит от вида функций распределения молекул по энергиям их поступательного движения и внутренним степеням свободы (электронным, колебательным, вращательным).
В рамках представлений теории абсолютных скоростей реакций Э. а. — разность между значениями средней энергии активированных комплексов и средней энергии исходных молекул.
Представления об Э. а. возникли в 70—80-х гг. 19 в. в результате работ Я. Вант-Гоффа и С. Аррениуса, посвященных изучению влияния температуры на скорость химической реакции. Константа скорости реакции k связана с Э. а. (Е) уравнением Аррениуса:
k = koe-E/RT
где R — газовая постоянная, Т — абсолютная температура в К, ko — постоянная, называемая предэкспоненциальным множителем константы скорости. Это уравнение, основанное на молекулярно-кинетической теории, позже было получено в статистической физике с учетом ряда упрощающих предположений, одно из которых — независимость Э. а. от температуры. Для практики и для теоретических расчетов в сравнительно узких температурных интервалах это предположение справедливо.
Э. а. можно найти по экспериментальным данным несколькими способами. Согласно одному из них, исследуют кинетику реакции при нескольких температурах (о методах см. в ст. Скорость химической реакции) и строят график в координатах In k — 1/T; тангенс угла наклона прямой на этом графике, в соответствии с уравнением Аррениуса, равен Е. Для одностадийных обратимых реакций (см. Обратимые и необратимые реакции) Э. а. реакции в одном из направлений (прямом или обратном) можно вычислить, если известна Э. а. реакции в другом и температурная зависимость константы равновесия (из термодинамических данных). Для более точных расчетов следует учитывать зависимость Э. а. от температуры.
Э. а. сложных реакций представляет собой комбинацию Э. а. элементарных стадий. Иногда, помимо истинной Э. а., определяемой по уравнению Аррениуса, используют понятие "кажущейся" Э. а. Например, если константы скоростей гетерогенно-каталитических реакций определяют по изменению объемных концентраций исходных веществ и продуктов, то кажущаяся Э. а. отличается от истинной на величину тепловых эффектов, сопровождающих процессы адсорбции и десорбции реагирующих веществ на поверхности катализатора. В неравновесных системах, например плазмохимических (см. Плазмохимия), определение Э. а. является очень сложной задачей. В некоторых случаях, однако, возможно формальное применение уравнения Аррениуса.
Энергетическая диаграмма реакции.
Энергия активации ощутимо влияет на значение константы скорости реакции и ее зависимости от температуры: чем больше Еа, тем меньше константа скорости и тем значительнее влияет на нее изменение температуры.
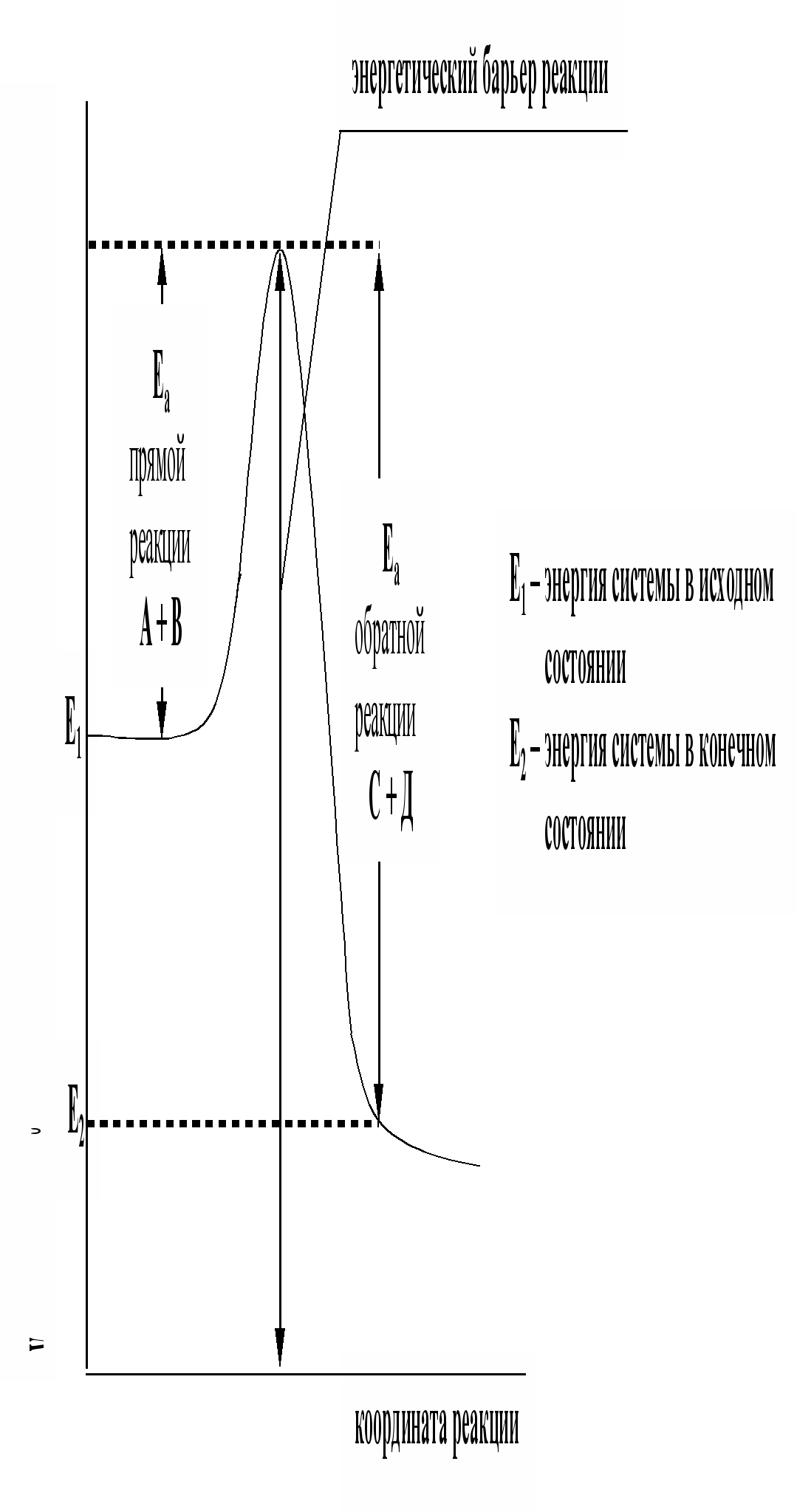
Рис.5. Энергетическая диаграмма реакции А + В = С + Д
20. Катализ и катализаторы(классификация и механизм действия). Особенности каталитических реакций.
Химический катализ - ускорение химических реакций под действием малых количеств веществ (катализаторов). После полного цикла промежуточных химических взаимодействий катализатор восстанавливает свой химический состав.
Катализаторы подразделяются на гомогенные и гетерогенные. Гомогенный катализатор находится в одной фазе с реагирующими веществами, гетерогенный -- образует самостоятельную фазу, отделённую границей раздела от фазы, в которой находятся реагирующие вещества. Типичными гомогенными катализаторами являются кислоты и основания. В качестве гетерогенных катализаторов применяются металлы, их оксиды и сульфиды.
Реакции одного и того же типа могут протекать как с гомогенными, так и с гетерогенными катализаторами. Так, наряду с растворами кислот применяются имеющие кислотные свойства твёрдые Al2O3, TiO2, ThO2, алюмосиликаты, цеолиты. Гетерогенные катализаторы с основными свойствами: CaO, BaO, MgO.
Гетерогенные катализаторы имеют, как правило, сильно развитую поверхность, для чего их распределяют на инертном носителе (силикагель, оксид алюминия, активированный уголь и др.).
Для каждого типа реакций эффективны только определённые катализаторы. Кроме уже упомянутых кислотно-основных, существуют катализаторы окисления-восстановления; для них характерно присутствие переходного металла или его соединения (Со+3, V2O5+ , MoO3). В этом случае катализ осуществляется путём изменения степени окисления переходного металла.
Много реакций осуществлено при помощи катализаторов, которые действуют через координацию реагентов у атома или иона переходного металла (Ti, Rh, Ni). Такой катализ называется координационным.
Если катализатор обладает хиральными свойствами, то из оптически неактивного субстрата получается оптически активный продукт.
В современной науке и технике часто применяют системы из нескольких катализаторов, каждый из которых ускоряет разные стадии реакции. Катализатор также может увеличивать скорость одной из стадий каталитического цикла, осуществляемого другим катализатором. Здесь имеет место «катализ катализа», или катализ второго уровня.
В биохимических реакциях роль катализаторов играют ферменты.
Различают гомогенный и гетерогенный катализ, но для любого из них основные закономерности сводятся к следующему:
1. Катализатор активно участвует в элементарном акте реакции, образуя либо промежуточные соединения с одним из участников реакции, либо активированный комплекс со всеми реагирующими веществами. После каждого элементарного акта он регенерируется и может вступать во взаимодействие с новыми молекулами реагирующих веществ.
2. Скорость каталитической реакции пропорциональна количеству катализатора.
3. Катализатор обладает избирательностью действия. Он может изменять скорость одной реакции и не влиять на скорость другой.
4. Катализатор дает реакции возможность протекать по другому пути, причем с большей скоростью, чем это происходит в отсутствии катализатора.
Скорость может возрастать за счет снижения энергии активации, увеличения предэкспоненциального множителя или за счет обоих факторов. Например, термическое разложение ацетальдегида СН3СНО СН4 + СО катализируется парами йода, что вызывает снижение энергии активации на 55 кДж/моль. Это снижение вызывает увеличение константы скорости примерно в 10000 раз.
5. Катализатор не влияет на положение термодинамического равновесия. Он в одинаковой степени изменяет скорость как прямой, так и обратной реакции.
6. При добавлении некоторых веществ, называемых промоторами, активность катализатора растет; добавление ингибиторов уменьшает скорость реакции.
Гомогенный катализ.
В гомогенном катализе катализатор представляет собой молекулу или ион, находящиеся в гомогенном растворе. В случае гомогенного катализа катализатор и все реагирующие вещества составляют одну общую фазу.
Примером гомогенного катализа является реакция термического разложения ацетальдегида СН3СОН СН4 + СО, катализируемая парами йода. В отсутствие паров йода Еа =191.0 кДж/моль, в их присутствии Еа = 136.0 кДж/моль. Константа скорости возрастает в 10000 раз. Это происходит потому, что реакция протекает в две стадии:
СН3СОН + I2 = CH3I + HI + СО
CH3I + HI = СН4 + I2
Энергия активации каждой стадии меньше, чем энергия активации некаталитической реакции.
К гомогенному катализу относятся многие кислотно-основные реакции, реакции комплексообразования, окислительно-восстановительные реакции, многочисленные реакции гидрирования, сульфедирования и др.
3. Кислотный и основный катализ
Кислоты и основания во многих реакциях выполняют функции катализатора, т.е., участвуя в реакции, сами не расходуются (реакции гидролиза, алкилирования, этерификации и др. Различают три типа кислотно-основноного катализа:
4. Гомогенно-каталитические реакции, катализируемые комплексными соединениями
Реакции восстановления, гидрирования, окисления, изомеризации, полимеризации в промышленных условиях осуществляются в присутствии катализаторов -- комплексных соединений (ионов металлов VIII группы таблицы Менделеева Fe, Со, Ni, Ru, а так же Си, Fg, Hg, Cr, Мn). Сущность каталитического действия заключается в том, что ионы металлов выступают как доноры или акцепторы электронов. Химическое взаимодействие между реагирующими молекулами, координированными около центрального иона металла, облегчается благодаря поляризации молекул и понижению энергии отдельных связей. Центральный ион металла является мостиком, облегчающими электронные переходы между реагирующими молекулами.
5. Ферментативный катализ
Ферменты являются наиболее удивительными катализаторами. С ними связано множество реакций в живых организмах, и поэтому их часто называют биологическими катализаторами. Ферментативный катализ -- явление более сложное, чем обычный катализ. Высокая организованность процессов ферментативного катализа определяется особенностью взаимодействия в живом организме, связанной с особым сочетанием молекулярного строения ферментов и субстратов, которыми в ферментативных реакциях называют реагирующие вещества.
6. Гетерогенный катализ
Гетерогенный катализ осуществляется на поверхности раздела фаз. Первой наблюдаемой гетерогенно-каталитической реакцией была осуществленная Пристли (1778) дегидратация этилового спирта на активной глине:
С2Н5ОН -- С2Н4 + Н2O
На практике наиболее часто встречаются два типа гетерогенного катализа:
1) процессы, катализатор которых находится в твердой фазе, а реагирующие вещества -- в жидкой;
2) процессы, катализатор которых находится в твердой фазе, а реагирующие вещества -- в газовой. Реакция, как правило, происходит (а в некоторых многостадийных процессах начинается) на границе раздела фаз, т.е. на поверхности твердого тела -- катализатора.
61. Общая характеристика элементов II-А группы. Биологическая роль S-элементов II-A группы.
Элементы IIA группы имеют электронную формулу ns2. Все они являются металлами, сильными восстановителями, несколько менее активным, чем щелочные металлы. Для них характерна степень окисления +2 и pвалентность 2. При образовании ковалентной связи происходит s возбуждение электрона и sp-гибридизация АО. Элементы IIA группы можно разделить на три части: 1) щелочноземельные металлы Ca, Sr, Ba, Ra, основания которых являются щелочами, 2) Мg, основание которого мало растворимо в воде, 3) Ве, основание которого является амфотерным основанием. В природе элементы IIA группы находятся в виде солей: сульфатов, карбонатов, фосфатов, силикатов. Эти элементы получают электролизом расплавов их солей. Элементы IIA группы представляют собой легкие серебристые металлы, более твердые, чем щелочные металлы.
Химические свойства элементов
Элементы IIA группы - менее активные восстановители, чем щелочные металлы. Их восстановительные свойства увеличиваются от бериллия к радию. Кислород воздуха окисляет Ca, Sr, Ba, Ra при обычной температуре. Mg и Be покрыты оксидными пленками и окисляются кислородом только при нагревании:
2Ca + O2 = 2CaO
2Mg + O2 =2MgO
Активные восстановители, металлы IIA группы, реагируют с неметаллами (например, с хлором), водой, кислотами:
Ca + Cl2= CaCl2
Ca+ 2H2O= Ca(OH) 2 + H2
^ Химические свойства соединений
Гидриды щелочноземельных металлов являются ионными солеобразными соединениями и взаимодействуют с водой и кислотами:
CaH2 + 2H2O Ca(OH)2 + 2H2
CaH2+ 2HCl 2 CaCl2 + 2H2
Оксиды щелочноземельных металлов Ca, Sr, Ba, Ra растворяются в воде c образованием щелочей. Оксид магния - мало растворим в воде и имеет только основные свойства. Нерастворимый в воде оксид бериллия имеет амфотерные свойства.
BeO + H2O
CaClCaO + 2HCl 2 + H2O
Гидроксиды Ca, Sr, Ba, Ra являются щелочами, гидроксид Mg - малорастворимый основной гидроксид, гидроксид Be - амфотерный гидроксид.
Карбонаты и сульфаты элементов IIA группы малорастворимы в воде. Карбонаты растворяются в кислотах:
Содержание ионов Ca2+ и Mg2+ обуславливает жесткость воды: временную, если есть гидрокарбонаты Ca и Mg, и постоянную, если в воде есть хлориды или сульфаты Ca и Mg. При кипячении жесткая вода смягчается за счет уменьшения временной жесткости воды:
СЖесткость воды (Ж) измеряется в миллимолях эквивалентов солей в 1 литре воды: Ж = 1000э , где Сэ - молярная концентрация эквивалентов (нормальность) солей в воде.
Соли BaCl2 и BaCO3 ядовиты и используются в качестве инсектицидов. Магний является важным конструкционным материалом, является микроэлементом, входит в состав хлорофилла. Гашеная известь используется в строительстве. Соли кальция, например, CaSO42H2O - гипс - используется для гипсования засоленных почв.
Биологическая роль.
Бериллий находится в растениях, а также в организмах животных. Содержание бериллия в живых организмах составляет 10-7 %, т. е. он является примесным ультрамикроэлементом. Биологическая роль бериллия изучена недостаточно. Соединения бериллия токсичны и вызывают ряд заболеваний (бериллиевый рахит, бериллиоз и т. д.). Особенно токсичны летучие соединения бериллия. Отрицательное влияние Ве2 + на физиологические процессы объясняется его химическими свойствами.
Магний формально относится к макроэлементам. Общее содержание его в организме – 0,027% (около 20 г). Топография магния в организме человека такова: в наибольшей степени магний концентрируется в дентине и эмали зубов, костной ткани. Накапливается он также в поджелудочной железе, скелетных мышцах, почках, мозге, печени и сердце. У взрослого человека суточная потребность в магнии составляет около 0,7 г. Ион Mg, так же как и ион K, является внутриклеточным катионом.
В биологических жидкостях и тканях организма магний находится как в виде акваиона, так и в связанном с белками состоянии в количестве < 10-2%, т. е., в сущности, это микроэлемент. Концентрация ионов Mg внутри клеток примерно в 2,5—3 раза выше, чем во внеклеточных жидкостях. Ионы магния играют важную биологическую роль в организме человека. Вследствие меньшего радиуса иона и большей энергии ионизации Mg2+ образует более прочные связи, чем ион Ca, и поэтому является более активным катализатором ферментативных процессов. Входя в состав различных ферментативных систем, ион Mg является их незаменимым 38б компонентом и активатором (такие ферменты, как карбоксипептидаза, холинэстераза и некоторые другие, являются специфическими для иона Mg). Гидролиз АТФ, сопряженный с рядом ферментативных реакций, в результате которых образуется гидрофосфат-ион НРО2- и выделяется большое количество энергии, проходит при избытке Mg2+.
Кальций относится к макроэлементам. Общее содержание его в организме – 1,4%. Кальций содержится в каждой клетке человеческого организма. Основная масса кальция находится в костной и зубной тканях. В среднем взрослый человек в сутки должен потреблять 1 г кальция, хотя потребность в кальции составляет только 0,5 г. Кальций, вводимый с пищей, только на 50% всасывается в кишечнике. Сравнительно плохое всасывание является следствием образования в желудочно-кишечном тракте труднорастворимых фосфата кальция Са3(РO4)2 и кальциевых солей жирных кислот. В организме концентрация ионов Са регулируется гормонами.
В костях и зубах взрослого человека около 1 кг кальция находится в виде нерастворимого кристаллического минерала – гидроксилапатита Са10(РО4)6(ОН)2 , образование которого происходит при взаимодействии ионов Са с фосфат-ионами. В крови и лимфе кальций на–ходится как в ионизированном, так и в неионизированном состоянии – в соединениях с белками, углеводами и др. Механизм свертывания крови состоит из ряда эта–пов, зависящих от наличия ионизированного Са. Ионы Са принимают участие в передаче нервных импульсов, со–кращении мышц, регулировании работы сердечной мышцы.
Концентрация ионов Са внутри и вне клетки соответ–ственно составляет 10-6 и (2,25—2,8) 10-3 моль/л. По–скольку кальций практически не используется внутри клетки, он выступает в качестве строительного мате–риала в организме – в костях, зубах. Скелет – основ–ное хранилище кальция в организме.
| |
|
|
 Скачать 91.17 Kb.
Скачать 91.17 Kb.
