1. Кислотноосновные свойства органических соединений, образование солей. Факторы, влияющие на кислотность и основность
 Скачать 0.79 Mb. Скачать 0.79 Mb.
|
 1.Кислотно-основные свойства органических соединений, образование солей. Факторы, влияющие на кислотность и основность. 1.Кислотно-основные свойства органических соединений, образование солей. Факторы, влияющие на кислотность и основность.Важными аспектами реакционной способности органических соединений являются их кислотные и основные свойства, которые часто обусловливают существование большинства органических биомолекул в условиях организма в ионном состоянии. Для оценки кислотности и основности органических соединений наибольшее значение имеют теория Бренстеда и теория Льюиса. Кислоты и основания Бренстеда По его теории (протолитической) кислотность и основность соединений связывается с переносом протона H+ Кислота ↔ H+ + Основание Кислоты Бренстеда (протонные) – нейтральные молекулы или ионы, способные отдавать протон (доноры). Основания Бренстеда – нейтральные молекулы или ионы, способные присоединять протон (акцепторы). Кислотность и основность являются не абсолютными, а относительными свойствами соединений: кислотные свойства обнаруживаются в присутствии основания; основные свойства – в присутствии кислоты. Кислоты и основания Льюиса По его теории кислотные и основные свойства соединений определяются их способностью принимать или отдавать пару электронов с образованием связи. Кислоты Льюиса- акцепторы пары элетронов; Основания Льюиса – доноры пары электронов. Стабильность аниона определяется рядом факторов. 1. Устойчивость аниона обусловлена делокализацией отрицательного заряда: чем выше степень делокализации отрицательного заряда в анионе, тем устойчивее образующийся анион, тем сильнее кислотные свойства. Эффект сопряжения способствует стабилизации аниона и усилению кислотных свойств. 2. Устойчивость аниона определяется электроотрицательностью элемента в кислотном центре. Чем больше ЭО, тем сильнее кислотные свойства (ЭО обычно сравнивают для элементов одного периода). 3. Устойчивость аниона связана с поляризуемостью атома в кислотном центре. Поляризуемость атома – мера смещения внешнего электронного облака под действием электрического поля (чем больше электронов на внешнем энергетическом уровне и чем дальше они расположены от ядра, тем больше поляризуемость. 4. Сольватационные эффекты оказывают влияние на устойчивость аниона. Чем больше эффект сольватации, тем сильнее кислотные свойства. 5. Электронная природа заместителя. Связанного с кислотным центром влияет на устойчивость аниона. Электроакцепторные (ЭА) заместители усиливают кислотные свойства. Электродонорные (ЭД) заместители уменьшают кислотные свойства. СH3—C—OH + NaOH CH3—C—ONa + H2O 2. Качественные реакции на многоатомные спирты, фенолы. На многоатомные спирты качественной реакцией является реакция с Cu(OH)2 . В результате взаимодействия мутно-голубой цвет гидроксида меди (II) изменяется на ярко-синий цвет спиртовой соли меди (т.к. Образуется комплексное соединение). 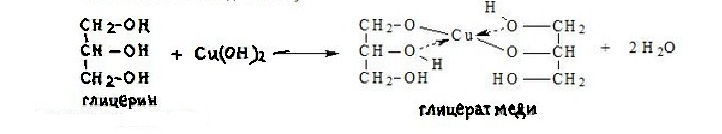 На фенол качественная реакция – с хлоридом железа (III). В результате образуется характерное сине-фиолетовое окрашивание. Кстати, на многоатомные фенолы (гидрохинон, резорцин) реакция с хлоридом железа может давать красное или зеленое окрашивание. 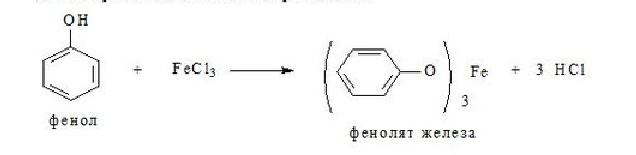 3. Структура молочной, яблочной, винной и лимонной кислот, название солей. Биологическое значение. Молочная кислота →лактаты CH3-CH-COOH ǀ OH Гликолиз - расщепление глюкозы без потребления кислорода, сложный ферментативный процесс, протекающий в тканях человека и животных. В результате глюкоза превращается в молочную кислоту с образованием богатых энергией фосфорных соединений - АТФ. Она накапливается в мышцах при интенсивной работе, вследствие чего в них появляется характерная боль. Причина накопления – недостаток кислорода, что вызывает восстановление ПВК в молочную с участием кофермента НАДН. глюкоза+2 АТФ+2 Фн ® молочная кислота+2 АТФ+2 Н2О Одна из важнейших гидроксикислот. Широко распространена в природе как продукт молочнокислого брожения лактозы, содержащейся в молоке, и др. углеводов, входящих в состав овощей и плодов. Яблочная кислота→малаты HOOC-CH(OH)-CH2 COOH Относится к дикарбоновым кислотам, в значительных количествах содержится в незрелых яблоках, рябине, фруктовых соках. В цикле Кребса L-яблочная кислота образуется путем гидратации фумаровой кислоты и далее окисляется коферментом НАД+ в щавелевоуксусную кислоту. Винная кислота →тартраты HOOC-CH(OH)-CH(OH)-COOH D(+) винная кислота (обыкновенная винная кислота) в медицине известна под названием виннокаменной кислоты. Получена К. Шееле (1769) из винного камня – осадка, выпадающего при брожении виноградного сока. Содержится во многих растениях (виноград, рябина..). Лимонная кислота → цитраты HOOC-CH2-C(OH)(COOH)-CH2-COOH В больших количествах содержится в плодах цитрусовых растений (лимоны, апельсины), а также в винограде, крыжовнике. Относится к трикарбоновым кислотам. 4. Салициловая кислота и ее производные, применяемые в медицине. Салициловая (2-гидроксибензойная кислота, фенольная кислота) кислота - белые игольчатые кристаллы или легкий кристаллический порошок без запаха. В медицине: лечение кожных и др. заболеваний. При концентрации 10—20% разрыхляет и отторгает эпидермис (применяется в составе различных противомозольных средств). В малых концентрациях (1—2 %) салициловая кислота способствует разрастанию эпидермиса. Она также подавляет секрецию потовых желез, поэтому применяется в виде растворов и присыпок при повышенной потливости. Дезинфицирующее действие салициловой кислоты (в пастах, мазях) используется для лечения инфекционных заболеваний кожи. Салициловая кислота в незначительных количествах содержится в вишне, малине, землянике и других ягодах как составная часть. При поступлении салициловой кислоты внутрь наблюдается раздражение слизистой оболочки желудка, появляются боль в надчревной области, тошнота, а иногда и рвота, поэтому не применяется внутрь. Для этой цели применяются соли салициловой кислоты (салицилаты) и ее производные. Аспирин — ацетилсалициловая кислота — С6Н4(ОСОСН3)СООН — широко применяется в качестве жаропонижающего и болеутоляющего средства. В некоторых странах он находит широкое применение и для лечения ревматизма. В желудочно-кишечном тракте аспирин частично омыляется с образованием салициловой и уксусной кислот. Часть его всасывается в неизмененном виде. Метилсалицилат — метиловый эфир салициловой кислоты - жидкость, хорошо всасывающаяся кожей. Применяется как наружное средство для растирания при лечении ревматических и невралгических болей, часто в комбинации с другими средствами. Оказывает как местное, так и резорбтивное действие. Фенилсалицилат – препарат из группы антибиотиков. Пара-аминосалициловая к-та (ПАСК)- противотуберкулезное средство, применяется в виде натриевой соли. 5. Производные гетерофункциональных соединений, применяемых в медицине: аминоспирты (холин, ацетилхолин, адреналин, их биологическая роль); ПАБК; производные n-аминофенола и их применение; сульфаниловая кислота, общий принцип действия сульфаниламидных препаратов. Аминоспиртами называют соединения, содержащие в молекуле одновременно амино- и гидроксогруппы. При действии на этиленоксид триметиламином или исчерпывающем метилировании 2-аминоэтанола образуется холин. (CH3)3N, H2O AgOH, 3CH3J CH2-CH2 ———→HOCH2CH2N+(CH3)3OH-←————HOCH2 CH2NH2 \ / O Холин (триметил-2-гидроксиэтиламмоний) – структурный элемент сложных липидов. Имеет большое значение как витаминоподобное вещество, регулирующее жировой обмен. В организме может образоваться из аминокислоты серина. При этом сначала в результате декарбоксилирования серина получается 2-аминоэтанол (коламин), который затем подвергается исчерпывающему метилированию при участии S-аденозилметионина (SAM). Замещенные фосфаты холина являются структурной основой фосфолипидов – важнейшего строительного материала клеточных мембран. Сложный эфир холина и уксусной кислоты – ацетилхолин – наиболее распространенный посредник при передаче нервного возбуждения в нервных тканях (нейромедиатор). Он образуется в организме при ацетилировании холина с помощью ацетилкофермента А. СН2COOCH2 CH2N+(CH3)3 При ингибировании ацетилхолинэстразы ацетилхолин накапливается в организме, что приводит к непрерывной передаче нервных импульсов и непрерывному сокращению мышечной ткани. На этом основано действие инсектицидов и нервно-паралитических ядов (зарина, табуна). Катехоламины- представители биогенных аминов, те аминов, образующихся в организме в результате процессов метаболизма. К ним относят дофамин, норадреналин и адреналин, выполняющие, как и ацетилхолин, роль нейромедиаторов. Адреналин является гормоном мозгового вещества надпочечников. Он участвует в регуляции сердечной деятельности, обмена углеводов. При физиологических стрессах он выделяется в кровь. Активность адреналина связана с конфигурацией хирального центра, определяющей взаимодействие с рецептором. 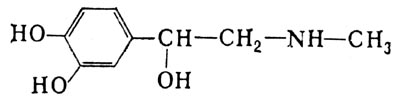 Эфиры ароматических аминокислот обладают общим свойством – способностью в той или иной степени вызывать местную анастезию, т е потерю чувствительности. 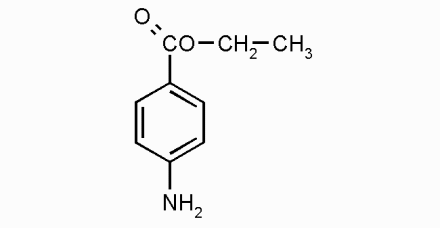 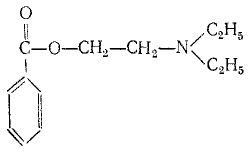 Анестезин новокаин Анестезин и новокаин несколько уступают по силе анестезирующего действия кокаину, широко употреблявшемуся ранее в мед. практике. ПАБК и n-Аминобензойная кислота является фактором роста МО и участвуют в синтезе фолиевой кислоты, при недостатке или отсутствии которой МО погибают. Название кислоты связано с выделением ее из листьев шпината. Фолиевая кислота играет важную роль в метаболизме нуклеиновых кислот и белков; в организме человека не синтезируется. Сульфаниловая кислота (n-аминобензолсульфокислота) легко получается при сульфировании анилина, существует в виде диполярного иона. Все сульфаниламиды содержат сульфамидную группу – SO2NH2 . Замена ее на др. группы приводит к потере антибактериальной активности. NH2—C6H4—SO3H. В поисках более эффективных антибактериальных средств было синтезировано свыше 5000 производных сульфаниламида. Однако лишь некоторые из них нашли практическое применение. Наибольшую активность проявляют те, у которых радикал R имеет гетероциклическую природу. Многие сульфаниламиды содержат пиримидиновый, пиридазиновый и др. гетероциклы. Антибактериальное действие их основано на том, что они являются антиметаболитами по отношению к n-аминобензойной кислоте, участвующей в биосинтезе фолиевой кислоты в МО. Амид сульфаниловой кислоты имеет структурное сходство с n-аминобензойной кислотой. 6. Аминокислоты: номенклатура, классификация. Аминокислоты - гетерофункциональные соединения, содержащие одновременно карбоксильные и аминные группы. Классификация: I) по функциональным группам: 1. Алифатические – наиболее многочисленная группа. Внутри этой группы их подразделяют с привлечением дополнительных классификационных признаков(нейтральные – аланин, валин; основные – лизин, гистидин, аргинин; кислые – аспарагиновая и глутаминовая к-ты). 2. Ароматические(фенилаланин, тирозин). 3.Гетероциклические (триптофан, пропин). II) по радикальным группам: 1.неполярные(либо углеводородный радикал, либо бензольное кольцо) – аланин, валин, изолейцин; 2.полярные незаряженные (заряды скомпенсированы) при pH=7 аспарагин, тирозин; 3.полярные заряженные отрицательно, при pH=7 аспарагиновая к-та, глутаминовая к-та; 4. полярные заряженные положительно, при pH=7 гистидин, лизин. 7. Кислотно-основные свойства аминокислот. Биполярная структура. Строение в кислой и щелочной средах. Аминокислоты – гетерофункциональные соединения, содержащие карбоксильную группу и аминогруппу, находящиеся у одного и того же атома C. NH2-CH-COOH ǀ R Все природные аминокислоты относятся к L ряду. В твердом состоянии и водных растворах при нейтральных значениях pH α-аминокислоты существуют в виде внутренних солей (диполярных ионов). α-аминокислоты- кристаллические вещества, растворимые в воде. Многие из них обладают сладким вкусом. Основным источником α-аминокислот для живого организма служат пищевые белки. Многие α-аминокислоты синтезируются в организме, некоторые нет и должны поступать извне. Такие аминокислоты-незаменимые: валин, лейцин, изолейцин, лизин, треонин, метионин, фенилаланин, триптофан. α-аминокислоты занимают ключевое положение в азотистом обмене. Многие из них используются в мед. практике в качестве лекарственных средств, влияющих на тканевый обмен.(глутаминовая к-та применяется для лечения заболеваний ЦНС, метионин и гистидин-лечения и предупреждения заболеваний печени, цистеин-глазных болезней) Классификация: 1)алифатические- наиболее многочисленная группа. -нейтральные (ала,гли,изолей,лей) -основные (арг,гис,лиз) -кислые (аспарагиновая к-та, глутаминовая к-та) 2)ароматические построены т о, что бензольные и гетероциклические кольца в них отделены от общего α-аминокислотного фрагмента метиленовой группой -CH2- 3)гетероциклические По R 1)неполярные (ала,вал,изолей,иет) 2)полярные незаряженные (заряды скомпенсированы) при pH=7 (асп,сер,глу,тир,тре,цис) 3)полярные заряженные отрицательно при pH=7 (аспараг. и глутамин. К-та) 4)полярные заряженные положительно при pH=7 (арг,гис) В сильно кислой среде в аминокислотах полностью протонирована аминогруппа и не диссоциирована карбоксильная группа. В сильно щелочной среде напротив свободна аминогруппа и полностью ионизирована карбоксильная. Кислая среда Нейтральная Щелочная H+ HO- R-CH-COOH← R-CH-COO- → R-CH-COO- ǀ → ǀ ← ǀ NH3- HO- NH3+ H+ NH2 Катионная форма диполярный ион анионная форма 8. Строение пептидов. Первичная структура пептидов и белков. Пептиды и белки представляют собой соединения, построенные из остатков а-аминокислот. Условно считают, что пептиды содержат в молекуле до 100 (что соответствует молекулярной массе до 10 000), а белки — свыше 100 аминокислотных остатков (молекулярная масса от 10 000 до нескольких миллионов). В группе пептидов принято различать олигопептиды (низкомолекулярные пептиды), содержащие в цепи не более 10 аминокислотных остатков, и полипептиды, в состав цепи которых входит до 100 аминокислотных остатков. Пептидную или белковую молекулу формально можно представить как продукт поликонденсации а-аминокислот, протекающей с образованием пептидной (амидной) связи между мономерными звеньями. Один конец цепи, на котором находится аминокислота со свободной NH2-группой, называют N-концом, другой, на котором находится аминокислота со свободной СООН-группой, — С-концом. Пептидные и белковые цепи принято записывать с N-конца. Первичная структура пептидов и белков – это аминокислотная последовательность, т.е. порядок чередования α-аминокислотных остатков. 9. Качественные реакции на пептидную группу и отдельные аминокислоты. БИУРЕТОВАЯ РЕАКЦИЯ, Белок (р-р) +CuSO4 + NaOH→ ярко-фиолетовое окрашивание В белках аминокислоты связаны друг с другом по типу полипептидов и дикетопиперазинов. Образование полипептидов из аминокислот происходит путем отщепления молекулы воды от аминогруппы одной молекулы аминокислоты и карбоксильной группы другой молекулы. Образующаяся группа –С(О)–NН– называется пептидной группой, связь С–N, соединяющая остатки молекул аминокислот, – пептидной связью. 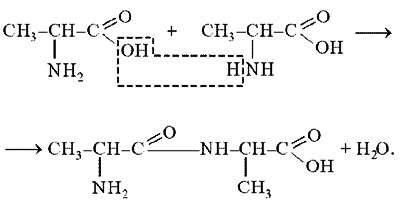 РЕАКЦИЯ РУЭМАННА (НИНГИДРИНОВАЯ РЕАКЦИЯ (1911)) a-Аминокислоты реагируют с нингидрином, образуя сине-фиолетовый комплекс (пурпур Руэманна), интенсивность окраски которого пропорциональна количеству аминокислоты. 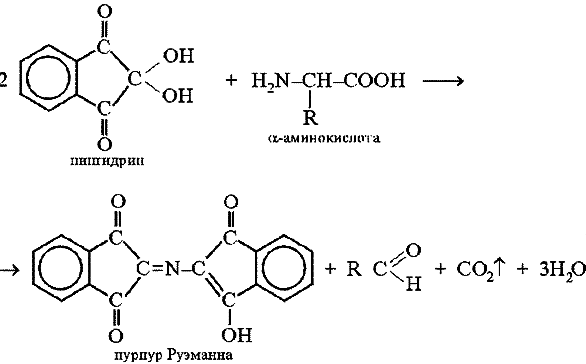 Реакция с нингидрином используется для визуального обнаружения a-аминокислот на хроматограммах (на бумаге, в тонком слое), а также для колориметрического определения концентрации аминокислот по интенсивности окраски продукта реакции КСАНТОПРОТЕИНОВАЯ РЕАКЦИЯ Белок + HNO3 (конц)→ желтое окрашивание Эта реакция используется для обнаружения a-аминокислот, содержащих ароматические радикалы. Тирозин, триптофан, фенилаланин при взаимодействии с концентрированной азотной кислотой образуют нитропроизводные, имеющие желтую окраску. В щелочной среде нитропроизводные этих a-аминокислот дают соли, окрашенные в оранжевый цвет. 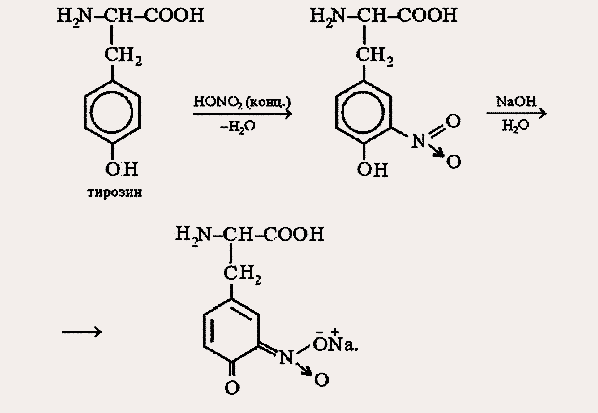 ОБРАЗОВАНИЕ КОМПЛЕКСОВ С МЕТАЛЛАМИ a-Аминокислоты образуют с катионами тяжелых металлов внутрикомплексные соли. Со свежеприготовленным гидроксидом меди(II) все a-аминокислоты в мягких условиях дают хорошо кристаллизующиеся внутрикомплексные (хелатные) соли меди(II) синего цвета 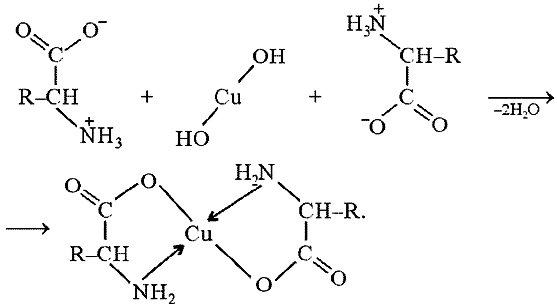 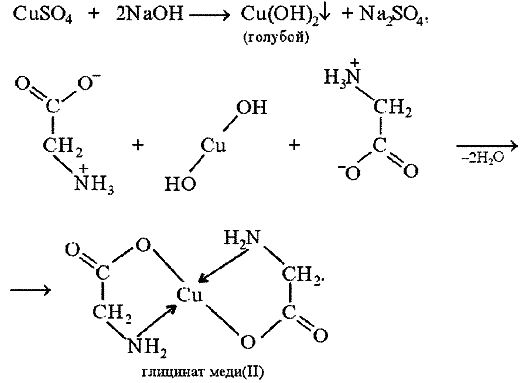 ЦИСТЕИНОВАЯ РЕАКЦИЯ (р-ция на остатки S-содержащих аминокислот) Белок + Pb(CH3 COO)2→ черное окрашивание, из-за образования PbS↓ 10. Биологически важные гетероциклы: пиррол, фуран, тиофен, пиридин, пиримидин и их биологически значимые производные. 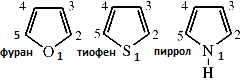 Фуран ацидофобен и подобно пирролу при действии минеральных кислот подвергается полимеризации с раскрытием цикла, что сопровождается смолообразованием. При действии подходящих электрофильных реагентов легко вступает в реакции электрофильного замещения. Фуран может присоединять водород в присутствии никелевого катализатора с образованием тетрагидрофурана, который используется в качестве растворителя. Наиболее часто используемые лек. средства фурацилин и фуразолидон при гнойно-воспалительных процессах, вызываемых МО. Тиофен наиболее близок к бензолу по физическим и химическим свойствам. Стоек к действию минеральных кислот. Производные тиофена входят в состав ихтиоловой мази, оказывающей противовоспалительное, антисептическое и местное обезболивающее действие. Производным тетрагидротиофена является биотин (витамин H), отсутствие которого в пище нарушает обмен белков и жиров в организме и ведет к кожным заболеваниям. Пиридин. Особенности: 1) шестичленное гетероциклическое соединение с одним гетероатомом азота в цикле: 2) бесцветная жидкость с неприятным запахом, хорошо растворимая в воде; 3) пиридин и его гомологи содержатся в каменноугольной смоле, которая и служит источником их получения; 4) наличие двойных связей в молекуле указывает на его высокую реакционную способность, а сходство по строению с бензолом позволяет предположить, что вещество обладает большой химической способностью; 5) пиридин устойчив по отношению к окислителям: он не обесцвечивает раствор перманганата калия даже при нагревании; 6) пиридин нитруется, реакция идет в более жестких условиях, чем у бензола, образуется нитропиридин. Гетероциклическое соединение пиридин – это азотистое основание ароматического характера. Способы применения пиридина: 1) ароматические и основные свойства пиридина используются при синтезе разного рода лекарственных препаратов, красителей, гербицидов; 2) используется как растворитель для денатурирования этанола. Пиррол. Особенности: 1) пятичленное гетероциклическое соединение, которое содержит в цикле один атом азота: 2) бесцветная жидкость с температурой кипения 130 °C. При хранении окрашивается и окисляется. Ароматичность пиррола, как и бензола, обусловлена наличием плоской шестиэлектронной π-системы. Ацидофобен. Название пиррола (красное масло) было дано Рунге (1834 г.), обнаружившим его в костяном масле (продукт сухой перегонки костей) и в небольшом количестве в каменноугольной смоле. Название связано с покраснением сосновой лучинки, смоченной соляной кислотой. Пиррол в промышленности получают из фурана и аммиака (реакция Юрьева). 3) является очень слабой кислотой, он реагирует с металлами, образуя соли. Основные свойства, которые можно было бы предположить у пиррола как вторичного амина, очень ослаблены . 4) применяется для синтеза различных органических соединений, в том числе лекарственных средств. Полиэтилентерефталат это полимер, в молекулах которого многократно повторяется группировка сложного эфира. Порфирин- тетрапиррольное соединение, имеет плоский макроцикл, представляет собой сопряженную систему из 26 π-электронов. В природе порфирины находятся в виде комплексов с металлами. Комплекс порфирина с Mg является основой молекулы хлорофилла. Комплекс с Fe служит простетической группой, к которой относят кислородоприносящие белки. 11. Пиримидин, его гидрокси- и аминопроизводные: урацил, тимин, цитозин. 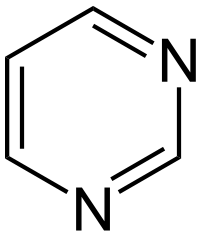 изомерный шестичленный гетероцикл, имеющий плоскую молекулу, простейший представитель 1,3-диазинов. Пиримидин — бесцветные кристаллы с характерным запахом. Введение второго атома азота в шестичленное кольцо еще больше понижает активность гетероциклического ядра (по сравнению с пиридином) в реакциях электрофильного замещения. Особенно важны гидрокси- и аминопроизводные пиримидина- У, Т, и Ц -компоненты нуклеиновых кислот. изомерный шестичленный гетероцикл, имеющий плоскую молекулу, простейший представитель 1,3-диазинов. Пиримидин — бесцветные кристаллы с характерным запахом. Введение второго атома азота в шестичленное кольцо еще больше понижает активность гетероциклического ядра (по сравнению с пиридином) в реакциях электрофильного замещения. Особенно важны гидрокси- и аминопроизводные пиримидина- У, Т, и Ц -компоненты нуклеиновых кислот.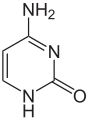 Цитозин Цитозин 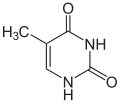 Тимин Тимин 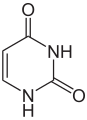 Урацил УрацилПиримидиновая структура — как ароматическая, так и гидрированная, входит в состав многих биологически активных веществ и лекарственных препаратов — например, барбитуратов — производных 1,3,5-тригидроксипиридина, обладающих снотворным, противосудорожным и наркотическим действием. 12. Пурин, его гидрокси- и аминопроизводные: аденин, гуанин. 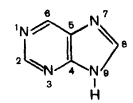 Пурин – биоциклическое гетероциклическое соединение, образованное конденсированными ядрами пиримидина и имидазола. Пуриновая с-ма ароматична. Она включает 8 π-электронов двойных связей и неподеленную пару электронов атома азота в положении 9, что соответствует правилу Хюккеля (4n + 2, где n=2). Пурин (т.пл. 216 оС) устойчив к действию окислителей, хорошо растворим в воде, амфотерен, образует соли не только с сильными к-тами, но и (благодаря NH-группе) и щелочными металлами. Пурин – биоциклическое гетероциклическое соединение, образованное конденсированными ядрами пиримидина и имидазола. Пуриновая с-ма ароматична. Она включает 8 π-электронов двойных связей и неподеленную пару электронов атома азота в положении 9, что соответствует правилу Хюккеля (4n + 2, где n=2). Пурин (т.пл. 216 оС) устойчив к действию окислителей, хорошо растворим в воде, амфотерен, образует соли не только с сильными к-тами, но и (благодаря NH-группе) и щелочными металлами. 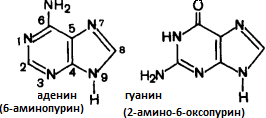 - его производные. - его производные.13. Моносахариды. Определение. Классификация в зависимости от числа атомов углерода и характера карбонильной группы (примеры). Моносахариды – твердые вещества, легко растворимые в воде, плохо- в спирте и совсем не растворимые в эфире. Водные растворы имеют нейтральную реакцию на лакмус. Большинство обладает сладким вкусом. В свободном виде в природе встречается преимущественно глюкоза. Она же является структурной единицей многих полисахаридов. Др. моносахариды в свободном виде встречаются редко и в основном известны как компоненты олиго- и полисахаридов. Моносахариды могут существовать как в открытой форме, так и циклических формах в растворе эти изомерные формы находятся в динамическом равновесии. Моносахариды классифицируют по нескольким принципам: 1. по числу углеродных атомов, входящих в состав молекулы: триозы,
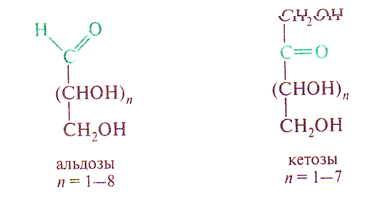
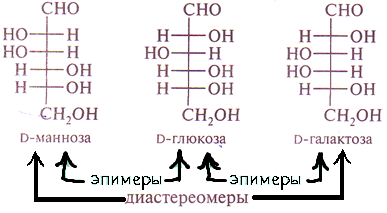
15. Открытые и циклические таутомерные формы (формулы Фишера и Хеуорса – циклооксо-таутомерия) сахаров. Их названия, α- и β-аномеры. Открытые формы моносахаридов изображают в виде проекционных формул Фишера. Углеродная цепь в низ записывается вертикально. У альдоз наверху помещают альдегидную группу, у кетоз-соседнюю с карбонильной первичноспиртовую группу. С этих групп начинают нумерацию цепи. 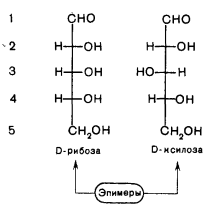 Относительная конфигурация моносахаридов определяется по конфигурационному стандарту – глицериновому альдегиду. С конфигурацией его хирального центра сравнивается конфигурация наиболее удаленного от карбонильной группы ассиметрического атома углерода, имеющего наибольший номер. При совпадении конфигурации этого атома углерода с конфигурацией D-глицеринового альдегида моносахарид в целом относят к D-ряду. И, наоборот, при совпадении с конфигурацией L-глицеринового альдегида считают,что моносахарид принадлежит к L-ряду. 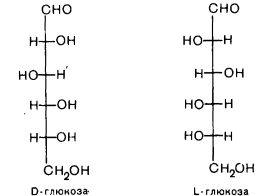 Для циклических форм моносахаридов приняты формулы Хеуорса, в которых циклы изображаются в виде плоских многоугольников, лежащих перпендикулярно плоскости рисунка. Атом кислорода располагается в пиранозном цикле в дальнем правом углу, в фуранозном - за плоскостью цикла. Символы атомов углерода в циклах не пишутся.  При написании формул Хеуорса руководствуются следующими правилами. В фишеровской проекционной формуле моносахарида производят 2 перестановки заместителей при том ассиметрическом атому углерода, гидроксильная группа которого примет участие в образовании оксидного цикла. Перестановки производят с условием, чтобы данная гидроксильная группа оказалась внизу, т.е. на одной проекционной линии с атомами углерода. Затем замыкают оксидный цикл. 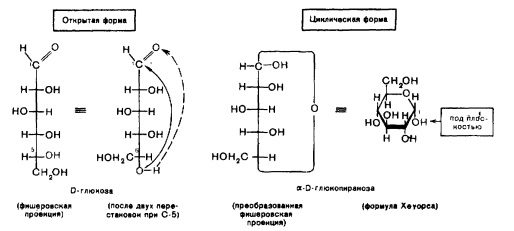 От преобразованной таким образом фишеровской проекционной формулы переходят к формуле Хеуорса. Заместители, находящиеся слева от углеродной цепи в фишеровской проекции, в формуле Хеуорса располагают над плоскостью цикла; заместители, расположенные справа,- под плоскостью. У альдогексоз D-ряда в пиранозной форме CH2OH-группа всегда располагается над плоскостью цикла, что служит формальным признаком D-ряда. Гликозидная гидроксильная группа у α-аномеров альдоз D-ряда оказывается под плоскостью, у β-аномеров- над плоскостью. Изменение во времени угла вращения плоскости поляризации света растворами углеводов называется мутаротацией. Химическая сущность состоит в способности моносахаридов к существованию в виде равновесной смеси таутомеров- открытой и циклических форм. Такой вид таутомерии называется цикло-оксо-таутомерией. 16. Принцип строения и определение восстанавливающих и невостанавливающих дисахаридов. Примеры. Типы гликозидных связей. Дисахариды — димеры, состоящие из двух молекул моносахаридов. Молекулы дисахаридов образуются из моносахаридов за счет конденсации циклических таутомеров гексоз. Дисахариды подразделяются на две группы: восстанавливающие и невосстанавливающие. В восстанавливающих дисахаридах связь между мономерами осуществляется за счет одного из спиртовых и полуацетального гидроксила. В дисахариде имеется свободная полуацетальная гидроксильная группа, вследствие чего сохраняется способность к раскрытию цикла. 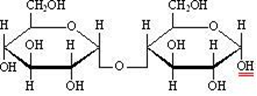 мальтоза. В ней имеется свободный гликозидный гидроксил, вследствие чего сохраняется способность к раскрытию цикла и переходу в альдегидную форму. В связи с этим, мальтоза способна вступать в реакции, характерные для альдегидов, и, в частности, давать реакцию "серебряного зеркала", поэтому ее называют восстанавливающим дисахаридом. Сюда же относят лактозу и целлобиозу. мальтоза. В ней имеется свободный гликозидный гидроксил, вследствие чего сохраняется способность к раскрытию цикла и переходу в альдегидную форму. В связи с этим, мальтоза способна вступать в реакции, характерные для альдегидов, и, в частности, давать реакцию "серебряного зеркала", поэтому ее называют восстанавливающим дисахаридом. Сюда же относят лактозу и целлобиозу. У невосстанавливающих дисахаридов в образовании гликозидной связи участвуют оба гликозидных гидроксила, поэтому невосстанавливающие дисахариды не способны к таутомерии с образованием открытой формы и свободной оксо-группы. Поэтому невосстанавливающие дисахариды не дают реакций, характерных для открытой формы моносахаридов. 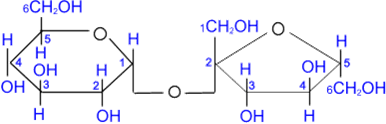 сахароза. сахароза. Гликозидная связь – это тип ковалентной связи, которая соединяет молекулу сахара с другой молекулой, часто с другим сахаром. Гликозидная связь образуется между полуацетальной группой сахара (или производной сахара) и гидроксильной группой органического соединения, например, спирта. Связь между аминогруппой или другой группой, содержащей атом азота, с сахаром, часто также называется гликозидной связью, хотя ИЮПАК этого и не рекомендует. Например, связь между сахаром и азотистым основанием в нуклеозиде называют гликозидной связью. Вещество, содержащее гликозидные связи, называют гликозидом 17. Принцип строения восстанавливающих и невостанавливающих дисахаридов. Примеры. Номенклатура. Структура мальтозы, лактозы, целлобиозы, сахарозы. Типы связей между моносахаридными остатками, моносахаридный состав. Природные дисахариды (биозы) состоят из двух одинаковых или разных моносахаридных остатков и представляют собой О-гликозоиды (полные ацетали), в которых один из моносахаридных остатков выполняет роль агликона. Существуют 2 типа связывания моносахаридных остатков: 1)за счет полуацетальной OH-группы другого моносахарида (группа восстанавливающих дисахаридов) 2)с использованием полуацетальных OH-групп обоих моносахаридов (группа невосстанавливающих дисахаридов). Восстанавливающие дисахариды. В них 1из моносахаридных остатков участвует в образовании гликозидной связи за счет гидроксильной группы чаще всего при С-4 или С-6, реже при С-3. Имеется свободная полуацетальная гидроксильная группа, вследствие чего сохраняется способность к раскрытию цикла. Представители : 1)мальтоза, солодовый сахар-основной продукт расщепления крахмала под действием фермента β-амилазы. Остатки 2-х молекул D-глюкопиранозы связаны 1→4 гликозидной связью  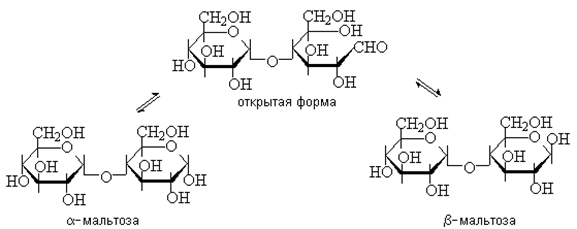 2)целлобиаза состоит из 2-х D-глюкопиранозильных остатков, связанных 1→4 гликозидной связью. Аномерный атом углерода, участвующий в образовании гликозидной связи, имеет β-конфигурацию. 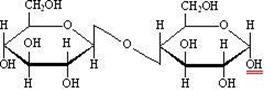 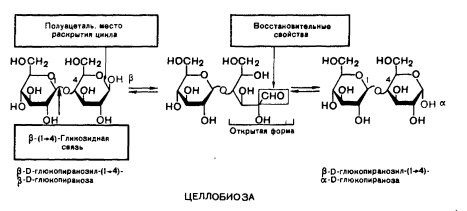 3)лактоза (молочный сахар) построена из остатков D-галактопиранозы и D-глюкопиранозы, связанных 1→4 гликозидной связью. Участвующий в образовании этой связи аномерный атом углерода D-галактопиранозы имеет β-конфигурацию. Аномерный атом глюкопиранозного фрагмента может иметь α и β- конфигурации. 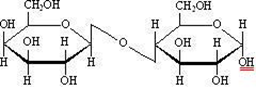 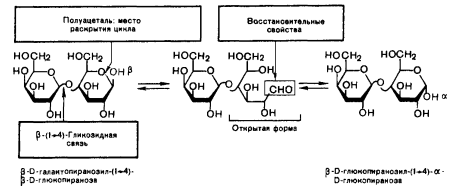 В образовании гликозидной связи участвуют оба гликозидных гидроксила, поэтому невосстанавливающие дисахариды не способны к таутомерии с образованием открытой формы и свободной оксо-группы. Поэтому невосстанавливающие дисахариды не дают реакций, характерных для открытой формы моносахаридов Сахароза  18. Таутомерия восстанавливающих дисахаридов. Реакции, подтверждающие восстанавливающие свойства. 19. Строение и номенклатура пуриновых и пиримидиновых нуклеозидов |

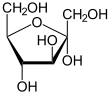 фруктоза
фруктоза 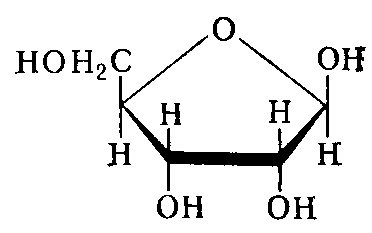 фруктоза
фруктоза 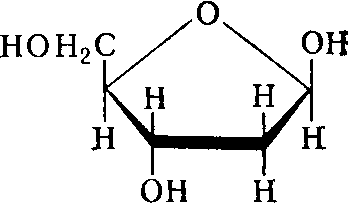 дезоксирибоза
дезоксирибоза