1. Кислотноосновные свойства органических соединений, образование солей. Факторы, влияющие на кислотность и основность
 Скачать 0.79 Mb. Скачать 0.79 Mb.
|
Нуклеозиды - соединения, в которых пуриновые или пиримидиновые основания связаны с рибозой (рибонуклеозиды) или дезоксирибозой (дезоксирибонуклеозиды).Нуклеозиды относятся к N-гликозидам: атом С-1' рибозы или дезоксирибозы связан с N-9 пуринового или N-1 пиримидинового основания:Аденозин и дезоксиаденозинВ состав ДНК входят следующие нуклеозиды, что описывается формулами:Аденин + дезоксирибоза = дезоксиаденозин.Гуанин + дезоксирибоза = дезоксигуанозин.Цитозин + дезоксирибоза = дезоксицитидин.Тимин + дезоксирибоза = дезокситимидин.В состав РНК входят следующие нуклеозиды, что описывается формулами:Аденин + рибоза = аденозин.Гуанин + рибоза = гуанозин.Цитозин + рибоза = цитидин.Урацил + рибоза = уридин.Кроме выше перечисленных главных нуклеозидов встречаются и минорные нуклеозиды, из которых наиболее распространены дигидроуридин, псевдоуридин; в последнем отсутствует обычная N-гликозидная связь: в нем атом С-1' рибозы соединен с атомом С-5 урацила. Нуклеозиды лучше растворимы в воде, чем исходные азотистые основания. Их легко можно разделить и идентифицировать методом тонкослойной хроматографии. Они устойчивы к щелочам, но легко гидролизуются кислотами, а также ферментом нуклеозидазой. Нуклеотиды представляют собой нуклеозиды с присоединенной эфирной связью к остатку рибозы или дезоксирибозы фосфатной группой. В образовании связи участвует 5'-углеродный атом пентозы. В зависимости от строения пентозы все нуклеотиды можно разделить на рибонуклеотиды и дезоксирибонуклеотиды:20. Общий принцип строения нуклеотидов. Нуклеотидами называют фосфаты нуклеозидов. Фосфорная кислота обычно этерифицирует спиртовый гидроксил при С-5' или С-3' в остатке рибозы (рибонуклеотиды) или дезоксирибозы (дезоксирибонуклеотиды). Общий принцип строения нуклеотидов можно показать на примере фосфатов аденозина. Для связывания трех компонентов в молекуле нуклеотида используются сложноэфирная и N-гликозидная связи. 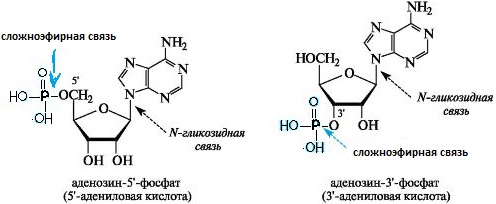 Нуклеотиды можно рассматривать, с одной стороны, как эфиры нуклеозидов (фосфаты), а с другой - как кислоты (в связи с наличием остатка фосфорной кислоты). 21. АТФ. Строение, типы связей. Макроэргические связи. Типичным примером высокоэнергетических соединений является АТФ. Это универсальное высоконергетичекое вещество любой клетки. Полное название - аденозинтрифосфат. АТФ представляет собой аденозинфосфорную кислоту, содержащую 3 остатка фосфорной кислоты (или фосфатных остатка), служит универсальным переносчиком и основным аккумулятором химической энергии в живых клетках, кофермент многих ферментов. АТФ не единственное биологически активное соединение, содержащее пирофосфатные связи. Макроэргическими в молекуле АТФ являются две пирофосфатные связи: между б- и в- и между в- и г-фосфатными остатками. . Все процессы в организме, сопровождающиеся накоплением энергии, в конечном счете, ведут к образованию АТФ, который выполняет роль связующего звена между процессами, протекающими с потреблением энергии, и процессами, сопровождающимися выделением и накоплением энергии. 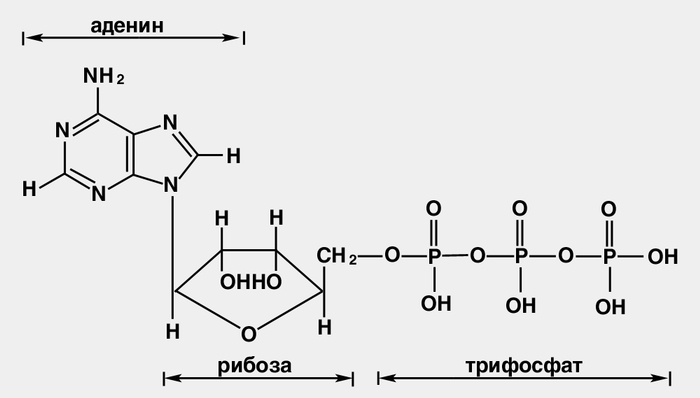 Макроэргические связи — это ковалентные связи, которые гидролизуются с выделением значительного количества энергии: 30 кДж/моль и более (свободная энергия гидролиза). Вообще термин «макроэргическая связь» используется исключительно для связей, энергия которых используется в метаболизме и не указывает на истинную величину энергии связей. 22. Строение и номенклатура жиров. Зависимость консистенции жиров от природы остатков высших жирных кислот. Строение жиров было установлено М. Шеврелем и М. Бертло. Нагревая жиры с водой (в присутствии щелочи), М. Шеврель еще в начале XIX в. установил, что, присоединяя воду, они разлагаются на глицерин и карбоновые кислоты – стеариновую, олеиновую и др. М. Бертло (1854 г.) осуществил обратную реакцию. Он нагревал смесь глицерина с кислотами и получил при этом вещества, аналогичные жирам; М. Шеврель провел реакцию гидролиза сложного эфира, а М. Бертло осуществил реакцию этерификации, т. е. синтез сложного эфира. На основании этих данных легко прийти к выводу о строении жиров. Характерные особенности жиров. 1. Жиры – это сложные эфиры трехатомного спирта глицерина и карбоновых кислот. 2. В большинстве случаев жиры образованы высшими предельными и непредельными карбоновыми кислотами, главным образом: а) пальмитиновой C15H31-СООН; б) стеариновой С17Н35-СООН; в) олеиновой С17Н33-СООН; г) линолевой С17Н31-СООН и некоторыми другими. 3. В меньшей степени в образовании жиров участвуют низшие кислоты, например, масляная кислота С3Н7-СООН (в сливочном масле), капроновая кислота С5Н11-СООН и др. 4. Жиры, которые образуются преимущественно предельными кислотами, твердые (говяжий жир, бараний жир). 5. С повышением содержания непредельных кислот температура плавления жиров понижается, они становятся более легкоплавкими (свиное сало, сливочное масло). Химические свойства жиров определяются принадлежностью их к классу сложных эфиров. Поэтому наиболее характерная для них реакция – гидролиз 23. Строение ВЖК, входящих в структуру жиров. Высшие карбоновые кислоты были выделены из жиров, поэтому получили название жирных. Биологически важные жирные кислоты- монокарбоновые кислоты с неразветвленной углеродной цепью и четным числом атомов углерода. Они могут быть насыщенными и ненасыщенными. Последние содержат 1 или несколько двойных связей, имеющих цис-конфигурацию. Ближайшая к карбоксильной группе двойная связь расположена обычно между 9-м и 10-м атомами углерода. Если двойных связей несколько, то они отделены друг от друга метиленовой группой. Число атомов углерода в природных кислотах 4-22, но чаще встречаются кислоты с 16 или 18 атомами.  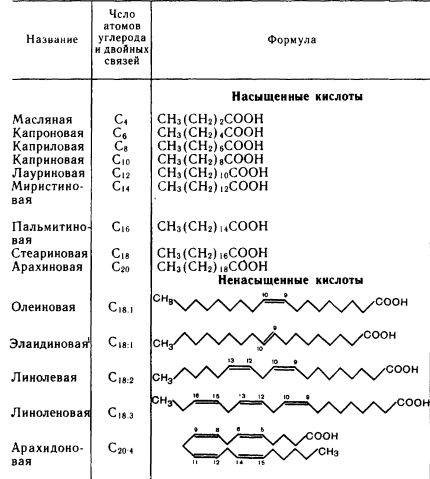 24. Кислотный и щелочной гидролиз жиров. Гидролиз жиров протекает при наличии в них воды. При обычной температуре скорость гидролиза ничтожна, так как в жире растворено мало воды (десятые доли процента). Ускоряется гидролиз жира под действием катализаторов, как-то: фермента липазы, щелочей, кислот. Усиливается гидролиз жира при повышении температуры, давления и др. Ферментативный гидролиз жира возникает под действием ферментов плесеней на поверхности соприкосновения жира и воды. Степень расщепления жира в этом случае пропорциональна поверхности контакта. Неферментативный гидролиз протекает в жировой фазе и зависит от количества растворенной в жире воды. Скорость гидролиза жира возрастет при наличии в жире сопутствующих веществ, которые способствуют повышению содержания воды в жире. Ускоряет гидролиз жира высокая температура (например, при кулинарной обработке), которая повышает степень растворения воды в жире. Конечными продуктами гидролиза жира являются глицерин и жирные кислоты. Промежуточными продуктами гидролиза жиров являются ди- и моноглицериды. Олеостеаринопальмитин - это жир, в состав которого входит остаток олеиновой, стеариновой и пальмитиновой кислот. Соответственно эти кислоты и получаются при кислотном гидролизе. И конечно получается ещё и глицерин, который входит в состав любого жира. А при щелочном гидролизе образуются соли этих указанных кислот - мыла: СН2-О-СО-С17Н33 СН--О--СО-С17Н35 + 3 КОН = глицерин + С17Н33СООК + С17Н35СООК +С15Н31СООК СН2-О-СО-С15Н31 25. Фосфатидиловая кислота как основная структура фосфолипидов. Строение кефалинов, лецитинов. Кислотный и щелочной гидролиз фосфолипидов. Биологическая роль фосфолипидов. Фосфатидиловая кислота является промежуточным продуктом биосинтеза не только триглицеридов, но и фосфолипидов. Она является остовом, на котором происходит синтез различных фосфолипидов. Фосфолипиды- липиды, отщепляющие фосфорную кислоту при гидролизе. К ним относятся глицерофосфолипиды и некоторые сфинголипиды. Фосфолипиды характеризуются высоким содержанием ненасыщенных кислот. Фосфолипиды представляют собой сходные по структуре молекулы, состоящие из глицеринового скелета с фосфодиэфирными группами в положении С3, соединенные со спиртовыми полярными группами и двумя эстерифицированными глицерином жирными кислотами в положении С1’ и C2’. Природные фосфолипиды в положении C1’ содержат насыщенную жирную кислоту, а в положении C2’ — ненасыщенную жирную кислоту. С химической точки зрения самой простой формой фосфолипидов является фосфатидиловая кислота (ФК), в которой молекула спирта отсутствует. Эта молекула рассматривается как «фосфатидиловый» компонент более сложных фосфолипидов, название которых зависит от типа спиртовой группы. В клеточной мембране фосфолипиды образуют двойной слой, в котором гидрофобные цепи жирных кислот направлены внутрь мембраны, а гидрофильные полярные группы кнаружи. Фосфолипиды — сложные липиды, в которых содержатся жирные кислоты, фосфорная кислота и дополнительная группа атомов, во многих случаях содержащая азот. Они есть во всех живых клетках. Содержатся в нервной ткани, участвуют в транспорте жиров, жирных кислот и холестерина. Фосфолипиды входят в состав всех клеточных мембран. Между плазмой и эритроцитами происходит обмен фосфолипидами, которые играют важнейшую роль, поддерживая в растворимом состоянии неполярные липиды. Наиболее распространенная группа Фосфолипидов — фосфоглицериды, также к фосфолипидам относятся фосфосфинголипиды и фосфоинозитиды. Фосфолипиды — амфифильные вещества. Они состоят из полярной «головки», в состав которой входит глицерин или другой многоатомный спирт, отрицательно заряженный остаток фосфорной кислоты и часто несущая положительный заряд группа атомов, и двух неполярных «хвостов» из остатков жирных кислот. Главная особенность фосфолипидов состоит в том, что «головка» у них гидрофильна, а «хвосты» гидрофобны. Это позволяет при нахождении в толще водной среды образовывать бислой — двойной слой фосфолипидных молекул, где гидрофильные головы с обеих сторон соприкасаются с водой, а гидрофобные хвосты упрятаны внутрь бислоя и тем самым защищены от контакта с водой. Это определяет многие физические и химические свойства фосфолипидов, например, способность формировать липосомы и биологические мембраны (липидный бислой). Химическая структура полярной «головки» определяет суммарный электрический заряд и ионное состояние фосфолипида. «Хвосты» контактируют с липидным окружением, а «головки» — с водным, так как неполярные жирные хвосты не могут соприкасаться с водой Главный липидный компонент клеточных мембран. Они сопутствуют жирам в пище и служат источником фосфорной кислоты, необходимый для жизни человека. Фосфолипиды являются важной частью клеточных мембран. Они обеспечивают текучие и пластические свойства мембран клеток и клеточных органоидов, в то время как холестеринобеспечивает жёсткость и стабильность мембран. Как фосфолипиды, так и холестерин часто входят в состав липопротеидов клеточных мембран, но имеются в мембранах и в свободном, не связанном с белками состоянии. Соотношение холестерин/фосфолипиды в основном и определяет текучесть либо жёсткость клеточной мембраны. Фосфолипиды участвуют в транспорте жиров, жирных кислот и холестерина. Между плазмой и эритроцитами происходит обмен фосфолипидами, которые играют важнейшую роль, поддерживая в растворимом состоянии неполярные липиды. Будучи более гидрофильными, чем холестерин, благодаря наличию в молекуле остатков фосфорной кислоты, фосфолипиды являются своеобразными «растворителями» для холестерина и других высоко гидрофобных соединений. Соотношение холестерин/фосфолипиды в составе липопротеидов плазмы крови наряду с молекулярным весом липопротеидов (ЛПВП, ЛПНП или ЛПОНП) предопределяет степень растворимости холестерина и его атерогенные свойства. Соотношение холестерин/фосфолипиды в составе желчи предопределяет степень литогенности желчи - степень склонности к выпадению холестериновых желчных камней. Фосфолипиды замедляют синтез коллагена и повышают активность коллагеназы (фермента, разрушающего коллаген). Поскольку коллаген определяет замещение эпителиальной ткани соединительной, фосфолипиды оказывают противорубцовый (антифибротический) эффект. Фосфолипиды гидролизуются фосфолипазами. При мягком щелочном гидролизеотщепляются жирные к-ты, но не затрагиваются сложноэфирные связи остатка фосфорной к-ты; при жестком щелочном гидролизе отщепляется также XOH. К-ты гидро-лизуют все сложноэфирные связи. Лецитины—соединения, расщепляющиеся при гидролизе с образованием высших жирных кислот [гл. обр. пальмитиновой, стеариновой, олеиновой и арахидоновой (С20Н32О2)], глицеро-фосфорноЙ кислоты и холина. фосфатидилхолин (лецитин) фосфатидилэтаноламин (устаревшее название = кефалин) 26. Гравиметрический анализ. Гравиметрический анализ - метод количественного химического анализа, основанный на точном измерении массы определяемого вещества или его составных частей, выделяемых в виде соединений точно известного постоянного состава. Гравиметрические определения можно разделить на три группы: методы осаждения, отгонки и выделения. Методы осаждения основаны на осаждении определяемого компонента в виде малорастворимого химического соединения, фильтровании, прокаливании до постоянной массы и последующем определении массы полученного вещества. При этом различают осаждаемую форму - форму, в виде которой определяемое вещество осаждают, и гравиметрическую форму - форму, в виде которой определяемое вещество взвешивают. Методы отгонки основаны на отгонке определяемого компонента в виде летучего соединения с последующим определением массы отогнанного вещества (прямое определение) или массы остатка (косвенное определение). Методы выделения основаны на количественном выделении определяемого компонента из анализируемого раствора путем химической реакции с последующим определением массы выделенного вещества. Этот принцип положен в основу электрогравиметрического метода анализа, в котором определяемый компонент выделяется из раствора в результате электрохимических реакций, протекающих на электродах. Среди гравиметрических методов анализа наиболее широко применяют метод осаждения. 27. Титриметрический анализ. Титриметрический анализ-метод количественного анализа, основанный на измерении объёма раствора с точно известной концентрацией реактива, требующегося для реакции с данным количеством определяемого вещества В Т. а. используются реакции осаждения, кислотно-основные, окислительно-восстановительные, комплексообразования и др. Основные требования к применяемым в Т. а. реакциям — взаимодействие быстрое, в стехиометрических соотношениях, без побочных реакций, искажающих результаты анализа. В Т. а. существует несколько приёмов. Прямое титрование состоит в том, что пробу анализируемого вещества титруют стандартным раствором, или титрантом, до точки эквивалентности — момента, когда количество стандартного раствора эквивалентно кол-ву определяемого вещества в соответствии с уравнением химическим для данной реакции. Конец титрования устанавливают визуально по изменению окраски вводимого индикатора либо инструментально. Титрование обратное, или по остатку, применяют, когда определяемое вещество не реагирует со стандартным раствором или реагирует недостаточно быстро. В этом случае к пробе анализируемого вещества прибавляют заведомый избыток стандартного раствора и остаток его после реакции с определяемым веществом титруют др. стандартным раствором. Титрование по замещению применяют, когда непосредственное определение данного вещества затруднительно (отсутствует подходящий титрант, нет необходимого индикатора и т. д.). В этом случае анализируемое вещество посредством реакции с неопределённым избытком соответствующего реагента переводят в др. соединение, которое титруют стандартным раствором, как это было описано выше. Например, этим методом определяют количество бихромата калия в растворе 28. Физико-химические методы. Помимо химических методов качественного анализа известны другие методы идентификации химических элементов и их соединений. Так, то или иное вещество можно обнаружить физическими методами анализа, не прибегая к химическим реакциям, или физико-химическими методами путем изучения и наблюдения физических явлений, происходящих при химических реакциях. К таким методам, называемым часто инструментальными, относятся следующие методы качественного анализа; - спектральный; - люминесцентный; - хроматографический; - полярографический и некоторые другие. Очень часто химические методы сочетают с физическими и физико-химическими методами анализа, что обеспечивает более высокую чувствительность и более точные результаты анализа. Повышение чувствительности и избирательности методов имеет большое значение для анализа особо чистых веществ, содержащих следовые количества примесей. Для определения малых количеств (следов) примесей используют методы предварительного выделения, концентрирования (обогащения) микропримесей. К числу этих методов относятся: - хроматографические методы; - экстрагирование; -соосаждение; -дистилляция (отгонка) летучих соединений и некоторые другие методы. Сочетая те или иные методы концентрирования с физическими или физико-химическими методами анализа, можно достичь высокой степени чувствительности, во много раз превышающей чувствительность отдельных методов. 29. Титриметрия. Титриметрия -совокупность методов количественного анализа, основанных на измерении количества реагента, необходимого для взаимодействия с определяемым компонентом в растворе или газовой фазе в соответствии со стехиометрией химической реакций между ними. При проведении эксперимента можно контролировать либо объем, либо массу добавляемого титранта-раствора или газовой смеси с точно известной концентрацией Ст реагента. Наибольшее распространение получила титриметрия для экспрессного определения высоких и средних концентраций веществ в растворах, в том числе неводных. Точно известный объем Vанализируемого раствора с помощью пипетки помещают в коническую колбу и к нему прибавляют небольшими порциями титрант из бюретки (калиброванная стеклянная трубка с клапанным устройством, например краном, на оттянутом конце), тщательно перемешивая раствор в колбе. Эту операцию называют титрованием. Массовые титриметрические анализы обычно проводят с помощью титраторов. Процесс титрования сопровождается изменением равновесных концентраций реагента, определяемого вещества и продуктов реакции. Это удобно изобразить графически в виде титриметрия называют кривой титрования в координатах концентрация определяемого вещества (или пропорциональная ей величина)-объем (масса) титранта. Измерив объем Vт титранта в конце титрования, рассчитывают концентрацию Санализируемого раствора по формуле:CV= CтVт (концентрации выражены в моль/л). Теоретически необходимо добавить такой объем титранта, который содержит количество реагента, эквивалентное количеству определяемого компонента в соответствии со стехиометрией реакции между ними при условии, что эта реакция практически необратима. Этот объем титранта соответствует точке эквивалентности (т. э.), или моменту стехиометричности. Практически определяют, однако, не т.э., а конечную точку титрования (к.т.т.), которая должна максимально совпадать с т.э. для получения минимальной погрешности титрования. Фиксировать к.т.т. можно по изменению окраски добавленного индикатора (выбор которого осуществляют по теоретически рассчитанной кривой титрования) или по достаточно резкому изменению каких-либо физические характеристики раствора, зависящей от концентрации определяемого вещества - тока, окислительно-восстановительного потенциала, оптической плотности, электрической проводимости и количества электричества. Соответственно различают амперометрическое титрование, потенциометрической, фотометрическое, кондуктометрической и кулонометрическое титрование .В этих титриметрических методах кривая титрования представляет собой зависимость измеряемой физической величины от объема (или массы) титранта. 30. Классификация методов титриметрического анализа. I) по типам реакций, лежащих в их основе: а)Методы кислотно-основного титрования. Они основаны на использовании реакции нейтрализации, применяют для определения кислот, оснований и солей, которые при гидролизе создают кислую или щелочную реакцию среды. б) Методы осадительного титрования. В этих методах исследуемое вещество при взаимодействии с титрантом образует малорастворимое соединение. в)Методы комплексиметрического титрования. Эти методы основаны на образовании слабоионизированных комплексов титранта с исследуемым веществом. г)Методы окислительно-восстановительного титрования (редокс-методы). Они основаны на окислительно-восстановительных реакциях, протекающих между определяемым веществом и титрантом. В зависимости от свойств используемого титранта методы окислительно-восстановительного титрования подразделяют на оксидиметрию и редуктометрию. Оксидиметрия — метод определения восстановителей путем титрования их стандартными растворами окислителей. Редуктометрия — метод определения окислителей путем титрования их стандартными растворами восстановителей. II) по титранту. Это более широкий способ классификации титриметрических методов. Название метода происходит от названия титранта. В методах кислотно-основного титрования: если титрантом является кислота, то метод называется ацидиметрией; если титрант — основание, то метод называется алкалиметрией. В методах осаждения: при титровании раствором AgNO3 метод называется аргентометрией, при титровании раствором Hg2(NO3)2 — меркурометрией. В методах комплексообразования: при титровании раствором трилона Б (то есть комплексона III) метод называется трилонометрией (комплексоно-метрией), при титровании раствором Hg(NO3)2 — меркуриметрией. В методах окислительно-восстановительного титрования: при титровании раствором калия перманганата KMnO4 метод называется перманганатомет-рией, при титровании раствором KBrO3 — броматометрией, при титровании раствором NaNO2 — нитритометрией. III) по способу титрования. а)Прямое титрование. Состоит в том, что к определенному объему раствора определяемого вещества прибавляют по каплям титрант до достижения конечной точки титрования. б)Обратное титрование (титрование по остатку). Этот способ используют в тех случаях, когда определяемое вещество является летучим или реакция между титрантом и определяемым веществом протекает медленно, а также в случаях, когда для прямого титрования невозможно подобрать индикатор. К определяемому веществу добавляют избыток титранта, взаимодействующего с этим веществом. После прохождения химической реакции остаток титранта оттитровывают вторым титрантом. в)Заместительное титрование. Используют в случаях, если анализируемое вещество не реагирует с титрантом или реагирует нестехиометрично. К определяемому веществу прибавляют вспомогательный реагент, с которым оно образует новое соединение (заместитель) в эквивалентных количествах. Концентрацию последнего определяют прямым титрованием. 31. Кислотно-основные реакции. Алкали- и ацидометрия. Метод кислотно-основного титрования основан на реакциях взаимодей ствия между кислотами и основаниями, то есть на реакции нейтрализации: |
