Обратимые и необратимые реакции
 Скачать 21.28 Kb. Скачать 21.28 Kb.
|
|
Обратимые и необратимые реакции Все химические реакции разделяют на две группы: обратимые и необратимые. Когда при химическом взаимодействии хотя бы одно из веществ расходуется полностью, реакция считается необратимой. Она протекает до конца. К необратимым относят реакции между веществами, в результате которых образуются осадки, газы, и малодиссоциирующие вещества. Обратимые реакции протекают не до конца. В них ни одно из реагирующих веществ не расходуется полностью. Необратимая реакция может протекать только в одном направлении. Обратимая реакция может протекать как в прямом, так и в обратном направлении. Химическое равновесие – состояние, когда прямая и обратная реакция протекают с одинаковой скоростью. Признаки химического равновесия. Постоянство концентраций участников реакции. Продолжают протекать прямая и обратная реакции. Возможность подхода с двух сторон. Наиболее устойчивое состояние при заданных условиях (при заданных T и P энергия Гиббса G минимальна). При внешнем воздействии химическое равновесие может смещаться. Критерий обратимости химической реакции при заданных температуре и давлении 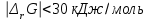 . .Константа химического равновесия Константа равновесия – характерная величина для каждой обратимой химической реакции. 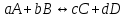 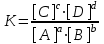 Она равна отношению произведений равновесных концентраций продуктов реакции в степени их стехиометрических коэффициентов к произведению равновесных концентраций исходных веществ в степени их стехиометрических коэффициентов. Константа химического равновесия зависит от природы реагирующих веществ и температуры, но НЕ зависит от концентрации. Связь стандартной энергии Гиббса и константы равновесия 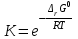 , ,где К – константа равновесия, 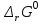 – изменение свободной энергии системы (энергии Гиббса) в химической реакции (Дж/моль), R – универсальная газовая постоянная (8,31 Дж/(моль·К)), Т – температура в К. – изменение свободной энергии системы (энергии Гиббса) в химической реакции (Дж/моль), R – универсальная газовая постоянная (8,31 Дж/(моль·К)), Т – температура в К.Смещение химического равновесия Принцип Ле-Шателье: если на систему, находящуюся в состоянии равновесия в изобарно-изотермических или изохорно-изотермических условиях, оказать какое-либо внешнее воздействие, то равновесие сместится в сторону ослабления этого воздействия. Факторы, влияющие на положение равновесия: добавление или отведение участников реакции из реакционной смеси (изменение концентрации), изменение температуры, изменение давления (объема) при участии в реакции газообразных веществ. Изменение концентрации: еслидобавлено исходное вещество, химическое равновесие смещается в сторону продуктов реакции; еслидобавлен продукт реакции – химическое равновесие будет смещено в сторону исходных реагентов. Изменение давлениявлияет на химическое равновесие в газовой фазе и равновесие гетерогенных реакций с участием газообразных веществ. При увеличении давления равновесие смещается в сторону уменьшения числа молей газообразных веществ. Изменение температуры: при повышении температуры равновесие смещается в сторону протекания эндотермической реакции, при понижении – в сторону экзотермической. |
