Образцы тестов. Химическая кинетика. Термодинамика
 Скачать 234.5 Kb. Скачать 234.5 Kb.
|
|
Вариант 2 Изолированной системой называют такую систему, которая: 1) не обменивается с окружающей средой ни веществом, ни энергией 2) обменивается с окружающей средой и веществом, энергией 3) обменивается с окружающей средой энергией, но не обменивается веществом 4) не обменивается с окружающей средой энергией, но обменивается веществом Какие величины являются функциями состояния системы: а) внутренняя энергия; б) работа; в) тепло; г) энтальпия; д) энтропия? 1) а, г, д. 2) б, в. 3) все величины. 4) а, б, в, г. Какое уравнение является математическим выражением 1- го закона термодинамика для закрытых систем? 1) ΔU = 0 2) ΔU = Q – p∙ΔV 3) ΔG = ΔH - T∙ΔS 4) ΔS>0 Укажите формулировку закона Гесса: 1) тепловой эффект реакции зависит только от начального и конечного состояния системы и не зависит от пути реакции 2) теплота, поглощаемая системой при постоянном объеме, равна изменению внутренней энергии системы 3) теплота, поглощаемая системой при постоянном давлении, равна изменению энтальпии системы 4) теплота, поглощаемая системой при постоянном давлении, равна изменению энтропии системы В каком из следующих процессов должно наблюдаться наибольшее положительное изменение энтропии: 1) 1 моль СН3ОН(тв) →1 моль СН3ОН(г) 2) 1 моль СН3ОН(тв) →1 моль СН3ОН(ж) 3) 1 моль СН3ОН(ж) →1 моль СН3ОН(г) 4) 1 моль СН3ОН(г) →1 моль СН3ОН(ж) Как изменяется энтропия системы за счет прямой и обратной реакции при синтезе аммиака? 1) прямая реакция идет с уменьшением энтропии, обратная – с увеличением 2) прямая реакция идет с увеличением энтропии, обратная – с уменьшением 3) энтропия не изменяется в ходе реакции 4) энтропия сначала увеличивается, затем уменьшается Какие процессы называют эндэргоническими? 1) ΔH< 0 2) ΔG < 0 3) ΔH> 0 4) ΔG > 0 Для обратимых процессов изменение свободной энергии Гиббса… 1) всегда равно нулю 2) всегда отрицательно 3) всегда положительно 4) сначала положительно, затем отрицательно Если ΔH<0 и ΔS< 0, то, в каком случае реакция может протекать самопроизвольно? 1) [ΔH]>[T∙ΔS] 2) при любых соотношениях ΔH и T∙ΔS 3) [ΔH]<[T∙ΔS] 4) ΔH=0; ΔS= 0 Гетерогенная система, состоящая из двух и более фаз с сильно развитой поверхностью раздела, называется: 1)неоднородной 2)дисперсной 3)поверхностной 4)диффузионной Если при увеличении температуры от 200С до 500С скорость реакции увеличилась в 8 раз, то температурный коэффициент скорости равен… 1) 4 2) 2 3) 2,67 4) 3 При увеличении давления в 5 раз скорость прямой химической реакции CO(г) + Cl2(г) = COCl2(г)... 1)не изменяется 2)увеличивается в 15 раз 3)увеличивается в 25 раз 4)увеличивается в 10 раз Если температурный коэффициент химической реакции равен 3 , то при повышении температуры от 30 °С до 60 °С скорость реакции: 1) увеличивается в 8 раз 2) уменьшается в 8 раз 3) увеличивается в 27 раз 4) уменьшается в 9 раз В каком направлении будет смещаться равновесие реакции: CH4(г) + H2O(r) ↔ СO(г) + 3H2(г) при уменьшении объема системы? 1) влево 2) вправо 3) не сместится 4) сначала вправо, затем влево Для смещения равновесия в сторону продуктов реакции N2 + H2 = NH3; ∆H < 0 необходимо: 1)уменьшить температуру 2)увеличить температуру 3)увеличить концентрацию NH3 4)уменьшить концентрацию N2 и H2 С наименьшей скоростью протекает коррозия железа под действием кислорода в водном растворе… 1) NaOH 2) NaCl 3) SO2 4) HCl Энергия активации Еа - это: 1) энергия, выделяющаяся в реакции; 2) энергия, необходимая для протекания реакции; 3) энергия образования 1 моль вещества. 4) энергия связи Какие из перечисленных воздействий приведут к изменению значения константы равновесия химических реакций? 1) введение катализатора 2) изменение концентраций реагирующих веществ 3) изменение температуры 4) уменьшение объема системы Экспериментально установлено, что кинетическое уравнение для реакции: 2NO(г) + О2(г) →2NO2(г) , имеет вид V = k∙c2 (NO) ∙ c(O2) 1) реакции является тримолекулярной 2) реакция протекает в одну сторону 3) реакция имеет третий порядок 4) реакция имеет первый порядок, как по кислороду, так и по монооксиду азота. Что называют сложной химической реакцией? 1) продукт образуется в результате непосредственного взаимодействия частиц реагентов 2) конечный продукт получается в результате осуществления двух и более простых реакций с образованием промежуточных продуктов 3) исходные вещества и продукты находятся в разных фазах 4) исходные вещества и продукты находятся в твердой фазе При повышении температуры на каждые 10 градусов скорость большинства реакций: 1) увеличивается в 2–4 раза 2) не изменится 3) уменьшится в 2–4 раза 4) увеличивается в 7–9 раз Какая стадия называется лимитирующей стадией сложной химической реакции? 1) самая быстрая 2) имеющая низкую энергию активации 3) самая медленная 4) первая Уравнение константы равновесия гетерогенной химической реакции 2H2S(г.) + SO2(г.)↔ 2S(к.) + 2Н2О(г.) имеет вид… 1)Кравн = 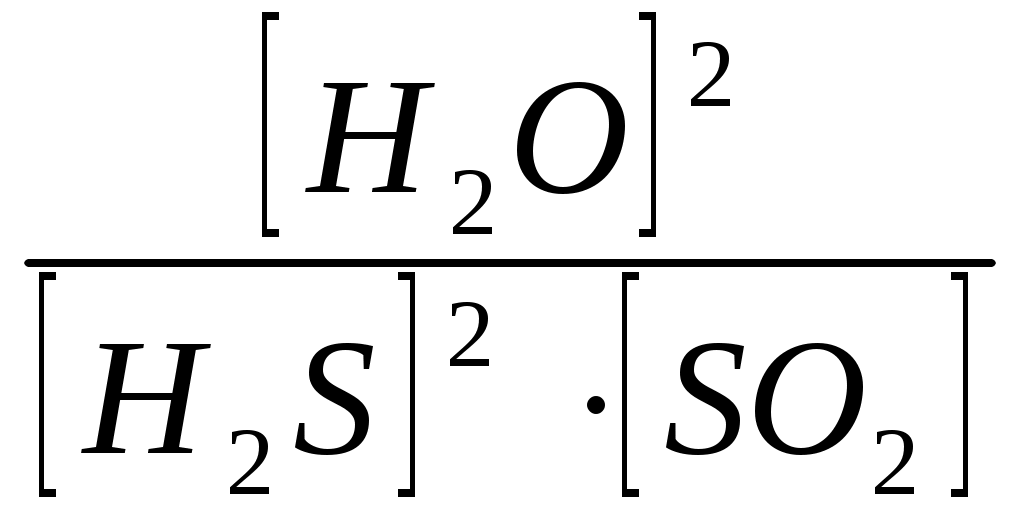 2)Кравн = 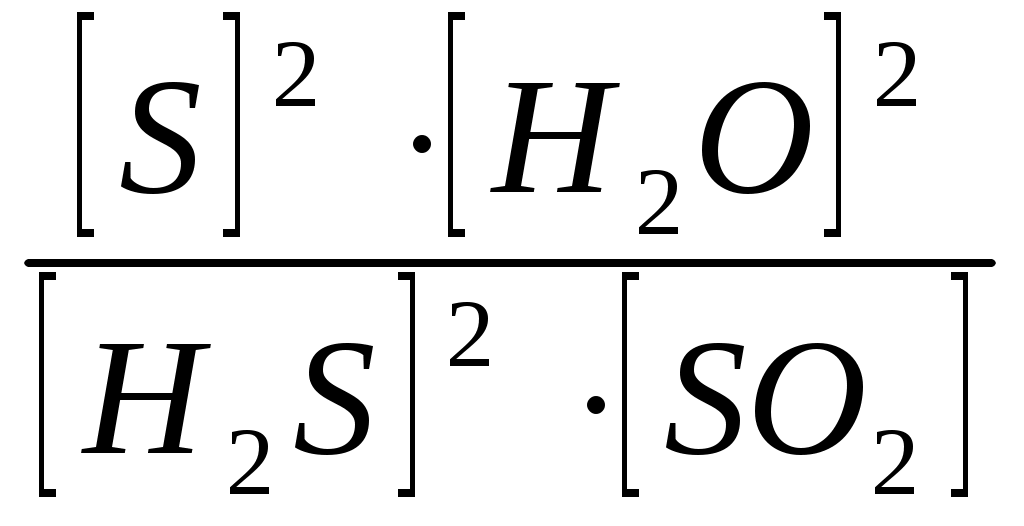 3)Кравн = 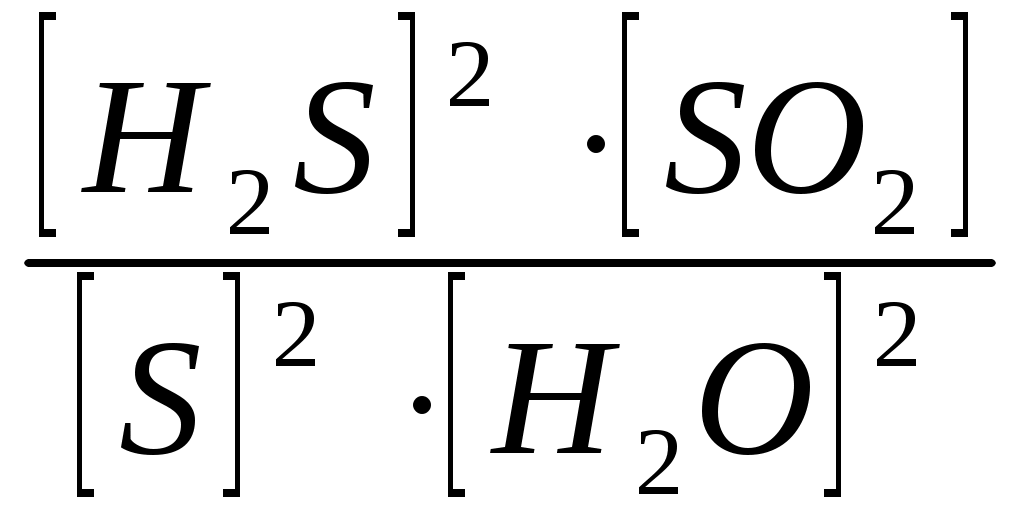 4)Кравн= 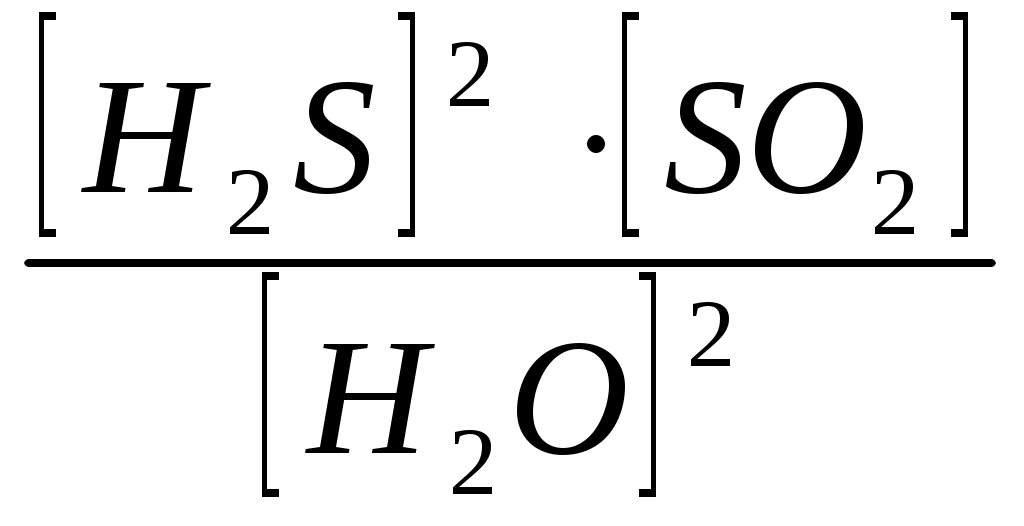 При увеличении давления в 5 раз скорость прямой химической реакции CO(г) + Cl2(г) = COCl2(г)... 1)не изменяется 2)увеличивается в 15 раз 3)увеличивается в 25 раз 4)увеличивается в 10 раз Реакции, в которых продукт первой элементарной стадии вступает в реакцию второй стадии и т. д., пока не образуется конечный продукт, называются: 1) параллельными 2) последовательными 3) сопряженными 4) эндэргоническими Для получения 1132 кДж тепла по реакции 2NO(г) + O2(г) <=> 2NO2(г);∆H° = -566 кДж необходимо затратить ___ литра(ов) кислорода. 1)56 2)11,2 3)22,4 4)44,8 Энтальпия образования H2S(г) равна - 21 кДж/моль. При взаимодействии 16 г серы и 11,2 л водорода выделяется ___ кДж теплоты. 1)21 2)5,25 3)42 4)10,5 Эндотермический процесс: 1)сопровождается выделением теплоты 2)сопровождается поглощением теплоты 3)сопровождается выпадением осадка 4)сопровождается выделением газа Самопроизвольным называется процесс, который… 1) осуществляется без помощи катализатора 2) сопровождается выделением теплоты 3) осуществляется без затраты энергии извне 4) протекает быстро Процессы, протекающие при постоянном объеме, называются: 1) изобарическими 2) изотермическими 3) изохорическими 4) изотермо-изобарическими
|
