Образцы тестов. Химическая кинетика. Термодинамика
 Скачать 234.5 Kb. Скачать 234.5 Kb.
|
|
Вариант 3
1) сохранения масс 2) Рауля 3) действующих масс 4) Вант–Гоффа
1) существенным уменьшением энергии активации соответствующего превращения 2) существенным увеличением энергии активации соответствующего превращения 3) образованием активированного комплекса 4) изменением давления
1) если концентрации реагирующих веществ постоянны и равны единице 2) если концентрации реагирующих веществ постоянны и не равны единице 3) если реагирующие вещества и продукты реакции находятся в одной фазе. 4) если концентрации реагирующих веществ постоянны и равны
1) времени, температуры, концентрации 2) природы реагирующих веществ, температуры, концентрации 3) времени, температуры, концентрации, природы реагирующих веществ 4) времени, температуры, давления
1)3 раза 2)6 раз 3)9 раз 4)27 раз
1)не изменяется 2)увеличивается в 2 раза 3)увеличивается в 4 раза 4)уменьшается в 4 раза
2СО(г.)↔С(графит)+СО2 (г.) имеет вид… 1)Крав= 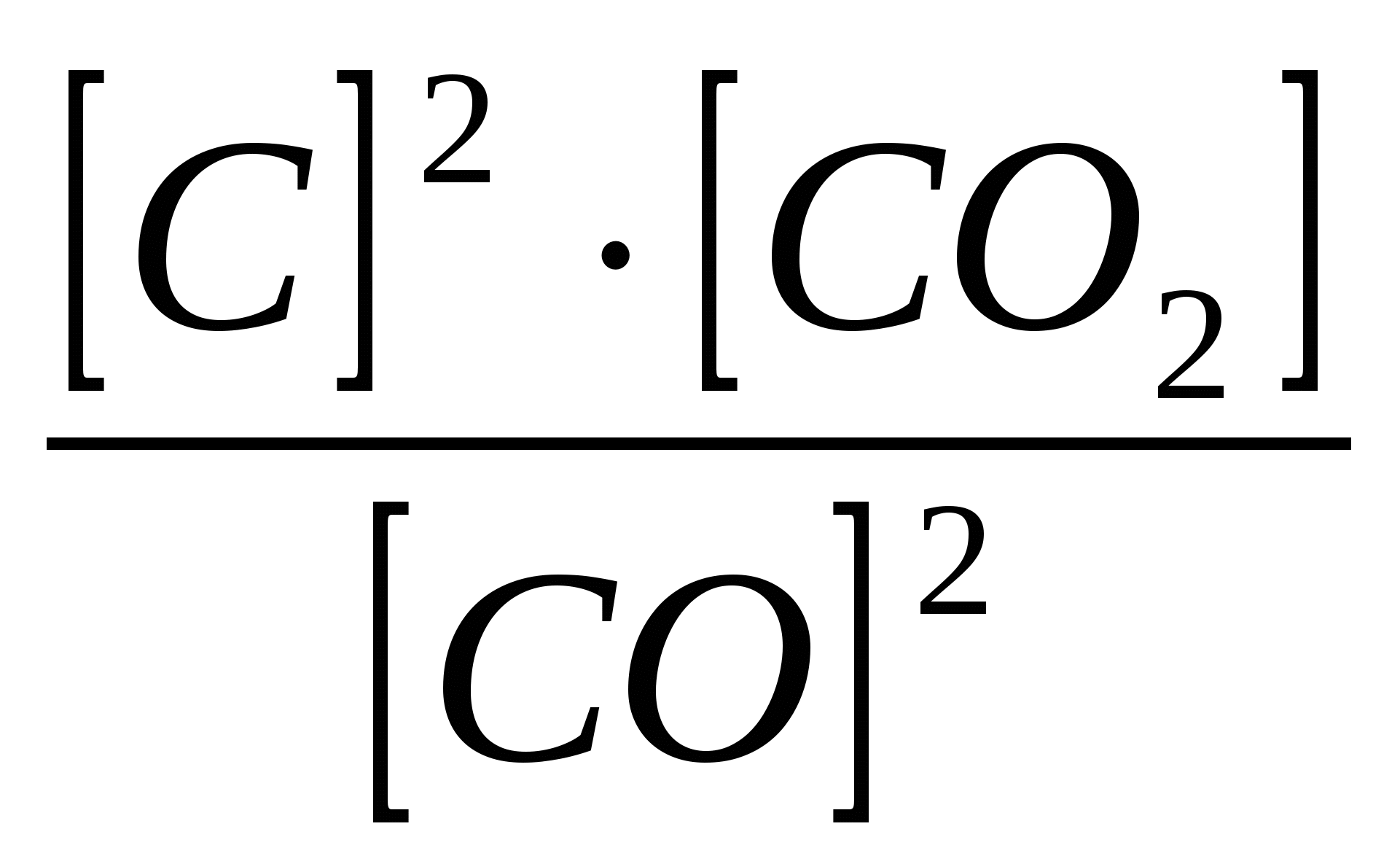
1) от времени реакции, температуры, катализатора 2) от природы реакции, температуры, концентрации 3) от природы реакции, температуры, катализатора 4) от времени реакции концентрации
1) показатель степени при концентрации, входящей в кинетическое уравнение 2) сумму показателей степеней при концентрациях, входящих в кинетическое уравнение 3) сумму стехиометрических коэффициентов реакции 4) сумму стехиометрических коэффициентов конечных продуктов
1) прямой – увеличивается, обратной – уменьшается 2) прямой – уменьшается, обратной – увеличивается 3) прямой и обратной – увеличиваются 4) прямой и обратной – уменьшаются
1) 148,5 2) 297 3) 74,25 4) 594
1)186 ,5 кДж 2) 393 кДж 3) 786 кДж 4) 98,2 кДж
1) эндотермическими 2) экзотермическими 3) эндэргоническими 4) экзэргоническими
1) для которых ΔH отрицательно 2) для которых ΔG отрицательно 3) для которых ΔH положительно 4) для которых ΔG положительно
1) изолированной 2) открытой 3) закрытой 4) замкнутой
1) а, б; 2) в, г, д, е 3) а, в, г, д, е 4) а, в, г, д
1) постоянной 2) переменной 3) равна нулю 4) уменьшается с ростом температуры
1) при постоянном объеме 2) при постоянной температуры 3) при постоянном давлении 4) при постоянной температуре и давлении
1) энтальпии 2) внутренней энергии 3) энтропии 4) температуры
1) эндотермическими 2) экзотермическими 3) эндэргоническими 4) экзэргоническими
1) внутренней энергии 2) энергии Гиббса 3) энтальпии 4) энтропии
1) ΔНо298 = 2ΔНо298,Н2S(г.) + ΔHо298, SО2(г.) – 2ΔНо298, Н2O(ж.) 2) ΔНо298 = ΔНо298, Н2O(ж.) - ΔHо298, Н2S(г.) – ΔНо298, SО2(г.) 3) ΔНо298 = 2ΔНо298, Н2O(ж.) - 2ΔHо298, Н2S(г.) – ΔНо298, SО2(г.) 4) ΔНо298 = ΔНо298,Н2S(г.) + ΔHо298, SО2(г.) – ΔНо298, Н2O(ж.)
1) ΔH< 0 2) ΔG < 0 3) ΔH> 0 4) ΔG > 0
1) всегда равно нулю 2) всегда отрицательно 3) всегда положительно 4) положительно или отрицательно в зависимости от обстоятельств
1) ΔH<0; ΔS>0 2) ΔH>0; ΔS< 0 3) ΔH<0; ΔS< 0 4) ΔH=0; ΔS= 0
1)9 2)3 3)2 4)6
1) 2 раза 2) 3 раза 3) 6 раз 4) 9 раз
1) не изменится 2) сместится в сторону продуктов реакции 3) изменится неоднозначно 4) сместится в сторону исходных веществ
CaCO3(тв) <=> CaO(тв) + CO2(г);∆rH° > 0 в сторону продуктов реакции необходимо: 1)увеличить давление 2)уменьшить температуру 3)ввести катализатор 4)увеличить температуру
1)понизить давление 2)ввести ингибитор 3)ввести катализатор 4)понизить температуру
|
