Образцы тестов. Химическая кинетика. Термодинамика
 Скачать 234.5 Kb. Скачать 234.5 Kb.
|
|
Вариант 2
1) не обменивается с окружающей средой ни веществом, ни энергией 2) обменивается с окружающей средой и веществом, энергией 3) обменивается с окружающей средой энергией, но не обменивается веществом 4) не обменивается с окружающей средой энергией, но обменивается веществом
б) работа; в) тепло; г) энтальпия; д) энтропия? 1) а, г, д. 2) б, в. 3) все величины. 4) а, б, в, г.
1) ΔU = 0 2) ΔU = Q – p∙ΔV 3) ΔG = ΔH - T∙ΔS 4) ΔS>0
1) тепловой эффект реакции зависит только от начального и конечного состояния системы и не зависит от пути реакции 2) теплота, поглощаемая системой при постоянном объеме, равна изменению внутренней энергии системы 3) теплота, поглощаемая системой при постоянном давлении, равна изменению энтальпии системы 4) теплота, поглощаемая системой при постоянном давлении, равна изменению энтропии системы
1) 1 моль СН3ОН(тв) →1 моль СН3ОН(г) 2) 1 моль СН3ОН(тв) →1 моль СН3ОН(ж) 3) 1 моль СН3ОН(ж) →1 моль СН3ОН(г) 4) 1 моль СН3ОН(г) →1 моль СН3ОН(ж)
1) прямая реакция идет с уменьшением энтропии, обратная – с увеличением 2) прямая реакция идет с увеличением энтропии, обратная – с уменьшением 3) энтропия не изменяется в ходе реакции 4) энтропия сначала увеличивается, затем уменьшается
1) ΔH< 0 2) ΔG < 0 3) ΔH> 0 4) ΔG > 0
1) всегда равно нулю 2) всегда отрицательно 3) всегда положительно 4) сначала положительно, затем отрицательно
1) [ΔH]>[T∙ΔS] 2) при любых соотношениях ΔH и T∙ΔS 3) [ΔH]<[T∙ΔS] 4) ΔH=0; ΔS= 0
1)неоднородной 2)дисперсной 3)поверхностной 4)диффузионной
1) 4 2) 2 3) 2,67 4) 3
CO(г) + Cl2(г) = COCl2(г)... 1)не изменяется 2)увеличивается в 15 раз 3)увеличивается в 25 раз 4)увеличивается в 10 раз
1) увеличивается в 8 раз 2) уменьшается в 8 раз 3) увеличивается в 27 раз 4) уменьшается в 9 раз
1) влево 2) вправо 3) не сместится 4) сначала вправо, затем влево
1)уменьшить температуру 2)увеличить температуру 3)увеличить концентрацию NH3 4)уменьшить концентрацию N2 и H2
1) NaOH 2) NaCl 3) SO2 4) HCl
1) энергия, выделяющаяся в реакции; 2) энергия, необходимая для протекания реакции; 3) энергия образования 1 моль вещества. 4) энергия связи
1) введение катализатора 2) изменение концентраций реагирующих веществ 3) изменение температуры 4) уменьшение объема системы
1) реакции является тримолекулярной 2) реакция протекает в одну сторону 3) реакция имеет третий порядок 4) реакция имеет первый порядок, как по кислороду, так и по монооксиду азота.
1) продукт образуется в результате непосредственного взаимодействия частиц реагентов 2) конечный продукт получается в результате осуществления двух и более простых реакций с образованием промежуточных продуктов 3) исходные вещества и продукты находятся в разных фазах 4) исходные вещества и продукты находятся в твердой фазе
1) увеличивается в 2–4 раза 2) не изменится 3) уменьшится в 2–4 раза 4) увеличивается в 7–9 раз
1) самая быстрая 2) имеющая низкую энергию активации 3) самая медленная 4) первая
1)Кравн = 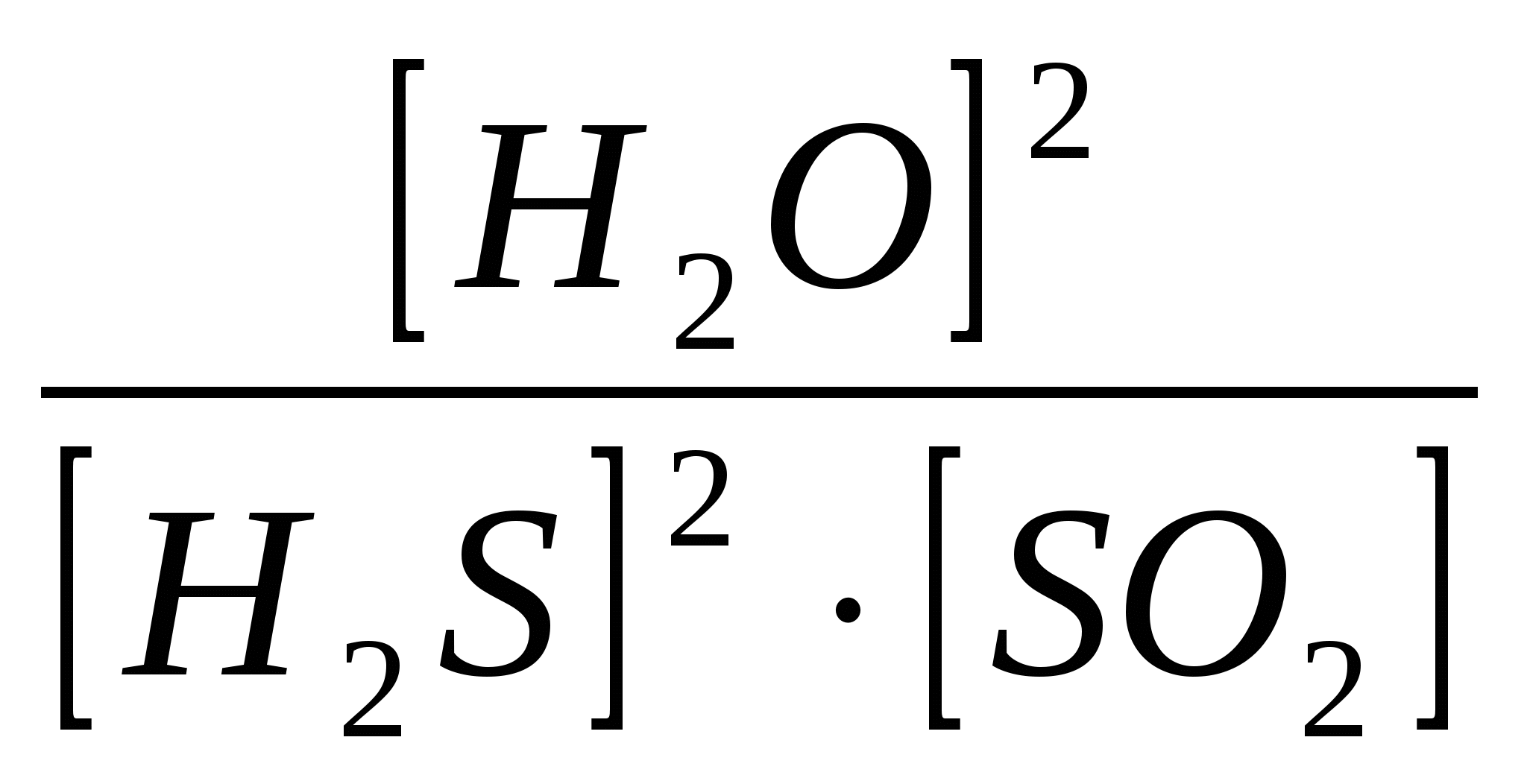 2)Кравн = 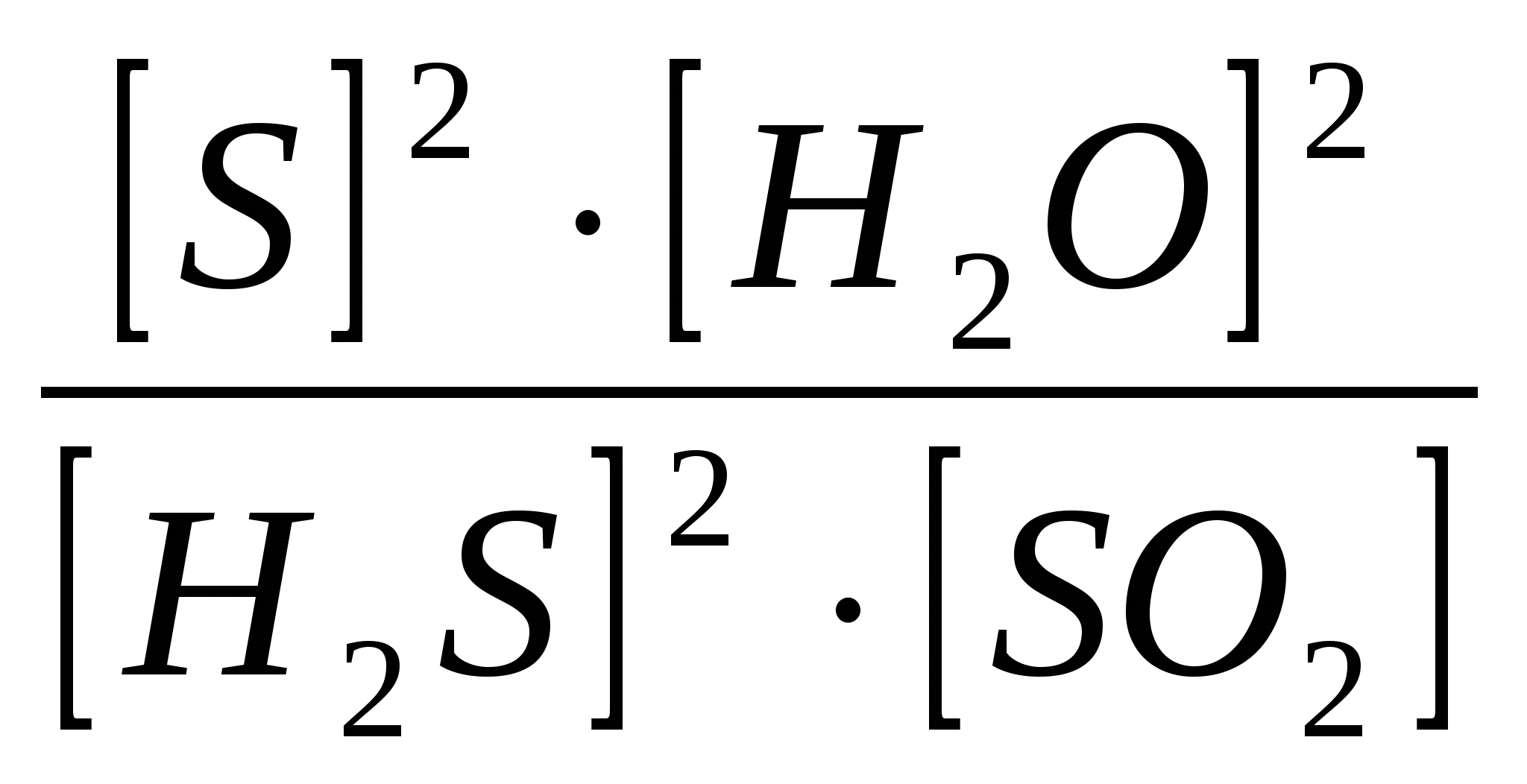 3)Кравн = 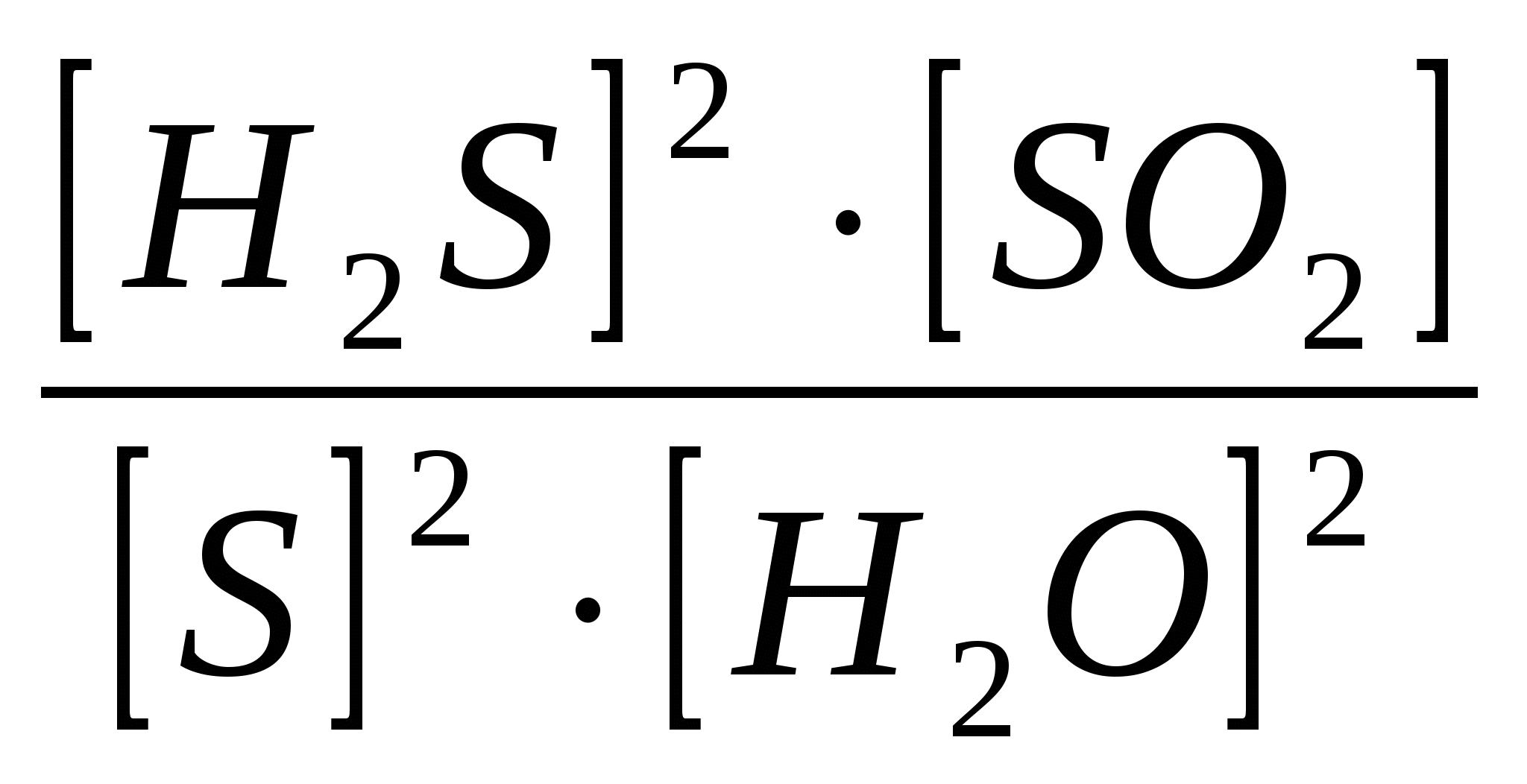 4)Кравн= 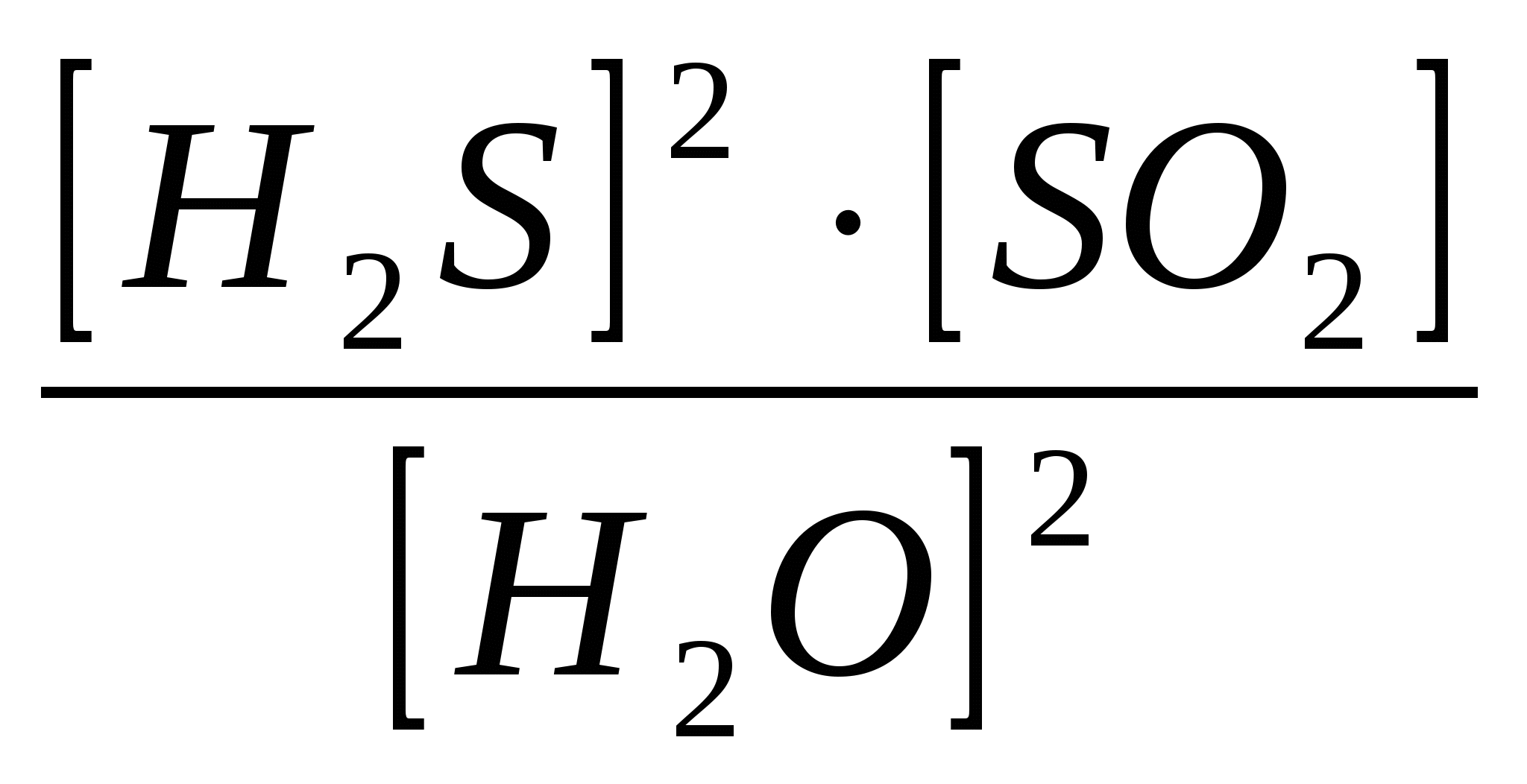
CO(г) + Cl2(г) = COCl2(г)... 1)не изменяется 2)увеличивается в 15 раз 3)увеличивается в 25 раз 4)увеличивается в 10 раз
1) параллельными 2) последовательными 3) сопряженными 4) эндэргоническими
2NO(г) + O2(г) <=> 2NO2(г);∆H° = -566 кДж необходимо затратить ___ литра(ов) кислорода. 1)56 2)11,2 3)22,4 4)44,8
1)21 2)5,25 3)42 4)10,5
1)сопровождается выделением теплоты 2)сопровождается поглощением теплоты 3)сопровождается выпадением осадка 4)сопровождается выделением газа
1) осуществляется без помощи катализатора 2) сопровождается выделением теплоты 3) осуществляется без затраты энергии извне 4) протекает быстро
1) изобарическими 2) изотермическими 3) изохорическими 4) изотермо-изобарическими
|
