|
|
Общая химическая технология
§ 6.4. Оптимальный температурный режим
и способы его осуществления в промышленных реакторах
В предыдущих параграфах были рассмотрены варианты тепловых режимов химических реакторов и способы учета теплопереноса в реакторе при разработке математической модели.
Температурный (тепловой) режим проведения химического процесса, обеспечивающий экономически целесообразную максимальную производительность единицы объема реактора (интенсивность) по целевому продукту, называют оптимальным.
Подход к разработке оптимального температурного режима может быть различным в зависимости от типа химической реакции. Очевидно, что максимальная интенсивность реактора будет достигнута при проведении процесса с максимально возможной скоростью. Рассмотрим поэтому, как влияет тип кинетического уравнения на выбор температурного режима.
Простые необратимые реакции. Уравнение скорости необратимых экзо- и эндотермических реакций можно записать в виде
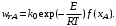 (6.26) (6.26)
Например, для реакции первого порядка
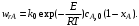 (6.27) (6.27)
Скорость химической реакции является функцией нескольких переменных: температуры и степеней превращения реагентов (или их концентраций). С ростом температуры константа скорости реакции в соответствии с уравнением Аррениуса монотонно возрастает. Из уравнений (6.26) и (6.27) видно, что принципиальных ограничений повышения температуры с целью увеличения скорости необратимых реакций нет. С ростом степени превращения реагентов скорость реакции падает. Для компенсации этого уменьшения целесообразно увеличивать температуру.
Эндотермическая реакция сопровождается поглощением теплоты. Следовательно, такие реакции невыгодно проводить в адиабатических условиях, так как по мере протекания реакции ее скорость будет падать как из-за увеличения степени превращения, так и из-за уменьшения температуры. Более разумно проводить эндотермические процессы в реакторах с подводом теплоты (изотермических или в реакторах с промежуточным тепловым режимом), поддерживая температуру, максимально допустимую по конструкционным соображениям. Необходимо при этом дополнительно провести оптимизацию температурного режима, сопоставив экономические показатели: увеличение прибыли вследствие роста производительности реактора и возрастания расходов на поддержание высокой температуры.
Для необратимых экзотермических реакций рост степени превращения сопровождается выделением теплоты, и, следовательно, в адиабатическом режиме это приведет к возрастанию температуры реакционной смеси. Уменьшение скорости реакции вследствие увеличения степени превращения будет частично компенсироваться ростом константы скорости реакции с возрастанием температуры. Проводя такую реакцию в проточном адиабатическом реакторе, можно обеспечить высокую скорость химической реакции и высокую производительность реактора в автотермическом режиме без использования посторонних источников теплоты. При этом теплота реакционной смеси, выходящей из реактора, служит для нагрева исходных реагентов на входе в реактор.
Обратимые химические реакции. Проанализируем условия обеспечения оптимального температурного режима обратимых реакций на примере обратимой реакции первого порядка А 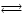 R. Скорость такой реакции R. Скорость такой реакции
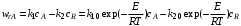 (6.28) (6.28)
или [см. уравнение (6.20)]
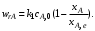 (6.29) (6.29)
С одной стороны, как и скорость необратимой реакции [см. выражение (6.27)], она зависит от константы скорости k1 и глубины химического превращения хА, а с другой – определяется степенью приближения реакционной системы к состоянию химического равновесия и значением предельно достижимой степени превращения в равновесных условиях хА,е. Характер изменения скорости с ростом температуры будет разным для эндо- и экзотермических реакций.
Повышение температуры проведения обратимой эндотермической реакции приводит одновременно к росту k1и увеличению равновесной степени превращения хА,е. Следовательно, при фиксированной степени превращения хА скорость обратимой эндотермической реакции с ростом температуры монотонно увеличивается. Поэтому подход к разработке оптимального температурного режима этих реакций будет таким же, как и для необратимых эндотермических процессов.
Иначе обстоит дело с обратимыми экзотермическими реакциями. Так как скорость реакции – функция нескольких переменных (по меньшей мере, двух – T и хА), то для анализа этой функции удобно использовать ее сечение при постоянстве всех переменных, кроме одной.
Такой подход облегчает и задачу графического представления функции. Функция п переменных f (х1, х2, ..., хn)графически изображается некоторой поверхностью в (п + 1)-мерном пространстве. Сечения функции можно представить в виде семейства графиков на плоскости в координатах f (х1,х2, ..., хn)÷хiпри постоянстве переменных х1, х2, ..., хi–1, хi+1, ..., хn.
В частности, рассмотрим два вида сечений функций wrA(xA,T): при постоянных значениях хA и при постоянных значениях Т.
Выберем некоторое значение степени превращения 0 < хА,1 < 1. Для этой степени превращения концентрация исходного реагента при протекании реакции А 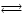 R составит сА,1 = сА,0(1 – хА,1), а концентрация продукта реакции cR,1 = сА,0хА,1. С ростом температуры увеличивается константа скорости прямой реакции [растет сомножитель k1сА,0 в уравнении (6.29)], но одновременно уменьшается равновесная степень превращения хА,е и при фиксированном значении хА,1 система находится ближе к состоянию равновесия [уменьшится второй сомножитель в уравнении (6.29)]. Таким образом, налицо два противоположных влияния. При низких температурах, когда темп изменения отношения хА,1 /хА,e меньше темпа роста константы скорости k1 с увеличением температуры, преобладает влияние первого (возрастающего) сомножителя. При некоторой температуре T1,eвыбранная степень превращения хА,1 становится равновесной (хА,е при температуре T1,е), тогда скорость прямой реакции равна скорости обратной реакции и суммарная скорость реакции будет формально равна нулю. При приближении к этой температуре (слева) преобладает влияние второго сомножителя, характеризующего степень приближения системы к равновесию. Очевидно, что существует какая-то оптимальная температура Т1,т,при которой скорость реакции при заданной степени превращения является максимальной. Найдем эту температуру, пользуясь методами математического анализа (определение экстремума функции). Для этого продифференцируем функцию (6.28) по температуре, считая концентрации сА и cR постоянными, и приравняем производную нулю: R составит сА,1 = сА,0(1 – хА,1), а концентрация продукта реакции cR,1 = сА,0хА,1. С ростом температуры увеличивается константа скорости прямой реакции [растет сомножитель k1сА,0 в уравнении (6.29)], но одновременно уменьшается равновесная степень превращения хА,е и при фиксированном значении хА,1 система находится ближе к состоянию равновесия [уменьшится второй сомножитель в уравнении (6.29)]. Таким образом, налицо два противоположных влияния. При низких температурах, когда темп изменения отношения хА,1 /хА,e меньше темпа роста константы скорости k1 с увеличением температуры, преобладает влияние первого (возрастающего) сомножителя. При некоторой температуре T1,eвыбранная степень превращения хА,1 становится равновесной (хА,е при температуре T1,е), тогда скорость прямой реакции равна скорости обратной реакции и суммарная скорость реакции будет формально равна нулю. При приближении к этой температуре (слева) преобладает влияние второго сомножителя, характеризующего степень приближения системы к равновесию. Очевидно, что существует какая-то оптимальная температура Т1,т,при которой скорость реакции при заданной степени превращения является максимальной. Найдем эту температуру, пользуясь методами математического анализа (определение экстремума функции). Для этого продифференцируем функцию (6.28) по температуре, считая концентрации сА и cR постоянными, и приравняем производную нулю:
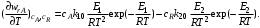
Отсюда при Т = Тт
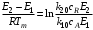 . .
Или
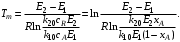 (6.30) (6.30)
Уравнение (6.30) позволяет определить оптимальную температуру для любой степени превращения кроме хА = 0 и хА = 1, когда функция wrA(T, xA) не имеет максимума.
Теперь можем построить сечение функцииwrA(T,хА)хА= xA–1 (рис. 6.9, кривая 1). Для другой степени превращения хА,2 > хА,1 функция wrА(T, хА)xА= xA,2также имеет максимум. Точка Т2,епересечения графика с осью абсцисс находится левее T1,е, так как у обратимых экзотермических реакций большая равновесная степень превращения достигается при меньшей температуре (при меньшей температуре наступает равенство хА,2и хА,е).
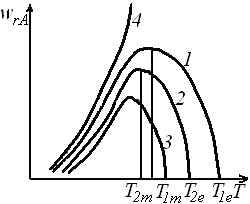
Рис. 6.9. Сечения функции wrA= wrA(xA, T)при постоянных температурах:
1, 2, 3 – зависимости wrA(T) для степеней превращения xA,1, xА,2, xА,3 (xА,1 < хА,2 < хАу); 4 – зависимость wrA(T)для хА = 0
Из уравнения (6.30) следует, что с ростом степени превращения оптимальная температура Т2ттакже уменьшается, потому что функция
у – хА(1 – хА) взнаменателе уравнения является возрастающей. Таким образом, кривая wrA(T)хA = хA,2 (кривая 2)будет находиться ниже кривой wrA(T)хA = хA,1(кривая 1) и ее максимум будет сдвинут влево.
Соединив точки максимумов (рис. 6.10) на различных сечениях wrA(T),получим линию оптимальных температур.
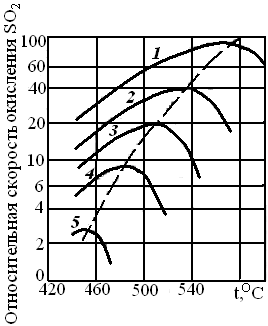
Рис. 6.10. Зависимость скорости окисления диоксида серы на ванадиевом
катализаторе от температуры при различных степенях превращения SO2:
1 – xSO2 = 0,7; 2 – xSO2 = 0,8; 3 – xSO2 = 0,85; 4 – xSO2 = 0,9; 5 – xSO2 = 0,95;
штриховая линия – линия оптимальных температур
Проведение процесса по линии оптимальных температур предполагает, что по мере увеличения степени превращения температуру в реакторе нужно уменьшать, чтобы скорость реакции всегда оставалась максимально возможной.
Чтобы убедиться в том, что скорость реакции действительно не может быть выше, чем при проведении процесса по линии оптимальных температур, рассмотрим сечения функции wrA(T, xA)при фиксированных температурах, т. е. зависимость скорости реакции от степени превращения.
Если Т – Т1 = const, величины k1и хА,е, зависящие от температуры и входящие в уравнение (6.29), также являются постоянными. Тогда уравнение (6.29) описывает прямую, пресекающую ось абсцисс в точке хА = хА,е и ось ординат в точке wrA = k1(Т1)сА,0 (рис. 6.11, линия 1). Для другой температуры Т2 > T1, точка пересечения прямой с осью абсцисс сдвинется влево, а точка пересечения с осью ординат – вверх.
Рис. 6.11. Сечения функции wrA = wrA(xA, T)при постоянных температурах:
1–5 – зависимости wrA(xA) для температур Т1, Т2, T3, Т4, Т5(T1<Т2<Т3<<Т4<Т5);
штриховая линия – линия оптимальных температур
На рис. 6.11 нанесено семейство таких сечений, отвечающее условию T1 < Т2< Т3< T4 < ... < Тn. Линия оптимальных температур будет получена в этом случае как огибающая этого семейства прямых. Из рис. 6.11 видно, что ни при каких температурах скорость реакции не может быть выше скоростей, определяемых линией оптимальных температур.
При решении практических задач линию оптимальных температур часто строят в координатах хА– Т. Тогда это линия, абсциссы точек которой – температуры, обеспечивающие максимальную скорость реакции для степеней превращения, являющихся ординатами этих точек. Для построения такой кривой можно воспользоваться уравнением типа (6.30). На рис. 6.12 приведена линия оптимальных температур для процесса окисления диоксида серы на ванадиевом (V2O5) катализаторе при составе исходной газовой смеси (в объемных долях, %) 7 % SO2 и 11 % О2. Линии 2 отвечают условию, когда скорость реакции составляет 80 % максимальной.
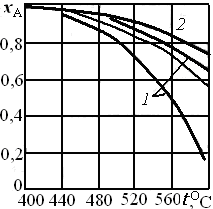
Рис. 6.12. Зависимость степени превращения диоксида серы
на ванадиевом катализаторе от температуры: 1 – линии,
отвечающие условию wrA = 0,8wrAopt; 2 – равновесная кривая;
штриховая линия – линия оптимальных температур wrA = wrAopt
Способы осуществления оптимального температурного режима
Решение практической задачи проведения процесса в промышленном реакторе в соответствии с оптимальным температурным режимом зависит от многих факторов и прежде всего от теплового эффекта и кинетики реакции.
Для эндотермических (обратимых и необратимых) реакций целесообразно химический процесс проводить в реакторах с подводом теплоты, причем желательно обеспечить достаточно равномерное распределение температуры по объему реактора. Распространенным типом аппаратов для проведения эндотермических реакций являются трубчатые реакторы, похожие по конструкции на кожухотрубные теплообменники. В этих аппаратах трубное пространство представляет собой собственно реактор, в котором реагенты движутся в режиме вытеснения, а по межтрубному пространству проходит теплоноситель, например топочные газы. Трубчатый реактор для проведения каталитических реакций, обогреваемый топочными газами (рис. 6.13), применяют, в частности, для паровой конверсии природного газа.
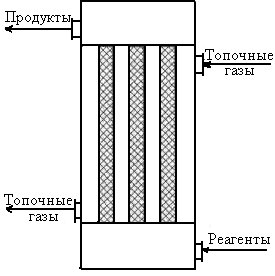
Рис. 6.13. Трубчатый реактор
для проведения эндотермической реакции
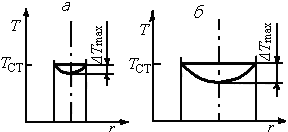
Рис. 6.14. Температурные профили
в каналах малого (а)и большого (б)диаметров
при проведении эндотермической реакции
Аналогичную конструкцию имеет ретортная печь для синтеза бутадиена из этилового спирта, в которой катализатор вместо труб располагают в ретортах – узких каналах с прямоугольным сечением. В таких реакторах ширина поперечного сечения каналов, по которым движется реакционная смесь, должна быть невелика, чтобы получить достаточно равномерное распределение температуры по сечению. Так как в реальных реакторах гидродинамический режим отклоняется от режима идеального вытеснения, при котором в любом поперечном сечении условия выровнены, то температура в центре канала отличается от температуры у стенки. Из рис. 6.14 видно, что в трубах большого диаметра температура на оси трубы существенно ниже температуры у стенки. Следовательно, и скорость реакции в той части реакционного потока, которая движется близко к оси трубы, ниже средней скорости в аппарате. При проведении каталитических процессов можно наносить катализатор только на внутреннюю поверхность труб, что обеспечит примерно одинаковую температуру по всему реактору.
Гомогенные эндотермические реакции можно также осуществлять в реакторах с интенсивным перемешиванием и теплообменной поверхностью, так как и в этом случае будет обеспечено равномерное распределение температуры по реактору.
Экзотермические реакции проводят, как правило, либо в адиабатических условиях, либо в аппаратах с отводом теплоты.
При осуществлении необратимых экзотермических реакций рост температуры приводит однозначно лишь к увеличению скорости процесса. Для снижения энергетических затрат такие реакции выгодно проводить в автотермическом режиме, когда требуемая температура обеспечивается исключительно выделяющейся теплотой химической реакции без подвода энергии извне. Существуют две предельные температуры (нижняя и верхняя), между которыми целесообразно проводить процесс.
Нижней предельной является температура, при которой скорость экзотермической реакции (следовательно, и скорость выделения теплоты) достаточна для обеспечения автотермического режима. Ниже этой теплоты скорость тепловыделения меньше скорости отвода теплоты с реакционным потоком, выходящим из реактора, и температура в проточном адиабатическом аппарате будет падать.
Верхнее предельное значение температуры связано с побочными процессами (побочными химическими реакциями или побочными физическими явлениями), а также с жаропрочностью конструкционных материалов. Например, при проведении гетерогенных процессов обжига зернистого твердого материала повышение температуры выше некоторого предельного значения приводит к спеканию твердых частиц, а, следовательно, к увеличению времени их полного превращения и уменьшению производительности реактора (см. гл. 7). Часто рост температуры ограничен прочностью конструкционных материалов и нецелесообразностью применения дорогостоящих жаропрочных материалов.
При проведении экзотермических процессов микробиологического синтеза повышение температуры ограничено жизнестойкостью микроорганизмов. Поэтому такие процессы целесообразно осуществлять в реакторах с отводом теплоты, а во избежание локальных перегревов лучше использовать реакторы, гидродинамический режим в которых приближается к идеальному смешению. Интенсивное перемешивание в таких процессах не только обеспечивает равномерное распределение температуры, но и интенсифицирует стадии массопередачи кислорода из газовой фазы в жидкую фазу.
Обратимые экзотермические реакции нужно проводить в соответствии с линией оптимальных температур, т. е. понижая температуру в аппарате по мере роста степени превращения реагентов. Такой режим неосуществим ни в адиабатических, ни в изотермических реакторах. При адиабатическом режиме рост степени превращения сопровождается выделением теплоты и разогревом, а не охлаждением реакционной смеси; при изотермическом режиме температура остается постоянной и не меняется с ростом степени превращения.
Осуществить процесс строго по линии оптимальных температур чрезвычайно сложно. Это можно было бы сделать в реакторе с теплообменной поверхностью, работающем в режиме вытеснения, при условии, что количество теплоты, отводимое через стенку реактора, будет разным на различных участках аппарата. Реагенты перед началом реакции следовало бы нагреть до высокой температуры, а сразу же после их поступления в аппарат предусмотреть отвод теплоты. Если реактор разбить по длине на несколько участков, то, чтобы обеспечить движение по линии оптимальных температур, на каждом из них количество отводимой теплоты должно быть немного больше количества теплоты, выделяющейся в ходе реакции. Следует иметь в виду, что по мере увеличения степени превращения падает скорость реакции и, следовательно, уменьшается скорость тепловыделения. Поэтому на участках реактора, где реакция завершается, нужно отводить меньше теплоты, чем на начальных участках.
Некоторым приближением к линии оптимальных температур является проведение процесса в реакторе вытеснения, находящемся внутри теплообменной трубки, по которой проходит холодный реагент (см. рис. 6.15). Такая конструкция может быть применена, например, в колоннах синтеза аммиака.
Рабочая линия процесса, характеризующая изменение температуры с ростом степени превращения (кривая 3)на участке BCFD, близка к линии оптимальных температур (штриховая линия). Однако указанные выше требования по условиям теплообмена в таком реакторе соблюдаются слабо. Действительно, на участке ВС скорость тепловыделения максимальна, и нужно отводить много теплоты. В то же время скорость теплоотвода здесь мала, так как невелика движущая сила теплопередачи (∆T). На участке FD теплоты выделяется сравнительно немного, но по наружной трубке идет холодный газ, ∆Т велика и скорость теплоотвода выше необходимой. В какой-то степени этот недостаток можно устранить в аналогичных реакторах с двойными теплообменными трубками (см. рис. 6.16).
Вообще же на практике обычно считают, что степень приближения к линии оптимальных температур удовлетворительная, если для реактора выполняется условие
wr ≥ 0,8 wopt. (6.31)
На графике хА(Т)две линии, соответствующие условию wrA=0,8wrAopt, проходят выше и ниже линии оптимальных температур, образуя область оптимальных температур, удовлетворяющую условию (6.31). При построении области оптимальных температур следует иметь в виду, что верхняя ограничивающая линия находится ниже равновесной кривой хА,е(Т). При выборе конструкции реактора и режима его работы стремятся к тому, чтобы большая часть рабочей линии процесса находилась внутри области оптимальных температур. Такому условию отвечают, в частности, рабочие линии на рис. 6.15, в и6.16, б.
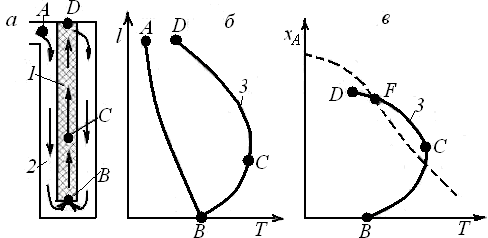
Рис. 6.15. Реактор с теплообменной трубкой (а),температурный профиль по длине реактора (б)и зависимость степени превращения от температуры (в):
1 – реактор; 2 – теплообменная трубка; 3 – кривая изменения температуры по длине реактора (рабочая линия); штриховая линия – линия оптимальных температур
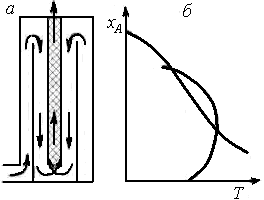
Рис. 6.16. Реактор с двойными теплообменными трубками (а)
и профиль температур в нем (б)
Сравнительно простым способом приближения к оптимальному режиму является проведение процесса в многосекционном реакторе вытеснения, в котором каждая секция работает в адиабатическом режиме, и между секциями имеется промежуточное охлаждение (рис. 6.17, а). На рис. 6.17, б показано, как будет проходить рабочая линия процесса в таком реакторе.
В секции 1 реактора (рис. 6.17, а)процесс протекает адиабатически, причем изменения температуры и степени превращения связаны между собой уравнением (6.23).
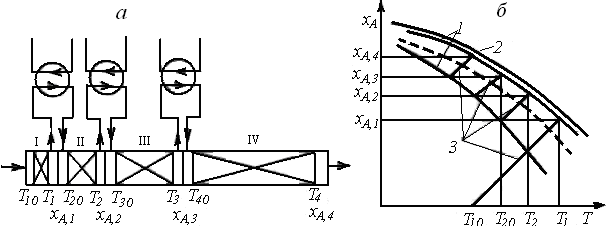
Рис. 6.17. Многосекционный реактор вытеснения с промежуточным отводом теплоты (а) и зависимости хА(Т),характеризующие процесс в нем (б):
1 – линии, отвечающие условию wrA = 0,8wrAopt; 2 – равновесная кривая;
3 – рабочая линия процесса; штриховая линия – линия оптимальных
температур (wrA = wrAopt)
Объем секции должен быть таким, чтобы на выходе из нее достигалась степень превращения хА,1, соответствующая пересечению адиабаты с верхней границей области оптимальных температур. Необходимое значение объема (или среднего времени пребывания) можно найти из решения системы уравнений материального и теплового балансов такого реактора.
На выходе из секции I реакционную смесь необходимо охладить от температуры T1 до температуры Т20,соответствующей нижней границе оптимальной области при хА = хА,1. Затем реакционная смесь попадает в адиабатическую секцию II, второй теплообменник, секцию III и т. д. Так как скорость реакции по мере увеличения степени превращения уменьшается, объем каждой последующей секции возрастает.
Охлаждение реагентов между секциями адиабатического реактора можно вести не только косвенным теплообменом, но и введением свежей холодной реакционной смеси (см. рис. 6.18, а). В общем случае добавление к уже частично прореагировавшей смеси свежих реагентов изменяет их концентрацию и может привести к смещению равновесия. Положение линии оптимальных температур зависит и от положения равновесной кривой, следовательно, изменение равновесного состава несколько сместит и положение линии оптимальных температур (рис. 6.18, б).
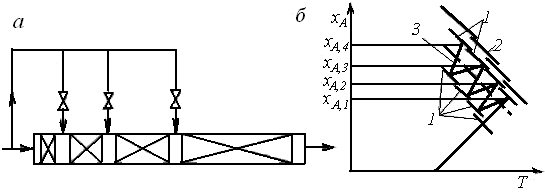
Рис. 6.18. Многосекционный реактор вытеснения
с байпасными линиями ввода холодного газа между секциями (а)
и зависимости хА(Т),характеризующие процесс в нем (б)
(обозначения те же, что и на рис. 6.17)
Возможным вариантом осуществления процесса по оптимальному температурному режиму является и применение каскада реакторов смешения, в каждом из которых поддерживается своя температура благодаря введению теплообменных поверхностей (рис. 6.19, а). Задавшись температурой Т1,а следовательно, и степенью превращения в первой секции хА,1,соответствующей верхней границе области оптимальных температур, можно рассчитать необходимый объем первой секции, рассматривая ее как реактор, работающий при постоянной температуре. Аналогично могут быть рассчитаны вторая и третья секции. Уравнение теплового баланса для таких реакторов позволит определить необходимую поверхность теплообмена и расход хладагента для поддержания в секциях температур, заданных рабочей линией процесса (рис. 6.19, б).
Для каждого из рассмотренных вариантов возможна дальнейшая оптимизация процесса – расчет оптимальных объемов секций, начальных температур, объемных расходов в байпасных линиях и т. д. При такой оптимизации стремятся получить наиболее целесообразные экономические показатели процесса. Более подробно вопросы оптимизации, ее методы рассмотрены в специальной литературе.
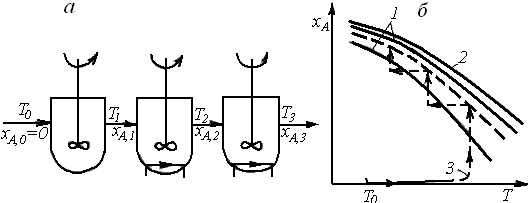
Рис. 6.19. Схема каскада реакторов идеального смешения с отводом теплоты в секциях каскада (а) и зависимости хА(Т),характеризующие процесс в нем (б)(обозначения те же, что и на рис. 6.17)
|
|
|
 Скачать 1.75 Mb.
Скачать 1.75 Mb.