Александр Степанович Попов. Изобретение радио. Общая и неорганическая химия Основные понятия и законы химии
 Скачать 165.13 Kb. Скачать 165.13 Kb.
|
|
01.06.Химические реакции. 01.06.01.Формулы веществ, между которыми наибольшая скорость при комнатной температуре. Zn и H2SO4 Na и H2O Fe и О2 СuSO4 (раствор) и КОН (раствор) Ответ: 4) 01.06.02.Формулы веществ, между которыми наименьшая скорость при комнатной температуре. Zn и H2SO4 Na и H2O Fe и О2 СuSO4 (раствор) и КОН (раствор) Ответ: 3) 01.06.03.С наименьшей скоростью при комнатной температуре протекает реакция между соляной кислотой и металлом. Цинком Магнием Свинцом Железом Ответ: 3) 01.06.04.С наибольшей скоростью при комнатной температуре протекает реакция между соляной кислотой и металлом Цинком Магнием Свинцом Железом Ответ: 2) 01.06.05.Вещества, задерживающие скорость химической реакции Катализаторы Ферменты Катализ Ингибиторы Ответ: 4) 01.06.06.Обратимая реакция. Н2 + Br2 = 2НВr AgNO3 + KCl = AgCl + KNO3 Na2CO3 + 2HI = H2O + CO2 + 2NaI H2SO4 + Mg(OH)2 = MgSO4 + 2H2O Ответ: 1) 01.06.07.Необратимая реакция. 2НI = I2 + H2 CaCl2 + 2NaBr = CaBr2 +2NaCl K2CO2 + H2SO4 = K2SO4 +H2O + CO2 2SO2 + O2 = 2SO3 Ответ: 3) 01.06.08. В равновесной системе FeO + H2 = Fe + H2O(г) – 23 кДж/моль равновесие сместилось в сторону продуктов реакции. При повышении давлении Повышении температуры Понижении температуры Понижения давления Ответ: 2) 01.06.09.Реакции, при которых из двух и более веществ образуется одно сложное Разложения Соединения Обмена Полимеризации Ответ: 2) 01.06.10.Наука о закономерностях протекания химических реакций по времени Химическая кинематика Химическая кинетика Химический анализ Физическая химия Ответ: 2) 01.06.11.Установите соответствие между химической реакцией и ее типом. Si + O2 = SiO2 А) разложение HCl + NaOH = NaCl + H2O Б) замещение CuSO4 + Zn =ZnSO4 +Cu В) обмен NH4NO3 = N2 +2H2O Г) соединение Ответ: 1Г, 2В, 3Б, 4А 01.06. 12.Растворение цинка в соляной кислоте будет происходить быстрее. Повысить температуру Увеличить концентрацию Понизить температуру Раздробить цинк Ответ: 1), 2), 4) 01.06.13. Факторы, влияющие на скорость химической реакции 1)Температура 2)Действие катализаторов 3)Энергия активации 4)Концентрация реагирующих веществ Ответ: 1), 2), 4) 01.06.14.Скорость любой химической реакции зависит: 1) от давления 3) от площади соприкосновения реагирующих веществ 2) от температуры 4) от всех перечисленных факторов Ответ: 3) 01.06.15.Реакция, скорость которой зависит от площади поверхности соприкосновения реагирующих веществ, - это … 1) нейтрализация серной кислоты раствором гидроксида натрия 2) горение водорода в кислороде 3) взаимодействие растворов хлорида меди и гидроксида калия 4) горение алюминия в кислороде Ответ: 4) 01.06.16. Обратимой является реакция, уравнение которой: 1) NaOH + HCl→ NaCl + H2O 2) H2 + I2→ 2HI 3) C + O2→ CO2 4) CaCO3 + 2HCl →CaCl2 + H2O + CO2 Ответ: 2) 01.06.17.С наибольшей скоростью при обычных условиях взаимодействуют: 1) цинк и соляная кислота 2) натрий и вода 3) магний и вода 4) свинец и соляная кислота Ответ: 3) 01.06.18.Химические процессы, в результате которых образуются новые вещества – это _________________________________. Ответ: химические реакции 01.06.19.По тепловому эффекту реакции делятся на ___________________________. Ответ: эндотермические и экзотермические 01.06.20.Состояние системы, при котором скорость прямой реакции равна скорости обратной реакции – это _______________________. Ответ: химическое равновесие 01.06.21.Растворение цинка в соляной кислоте будет замедляться в случае _______. Ответ: понижения температуры 01.06.22.Наибольшая скорость реакции будет при взаимодействии цинка с раствором серной кислоты, в котором массовая доля кислоты составляет __________%. Ответ: 20 01.06.23.Если в химической реакции А + В =С увеличить концентрацию вещества А в 2 раза и концентрацию вещества В в 3 раза, то скорость реакции _________. Ответ: увеличится в 6 раз 01.06.24.Изменение скорости реакции под действием катализатора называется __________________________. Ответ: катализом 01.06.25.Принцип, с помощью которого можно предсказать направление смещения равновесия Ответ: принцип Ле Шателье 01.06.26.При повышении температуры на 10° скорость некоторой реакции увеличится в 2 раза. При температуре 30°С скорость реакции – 0,2 моль/(л*мин), а при температуре 50°С - ______________________. Ответ: 0,8 01.06.27.Если концентрацию водорода увеличить в 3 раза, то скорость реакции 3Н3 + N2 = 2NН3 увеличится в ______ раз. Ответ: 27 01.06.28.Если температурный коэффициент равен 3 и температура увеличилась с 20° до 50°С, то скорость реакции _______________________________. Ответ: возрастет в 27 раз 01.06.29. Реакция ионного обмена идет до конца, если в результате реакции образуется: 1) нерастворимое вещество 2) газообразное вещество 3) малодиссоциирующее вещество 4) во всех этих случаях Ответ: 4) 01.06.30.С наибольшей скоростью при обычных условиях взаимодействуют 1) азот и водород 2) магний и вода 3) раствор гидроксида натрия и соляная кислота 4) сера и железо Ответ: 4) 01.06.31.Гетерогенной реакцией обмена является: 1) взаимодействие гидроксида цинка с водным раствором оксида натрия 2) взаимодействие соляной кислоты с водным раствором оксида бария 3) взаимодействие водных растворов фосфорной кислоты и гидроксидом калия 4) взаимодействие водных растворов нитрата бария и сульфата натрия Ответ: 1) 01.06.32.На скорость химической реакции между раствором серной кислоты и железом не оказывает влияния 1) концентрация кислоты 2) измельчение железа 3) температура реакции 4) увеличение давления Ответ: 1) 01.06.33.При обычных условиях с наименьшей скоростью происходит взаимодействие между:
Ответ: 3) 01.06.34. Химическое равновесие в системе 2NO(г) + O2 (г) 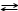 2NO2 (г) + Q 2NO2 (г) + Qсмещается в сторону образования продукта реакции при
Ответ: 1) 01.06.35. Реакция, уравнение которой Zn(OН)2 + H2SO4 = ZnSO4 + 2H2O, относится к реакциям
Ответ: 1) 01.06.36. Для увеличения скорости взаимодействия железа с хлороводородной (соляной) кислотой следует
Ответ: 4) 01.06.37.Изменение давления смещает равновесие в системе
Ответ: 1) 01.07.Металлы и неметаллы. 01.07.01.Группа элементов, содержащих только металлы Li, Be, B K, Ca, Sr H, Na, Cu Se, Te, Po Ответ:2) 01.07.02.Восстановительные свойства в ряду Ba-Sr-Ca-Mg Усиливаются Ослабевают Не изменяются Сначала усиливаются, затем ослабевают Ответ: 2) 01.07.03.Внешний энергетический уровень алюминия 3s23p1 3s23p2 3s24p1 4p3 Ответ: 1) 01.07.04.Металл, легко подвергаемый химической коррозии Никель Хром Железо Олово Ответ: 3) 01.07.05.Веществ, используемое в качестве восстановителя для получения чистого вольфрама Магний Алюминий Водород Углерод Ответ: 3) 01.07.06.Пара, образуемая самый легкий и самый тяжелый металл Al, Fe Na, Pt Li, Os Mg, Pb Ответ: 3) 01.07.07.Вещества, с которыми может реагировать кальций Сера и гидроксид натрия Вода и кислород Углерод и магний Хлорид калия и серная кислота Ответ: 2) 01.07.08.Способ получения в промышленности железа Гидрометаллургический метод Электролиз расплава оксида железа(III) Пирометаллургический метод Электролиз раствора хлорида железа(III) Ответ: 3) 01.07.09.Гидроксид, проявляющий наиболее сильные основные свойства Алюминия Магния Натрия Калия Ответ: 4) 01.07.10.Вещество, с которым не взаимодействует оксид кальция Серная кислота Гидроксид натрия Оксид углерода(IV) Вода Ответ: 2) 01.07.11.Металлы относящиеся к легким и тяжелым характеризуются свойством: 1)теплопроводностью 2)твердостью 3)плотностью 4)пластичностью Ответ: 3) 01.07.12.Коррозия протекающая c растворами электролитов при температуре называется: 1)химическая 2)атмосферная 3)почвенная 4)морская Ответ: 1) 01.07.13.Сплав никеля, хрома и алюминия, обладающий большой электропроводностью и жаропрочностью называется: 1)латунь 2)дюралюминий 3)бронза 4)нихром Ответ: 4) 01.07.14.Неметаллом является: 1) таллий; 2) тантал; 3) хром; 4) хлор. Ответ: 2) 01.07.15.Общим физическим свойством металлов не является: 1) тугоплавкость; 2) пластичность; 3) высокая электропроводность; 4) блеск. Ответ: 4) 01.07.16.Самый легкий и самый тяжелый металл образуют пару: 1) Al, Fe; 2) Na, Pt; 3)Li,Os; 4)Mg,Pb. Ответ: 3) 01.07.17.Свойства металлов, связанных с высокой подвижностью свободных электронов, сталкиваясь с колеблющимися в узлах решетки ионами, электроны обмениваются с ними энергией называется: 1)теплопроводность 2)твердость 3)плотность 4)пластичность Ответ: 1) 01.07.18.Самопроизвольное разрушение металлов называется: 1)электролиз 2)гидролиз 3)коррозия 4)сплав Ответ: 3) 01.07.19.Металл, имеющий конфигурацию валентных электронов 3d14s2 – это _________. Ответ: скандий 01.07.20.В ряду элементов Li-Na-K-Rb восстановительные свойства __________________. Ответ: усиливаются 01.07.21.Кальций имеет конфигурацию валентных электронов _______________________. Ответ: 3d104s2 01.07.22.Для протекторной защиты стального корпуса корабля от коррозии нельзя использовать ____________________. Ответ: медь 01.07.23.Железная конструкция будет защищена от электрохимической коррозии в воде, если на ней укрепить пластину из _______________. Ответ: магния 01.07.24.Основные свойства в ряду Сr(OH)2-Cr(OH)3-H2CrO4________________________/ Ответ: ослабевают 01.07.25.Общие физические свойства металлов 1)Тугоплавкость 2)Пластичность 3)Высокая теплопроводность 4)Блеск Ответ: 2), 3), 4) 01.07.26.Вещества, с которыми не взаимодействует медь 1)Вода 2)Соляная кислота 3)Кислород 4)Хлорид цинка в растворе Ответ: 1), 2), 4) 01.07.27.Оксид, не взаимодействующий с водой 1)Оксид кальция 2)Оксид железа 3)Оксид меди 4)Оксид цинка Ответ: 2), 3), 4) 01.07.28.Амфотерным гидроксидом является Cr(OH)3 Al(OH)3 Mn(OH)2 BE(OH)2 Ответ: 1), 2), 4) 01.07.29.Свойства вещества изменять форму под внешним воздействием и сохранять принятую форму после прекращения этого воздействия называется: 1)теплопроводность 2)твердость 3)плотность 4)пластичность Ответ: 4) 01.07.30.Коррозия протекающая на поверхности металла под действием сконденсированной влаги называется: 1)химическая 2)атмосферная 3)почвенная 4)морская Ответ: 2) 01.07.31.Сплав меди с цинком, где Cu-57-60%, a Zn-40-43% называется: 1)латунь 2)дюралюминий 3)бронза 4)нихром Ответ: 1) 01.07.32.Неметаллом является: 1) кремний; 2) индий; 3) барий; 4) титан. Ответ: 1) 01.07.33. Самый легкий и самый тяжелый металл образуют пару: 1) Al, Fe; 2) Na, Pt; 3)Li,Os; 4)Mg,Pb. Ответ: 3) 01.07.34.Коррозия протекающая при контакте с грунтовыми водами называется: 1)химическая 2)атмосферная 3)почвенная 4)морская Ответ: 3) 01.07.35.Сплав, основу, которого составляет медь с металлами соответствующих названием называется: 1)латунь 2)дюралюминий 3)бронза 4)нихром Ответ: 4) 01.07.36.Температура плавления цезия 29 градусов, поэтому он относится: 1)тугоплавким 2)легким 3)тяжелым 4)легкоплавким Ответ: 1) 01.07.37.Неметаллом является: 1) берилий; 2) бром; 3) кобальт; 4) молибден. Ответ: 2) 01.07.38.Ртуть в отличие от остальных металлов при обычных условиях не обладает свойством: 1) теплопроводности; 2) металлического блеска; 3) электропроводности; 4) твердого состояния. Ответ: 4) 01.07.39.Свойства металлов, связанных с высокой подвижностью свободных электронов, сталкиваясь с колеблющимися в узлах решетки ионами, электроны обмениваются с ними энергией называется: 1)теплопроводность 2)твердость 3)плотность 4)пластичность Ответ: 1) 01.07.40.Самопроизвольное разрушение металлов называется: 1)электролиз 2)гидролиз 3)коррозия 4)сплав Ответ: 3) 01.07.41.Сплав на основе алюминия, который по прочности равен стали, но легче ее в 3 раза называется: 1)латунь 2)дюралюминий 3)бронза 4)нихром Ответ: 2) 01.07.42.Неметаллом является: 1) литий; 2) висмут; 3) йод; 4) олово. Ответ: 3) 01.07.43. Железо в отличие от многих металлов обладает свойством: 1) пластичности; 2) притягивается магнитом; 3) электропроводности; 4) имеет серый цвет. Ответ: 2) 01.07.44.Неметаллом является: 1) никель 3) стронций 2) цинк 4) йод Ответ: 4) 01.07.45. Жидкое агрегатное состояние (при комнатной температуре) имеет 1) калий 3) сера 2) ртуть 4) азот Ответ: 2) 01.07.46.Твердое агрегатное состояние (при комнатной температуре) имеет 1) ртуть 3) бром 2) хлор 4) алюминий Ответ: 4) 01.07.47.Жидкое агрегатное состояние (при комнатной температуре) имеет 1) кальций 3) бром 2) кислород 4) фосфор Ответ: 3) 01.07.48. Твердое агрегатное состояние (при комнатной температуре) имеет 1) азот 3) магний 2) бром 4) фтор Ответ: 3) 01.07.49. В порядке уменьшения восстановительных свойств металлы расположены в ряду:
Ответ: 1) 01.07.50. Верны ли следующие суждения о неметаллах? А. Все неметаллы являются химически активными веществами. Б. Все неметаллы обладают только окислительными свойствами.
Ответ: 4) 01.07.51. Химическая реакция возможна между:
Ответ: 4) 01.07.52. Какой из металлов не вытесняет водород из разбавленной серной кислоты?
Ответ: 3) 01.07.53. Оксиды с общей формулой R2O3 и R2O5 образуют элементы подгруппы
Ответ: 2) 01.07.54. Наиболее энергично реагирует с водой
Ответ: 4) 01.07.55.Водород проявляет свойства окислителя при взаимодействии с
Ответ: 3) 01.07.56. При нагревании оксида железа (II) с оксидом углерода (II) образуются углекислый газ и
Ответ: 1) 01.07.57. При нагревании гидроксида меди (II) образуются
Ответ: 3) |
